2. 锦州医科大学病原微生物教研室
据报道,呼吸系统疾病一直占据着中国公共卫生支出的较大比例,而呼吸系统感染是最常见的引起急性呼吸系统疾病和慢性呼吸系统疾病急性发作的原因,随着抗生素的普遍应用,细菌感染所致的呼吸系统疾病得到越来越有力的控制,而病毒感染所占比例则不断攀升,目前有 > 90 % 的急性呼吸道感染均为病毒感染所致 [1]。由于病毒感染性疾病具有发病率高、传播快、流行广、病原体易变异等特点[2],近年一些新兴病毒的感染引起了人们的广泛关注。呼肠孤病毒是一种双链RNA病毒,正常情况下,哺乳动物呼肠孤病毒(mammalian orthoreovirus,MRV)十分常见,可引起人类无症状的感染;禽呼肠孤病毒(avian orthoreovirus,ARV)、狒狒呼肠孤病毒(baboon orthoreovirus,BRV)等的感染虽可引起严重的动物疾病,但不会引起人类疾病[3]。然而,2006年在马来西亚一名急性呼吸道患者身上分离出了一种新的呼肠孤病毒,命名为Melaka病毒,该病毒与澳大利亚和马来西亚果蝠中分离的呼肠孤病毒的亚型纳尔逊海湾病毒(Nelson Bay orthoreovirus,NBV)基因相关[4],随后又有许多NBV病毒从马来西亚和香港的严重呼吸系统疾病患者中分离出来[3,5],NBV已经进化成为一种可以引起人类疾病的病原体。本研究应用2007年从印度尼西亚巴厘岛返回日本的呼吸道感染患者身上分离出的NBV病毒株(Miyazaki-Bali/2007)[4,6],采用免疫沉淀及蛋白质谱的方法对能够和NBV病毒M3基因编码的非结构蛋白 μNS互作用并参与形成包涵体样结构的宿主蛋白进行了初步筛选及鉴定,旨在为呼肠孤病毒药物的开发提供参考依据。
1 材料与方法 1.1 主要试剂及仪器达尔伯克氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)、减血清培养基(optiminimum essential medium,Opti-MEM)、山羊抗兔FITC-488及转染试剂lipofectmine 2 000(invitrogen中国分公司),苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)(北京索莱宝生物科技有限公司),兔抗M3多克隆抗体由锦州医科大学病原微生物实验室制备,山羊抗兔辣根过氧化物酶标记的二抗(北京中杉金桥生物技术有限公司),血凝素(hemagglutinin,HA)抗性免疫磁珠(美国Sigma公司),银染试剂盒、ECL发光液(上海碧云天生物技术有限公司),pEFHAMBM3(pEFHAMBM3为构建好的含有呼肠孤病毒M3基因片段的质粒)及NBV Miyazaiki-Bali病毒由日本大阪大学微生物病研究所病毒免疫研究室小林刚教授惠赠。DMI4000B荧光显微镜(德国Leica公司),Acclaim PepMap RSLC 5分析柱(美国Thermo scientific),Q-Exactive plus质谱仪(美国Thermo scientific公司)。
1.2 细胞培养、转染及分组将293 T细胞株(美国模式培养物集存库)培养于含8 % 胎牛血清的高糖DMEM培养基中,以3 × 106/板的密度接种在6 cm细胞培养板上。将10 μg pEFHAMBM3及pEFHA质粒分别与200 μL Opti-MEM培养基混合5 min,将25 μL转染试剂与200 μL Opti-MEM培养基混合5 min,再将稀释好的质粒及转染试剂混合,室温孵育20 min后,添加到细胞培养基中。然后将细胞在37 ℃下温育4~6 h,更换有血清培养基,继续37 ℃下温育24~48 h。实验组细胞转染pEFHAMBM3质粒,对照组细胞转染pEFHA质粒。
1.3 免疫荧光感染病毒前1 d将L929细胞(美国模式培养物集存库)接种于带有细胞爬片的24孔板内,12 h后用NBV Miyazaki-Bali病毒感染L929细胞,48 h后细胞用磷酸盐缓冲液(phosphate buffer saline,PBS) – 4 % 多聚甲醛固定20 min,用PBS洗净后和 μNS抗血清孵育37 ℃ 1 h,用PBS冲洗3次后,细胞与FITC-488山羊抗兔IgG一起孵育37 ℃ 1 h,PBS洗3次,用DMI4000B荧光显微镜观察并获取图像。L929细胞转染pEFHAMBM3质粒48 h后也进行免疫荧光实验。
1.4 Western blot免疫印迹检测细胞内 μNS表达情况用PBS将细胞从培养皿上吹下,1 000 r/min离心3 min,弃上清,加入500 μL NP – 40细胞裂解液、5 μL苯甲基磺酰氟4 ℃摇动1 h裂解细胞,5 000 r/min离心5 min,取上清液。取20 µL上清液加入10 µL 2 × sample,106 ℃加热10 min,静置为室温后取实验组和对照组各10 μL、20 μL蛋白样品进行聚丙烯酰胺凝胶电泳,结束后20 V电转印至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。使用5 % 的脱脂牛奶封闭液中室温封闭1 h,稀释 μNS抗血清,4 ℃孵育过夜。PBS洗膜4次,加入稀释二抗37 ℃孵育1 h,洗膜,加入发光液曝光显影。
1.5 免疫沉淀收集对照组pEFHA组和实验组pEFHAMBM3组的细胞各1 × 107个,PBS洗涤2次,加入500 μL NP – 40细胞裂解液、5 μL 苯甲基磺酰胺于4 ℃摇动1 h,5 000 r/min离心5 min,取上清液,加入流感病毒HA标签的抗体磁珠20 μL,4 ℃摇床孵育过夜。用细胞裂解液洗涤沉淀4次,最后1次洗涤后,去除上清,加入20 μL 2 × 十二烷基硫酸钠 – 聚丙烯酰胺凝胶电泳(sodium-dodecyl sulphate-polyacrylamide gelelectrophoresis,SDS-PAGE)上样缓冲液重悬沉淀,瞬时高速离心;沸水浴10 min,取上清液 – 20 ℃保存。
1.6 SDS-PCAG凝胶电泳及镀银染色制胶上样,浓缩胶电泳电压为80 V,分离胶电泳电压为120 V电泳时间约1 h 30 min。镀银染色按照试剂盒快速银染说明书进行。
1.7 蛋白质谱分析将各样品蛋白胶内酶解,样品进行分离后上样到Acclaim PepMap RSLC 5分析柱分离。样品经色谱分离后用Q-Exactive plus质谱仪进行质谱分析,分析时长为60 min。
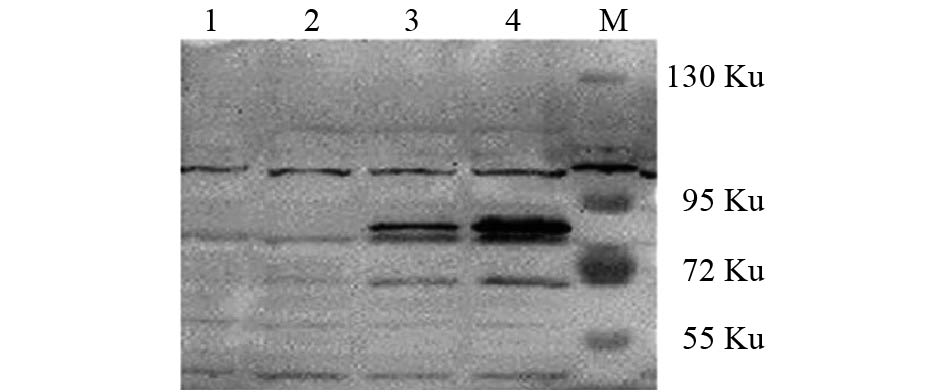
2 结 果 2.1 蛋白免疫印迹检测转染后细胞内 μNS的表达情况(图1)
|
注:M: Marker;1:10 μL对照组蛋白样本;2:20 μL对照组蛋白样本;3:10 μL实验组蛋白样本;4:20 μL实验组蛋白样本。 图 1 western blot 检测M3质粒转染 |
呼肠孤病毒 μNS蛋白分子量约为69 Ku,与胞内宿主因子结合后分子量增大,SDS-PAGE蛋白电泳显示72 Ku上有1条明显条带,与预期蛋白大小相符,可证实本实验成功得到 μNS蛋白及其互作蛋白。
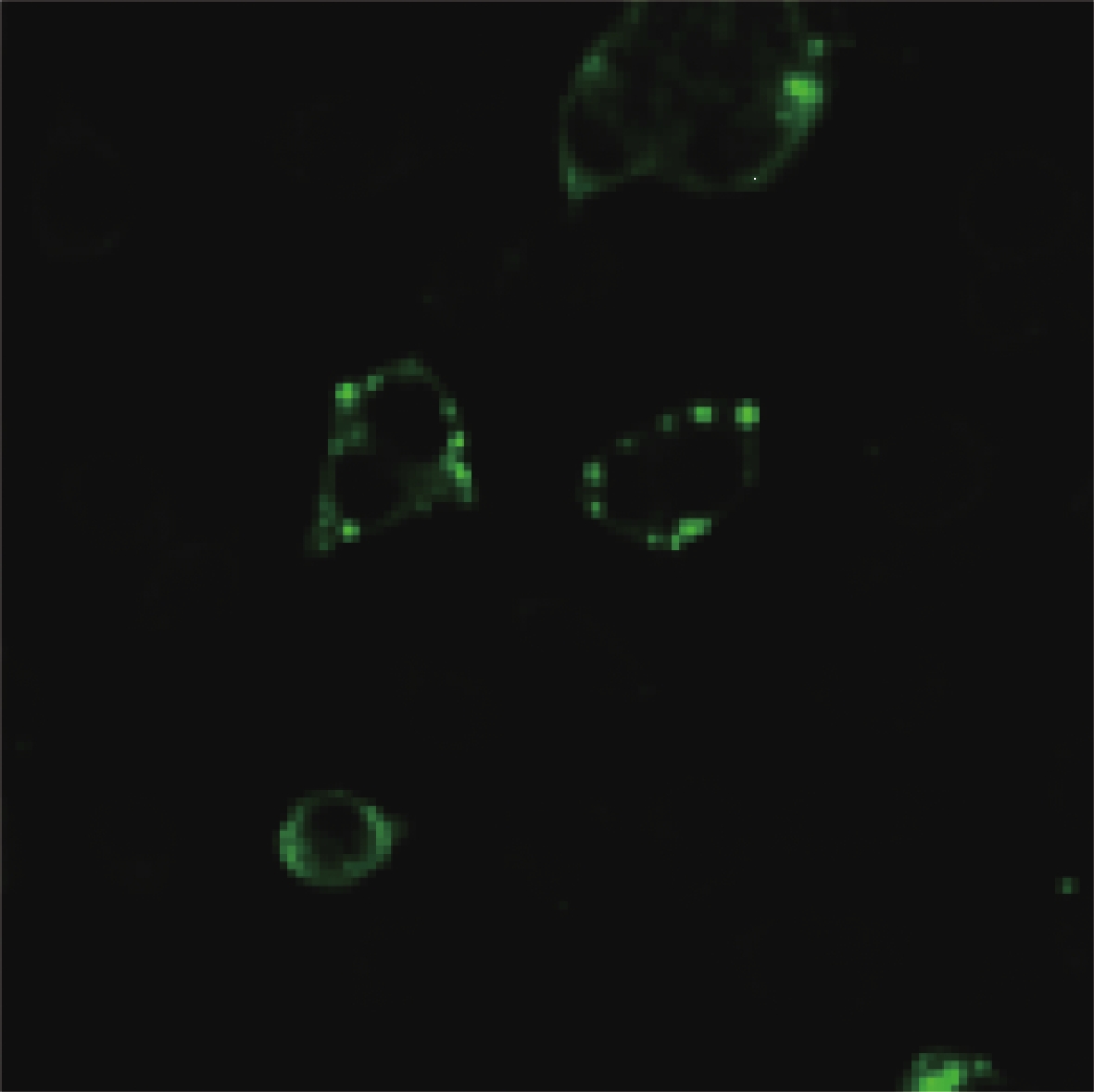
2.2 免疫荧光确认µNS蛋白在NBV病毒感染细胞及M3转染细胞中表达(图2、3)
|
图 2 NBV感染L929细胞形成包涵体结构 |

|
图 3 M3转染的L929细胞中NBV病毒 μNS的表达 |
L929细胞感染了pEFHAMBM3 24 h后,加4 % 多聚甲醛固定,和抗 μNS血清孵育进行免疫荧光检测。采用FITC488 – 标记的山羊抗兔抗体作为二次抗体,共聚焦显微镜观察 μNS蛋白在细胞内的表达,结果显示 μNS不仅可以在感染细胞内形成包涵体结构( 图2),同时也可以在单独转染M3质粒的细胞内形成类似的结构(图3),这样的结构可能由宿主因子和 μNS互作的参与而形成。
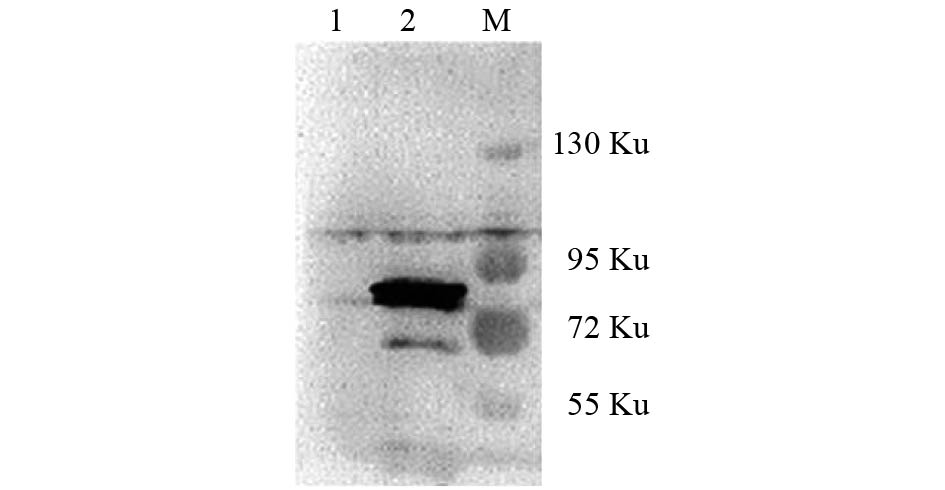
2.3 蛋白印迹检测免疫沉淀后 μNS的表达及其互作蛋白(图4)
|
注:M: Marker;1:20 μL对照组免疫沉淀后蛋白样本;2:20 μL实验组免疫沉淀后蛋白样本。 图 4 western blot 检测 μNS蛋白免疫沉淀后获得情况 |
将转染后所得蛋白样本进行免疫沉淀,用含有HA抗体的磁化珠子特异性沉淀出目的蛋白,同时和 μNS互作的蛋白也同时被沉淀下来。为保证免疫沉淀的实验结果,HA抗体磁珠加入前取20 µL进行蛋白印记检测,验证转染的情况,证实 μNS表达,结果可见 μNS有表达。
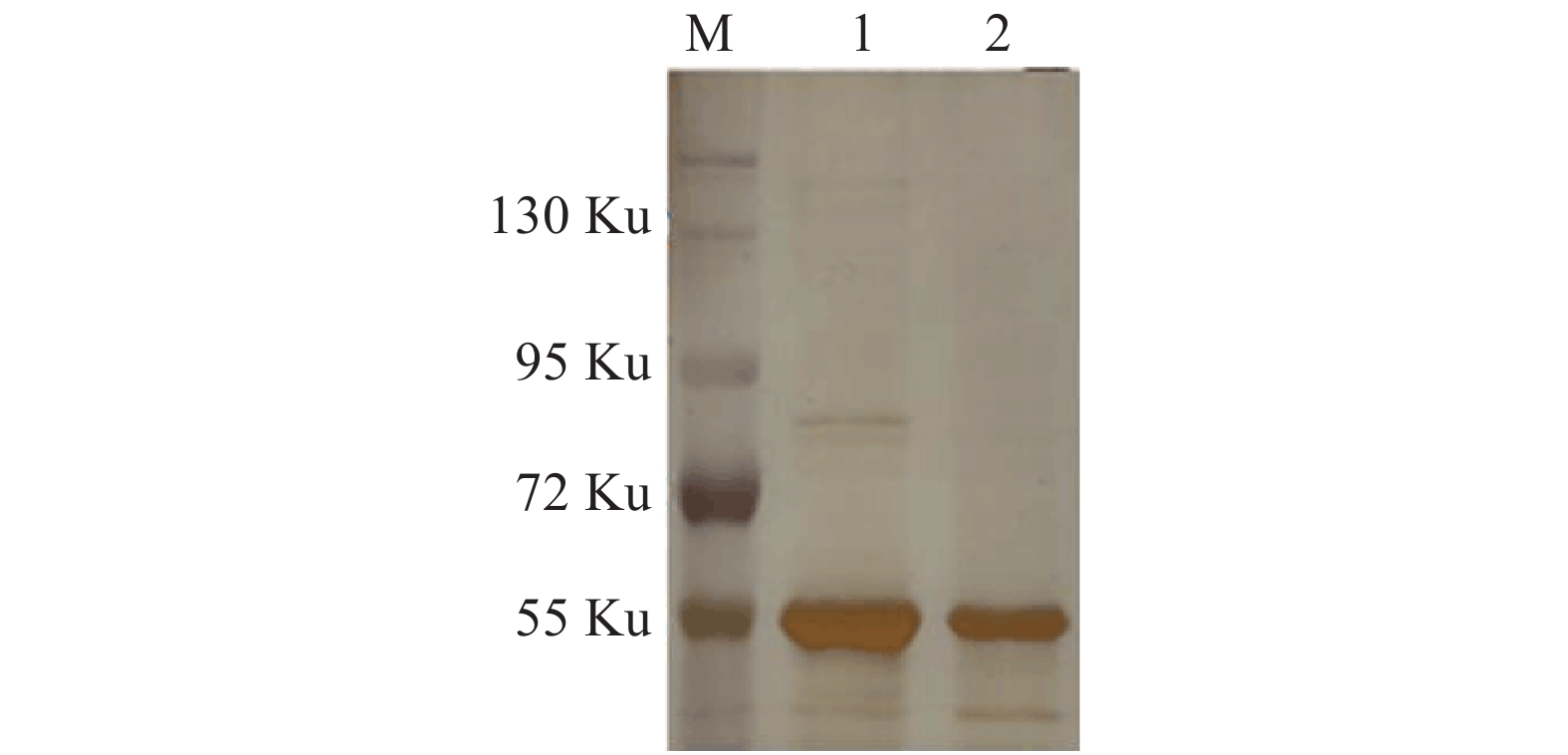
2.4 SDS-PAGE电泳镀银染色检测 μNS蛋白及其互作蛋白(图5)
|
注:M: Marker;1:20 μL实验组免疫沉淀后蛋白样本;2:20 μL对照组免疫沉淀后蛋白样本。 图 5 镀银染色检测 μNS蛋白及其互作蛋白 |
将免疫沉淀后的实验组样本及对照组样本各15 μL进行SDS-PAGE凝胶电泳,而后进行镀银染色,可见实验组与对照组相比有不同大小的蛋白条带显示。提示这些蛋白有可能是与 μNS互作的蛋白,同时有可能参与了包涵体的形成。在72 ku上有明显差异条带,与预期相符。
2.5 蛋白质定性检测(表1)| 表 1 实验组与对照组差异表达蛋白 |
将实验组及对照组蛋白样本分别进行蛋白质定性分析,结果显示,实验组表达的蛋白较对照组表达蛋白多了9种,可推测该9种宿主蛋白与病毒工厂的形成有密切关系。具体差异蛋白见表1。
3 讨 论呼肠孤病毒是一种无包膜双链RNA病毒,包含10个分段双链RNA,根据RNA的大小,将其分为大(L1~L3)、中(M1~M3)和小(S1~S4)3组。μNS蛋白是呼肠孤病毒一种主要的非结构蛋白,由M3基因片段编码,蛋白质大小为69 Ku,呼肠孤病毒感染的早期,在细胞质中形成一些小的点状结构[7],随着感染的继续,这些点状结构的大小逐渐增大并变得更多,这些结构被命名为“包涵体”,也可形象的称之为“病毒工厂”。呼肠孤病毒的复制和组装即发生在这种“病毒工厂”结构中。有研究证实,“病毒工厂”由双链RNA、相关的蛋白质和完全组装的颗粒组成[8],而形成“病毒工厂”的关键蛋白 μNS是M3基因片段翻译合成的蛋白质产物[9]。有研究证实病毒的非结构蛋白 μNS是形成“病毒工厂”结构所必需的蛋白,且 μNS蛋白在细胞内独自表达即可形成类似“病毒工厂”的结构[10]。病毒利用细胞的生物合成途径进行增殖,并通过形成“病毒工厂”的形式避免被细胞抗病毒反应消灭[11],尽管“病毒工厂”结构在不同病毒之间存在差异,但也具有基本的相似性。目前 μNS蛋白形成“病毒工厂”的研究绝大部分是针对MRV和ARV开展的,而人致病性呼肠孤病毒NBV的 μNS蛋白形成“病毒工厂”的能力至今尚未有报道。近年来,呼肠孤病毒的研究因其开始引起人类疾病而引起广泛关注,故呼肠孤病毒复制机制的研究也变得愈发重要。
病毒感染细胞的过程需要病毒和宿主组分的协同作用,同样,“病毒工厂”的形成也必定有宿主因子的参与,μNS蛋白作为“病毒工厂”的支架蛋白,可与多种蛋白相互作用从而完成病毒颗粒的组装,本研究通过免疫沉淀的方法特异性获得 μNS蛋白及与其结合的未知宿主蛋白,经蛋白免疫印迹法验证和蛋白质定性分析,对比实验组和对照组得到丝氨酸/苏氨酸蛋白激酶、精胺合酶、角蛋白14、线粒体Rho GTPase 1、组蛋白H2B、40S核糖体蛋白S4、核糖体蛋白L26、肌动蛋白 – 2和未表征的蛋白质共9种差异蛋白。其中,丝氨酸/苏氨酸蛋白激酶为三磷酸鸟苷(guanosine triphosphate,GTP)酶非常重要的一种效应物,在细胞的形态学、动力学及细胞转化的调控方面起着重要的作用。它能使底物蛋白中的丝氨酸或苏氨酸羟基磷酸化,通过催化多种功能蛋白(如,酶、受体、运输蛋白、调节蛋白、核内蛋白等)的磷酸化来调节病毒在细胞中的复制与装配。精胺合酶的功能是将亚精胺转化为精胺,反应物亚精胺和产物精胺对于正常的细胞生长都是必需的。角蛋白为中间纤维超家族的成员,主要存在于上皮细胞胞浆内,是构成细胞骨架的重要成分,按照分子量大小和等电点不同可将角蛋白分成许多组分,其中分子量为50 × 10 3的角蛋白14(keratin14,K14)主要分布在表皮的基底层细胞内,对维持细胞的形态及完整性有非常重要的作用。组蛋白H2B为构成核小体的成分,在转录延伸过程中可多次进行泛素化及去泛素化,由于其常分布于细胞核中,可能并未真正参与“病毒工厂”的形成。目前对于这些蛋白是如何在病毒的复制装配中起到作用尚不清楚,本实验研究仅为呼肠孤病毒的复制装配机制提供了最初步的实验依据,这些候选蛋白中的1种或几种是否在病毒复制过程中起到作用及起到何种作用尚有待于进一步深入研究。
| [1] | 于伟, 孙海波, 田疆. 一起腺病毒感染暴发疫情分子流行特征分析[J]. 中国公共卫生, 2014, 30(7): 972–974. |
| [2] | 孙海波, 于伟, 王璐璐, 等. 辽宁省发热伴呼吸道症候群病原谱及流行特征[J]. 中国公共卫生, 2017, 33(6): 997–1000. |
| [3] | Chua KB, Voon K, Yu M, et al. Investigation of a potential zoonotic transmission of orthoreovirus associated with acute influenza-like illness in an adult patient[J]. PLoS One, 2011, 6(10): e25434. DOI:10.1371/journal.pone.0025434 |
| [4] | Yamanaka A, Iwakiri A, Yoshikawa T, et al. Imported case of acute respiratory tract infection associated with a member of species Nelson Bay orthoreovirus[J]. PLoS One, 2014, 9(3): e92777. DOI:10.1371/journal.pone.0092777 |
| [5] | Wong AH, Cheng PK, Lai MY, et al. Virulence potential of fusogenic orthoreoviruses[J]. Emerging Infectious Diseases, 2012, 18(6): 944–948. |
| [6] | Singh H, Yoshikawa T, Kobayashi T, et al. Rapid whole genome sequencing of Miyazaki-Bali/2007 Pteropine orthoreovirus by modified rolling circular amplification with adaptor ligation - next generation sequencing[J]. Scientific Reports, 2015, 5: 16517. DOI:10.1038/srep16517 |
| [7] | Bussiere LD, Choudhury P, Bellaire B, et al. Characterization of a replicating mammalian orthoreovirus with tetracysteine tagged μNS for live cell visualization of viral factories[J]. Journal of Virology, 2017, 91(22): JVI. 01371–17. |
| [8] | Miller CL, Arnold MM, Broering TJ, et al. Localization of mammalian orthoreovirus proteins to cytoplasmic factory-like structures via nonoverlapping regions of microNS[J]. Journal of Virology, 2010, 84(2): 867–882. DOI:10.1128/JVI.01571-09 |
| [9] | Busch LK, Rodriguez-Grille J, Casal JI, et al. Avian and mammalian reoviruses use different molecular mechanisms to synthesize their {micro}NS isoforms[J]. The Journal of General Virology, 2011, 92(Pt 11): 2566–2574. |
| [10] | Haatveit HM, Nyman IB, Markussen T, et al. The non-structural protein μNS of piscine orthoreovirus (PRV) forms viral factory-like structures[J]. Veterinary Research, 2016, 47(1): 1–11. DOI:10.1186/s13567-015-0288-7 |
| [11] | Fernández de Castro I, Zamora PF, Ooms L, et al. Reovirus forms neo-organelles for progeny particle assembly within reorganized cell membranes[J]. MBio, 2014, 5(1): e00931–13. |
 2019, Vol. 35
2019, Vol. 35


