氯霉素是一种广谱抗生素,对大多数革兰阳性菌和阴性菌均有良好的抑制作用,对部分衣原体、立克次体和某些原虫也有一定的抑制作用。氯霉素常用于水产集约化养殖引起的病害防治,在海水养殖中,氯霉素还被认为是抑制对虾病原弧菌作用最强的药物,但氯霉素同时能作用于人体线粒体而引起人的再生障碍性贫血、粒状白细胞缺乏症等疾病, 许多发达国家相继禁止或严格限制使用氯霉素。欧盟规定动物源食品中氯霉素残留的最低执法限量(minimum required performance limit,MRPL)为0.3 μg/kg[1];我国2002年出台《食品动物禁用的兽药及其它化合物清单》(193号公告)[2],将氯霉素列入禁用清单,禁止在所有食品动物上使用。氯霉素残留的检测研究多集中在鱼、虾、贝类等水产品基质[3 – 4],而养殖水体中氯霉素残留研究较少。本研究通过建立养殖水中氯霉素的超高效液相色谱 – 串联质谱(ultra performance liquid chromatography/tandemmass spectrometry, UPLC/MS/MS)检测方法并对养殖、运输和销售等环节的养殖水中的氯霉素残留进行监测,旨在为溯源水产品中氯霉素的引入途径,了解氯霉素的非法添加状况提供技术支持。
1 材料与方法 1.1 主要试剂与仪器甲醇、乙酸乙酯(色谱纯,美国Merck公司);氯霉素标准品(chloramphenicols,CAS号:56-75-7,CAP)、氘代氯霉素标准品(chloramphenicols-D5)(德国Dr.公司)。超高压液相色谱 –三重四级杆串联质谱仪(I-class液相色谱系统,XEVO TQ-XS质谱系统配电喷雾离子源)、液相色谱柱(ACQUITY, BEH C18, 1.7 μm, 2.1 mm × 100 mm)(美国Waters公司);玻璃微纤维滤纸(美国Whatman公司);0.22 μm滤膜(上海安谱公司)。
1.2 标准溶液配制 1.2.1 标准溶液储备液配制精密称取氯霉素标准品0.010 g,用甲醇溶解稀释并定容到10.0 mL,配制成浓度为1.0 mg/mL的标准储备液。
1.2.2 标准溶液中间液配制将氯霉素标准储备液用甲醇逐级稀释配制成浓度为10.0 ng/mL的氯霉素标准溶液中间液。
1.2.3 内标溶液用甲醇溶液将氯霉素 – D5标准品稀释配制成浓度为20 ng/mL的内标溶液。
1.3 水样前处理水样摇匀,用玻璃微纤维滤纸过滤,准确量取50 mL过滤后的水样,倒入100 mL分液漏斗中,加入10.0 μL的氘代氯霉素标准使用液,分别用10 mL乙酸乙酯分2次萃取,合并萃取液于100 mL鸡心瓶中,50 ℃水浴下旋转蒸发、浓缩至干;准确加入1.0 mL 10 %的甲醇水溶液复溶,漩涡振荡1 min复溶,复溶液经0.22 μm的滤膜过滤,待测。
1.4 UPLC/MS/MS工作条件 1.4.1 色谱条件色谱柱:Waters ACQUITY,UPLC®,BEH C18,1.7 μm,2.1 mm × 100 mm;柱温:40 ℃;进样量:5 μL;流动相A:水,流动相B:甲醇,线性梯度洗脱条件:0~0.2 min,B:10 %;0.2~2.8 min,B:10 %~90 %;2.8~3.9 min,B:90 %:3.9~4.0 min,B:90 %~10 %;流速: 0.25 mL/min。
1.4.2 质谱条件(表1)| 表 1 质谱条件 |
电离方式:电喷雾离子源,负离子;监测模式:多反应监测(multiple reaction monitoring, MRM);毛细管电压:3.0 kV;脱溶剂气流速:600 L/h;锥孔气流速:150 L/h;脱溶剂气温度:500 ℃。
1.4.3 标准工作曲线10.0 ng/mL氯霉素标准溶液中间液用10 %甲醇溶液分别稀释配制成浓度为0.010、0.050、0.100、0.200和0.500 ng/mL,内标浓度为0.200 ng/mL标准系列溶液;取10 μL标准系列溶液进样分析,以测得的氯霉素峰面积对内标化合物峰面积的比值,分别对氯霉素(ng/mL)的浓度绘制标准曲线。
1.5 养殖水中氯霉素残留情况调查养殖水样本155份,采样点覆盖福建省9地市及平潭实验区,涵盖水产品养殖、运输、批发零售和餐饮等环节。水样按1.3处理后,采用UPLC/MS/MS法检测氯霉素残留量。
2 结 果 2.1 液相色谱串联质谱定性(图1、2)采用MRM扫描模式,得到氯霉素(浓度为0.010 ng/mL)和氘代氯霉素混标溶液(浓度为0.200 ng/mL)的质谱图(图1)。氯霉素在液相色谱中出峰时间为2.95 min,母离子(m/z = 321)产生2个主要子离子(m/z = 152、257),以丰度最大的子离子152为定量离子,子离子257为定性离子;以氘代氯霉素(母离子m/z为326,子离子m/z为157)为内标物,内标法定量。由于氯霉素的定性离子有干扰峰,影响丰度比的计算,在液相色谱分离上应调整流动相梯度比例使得干扰物质和氯霉素得到分离,阴性养殖水样氯霉素和氘代氯霉素质谱图见图2。

|
图 2 阴性养殖水样氯霉素和氘代氯霉素质谱图 |
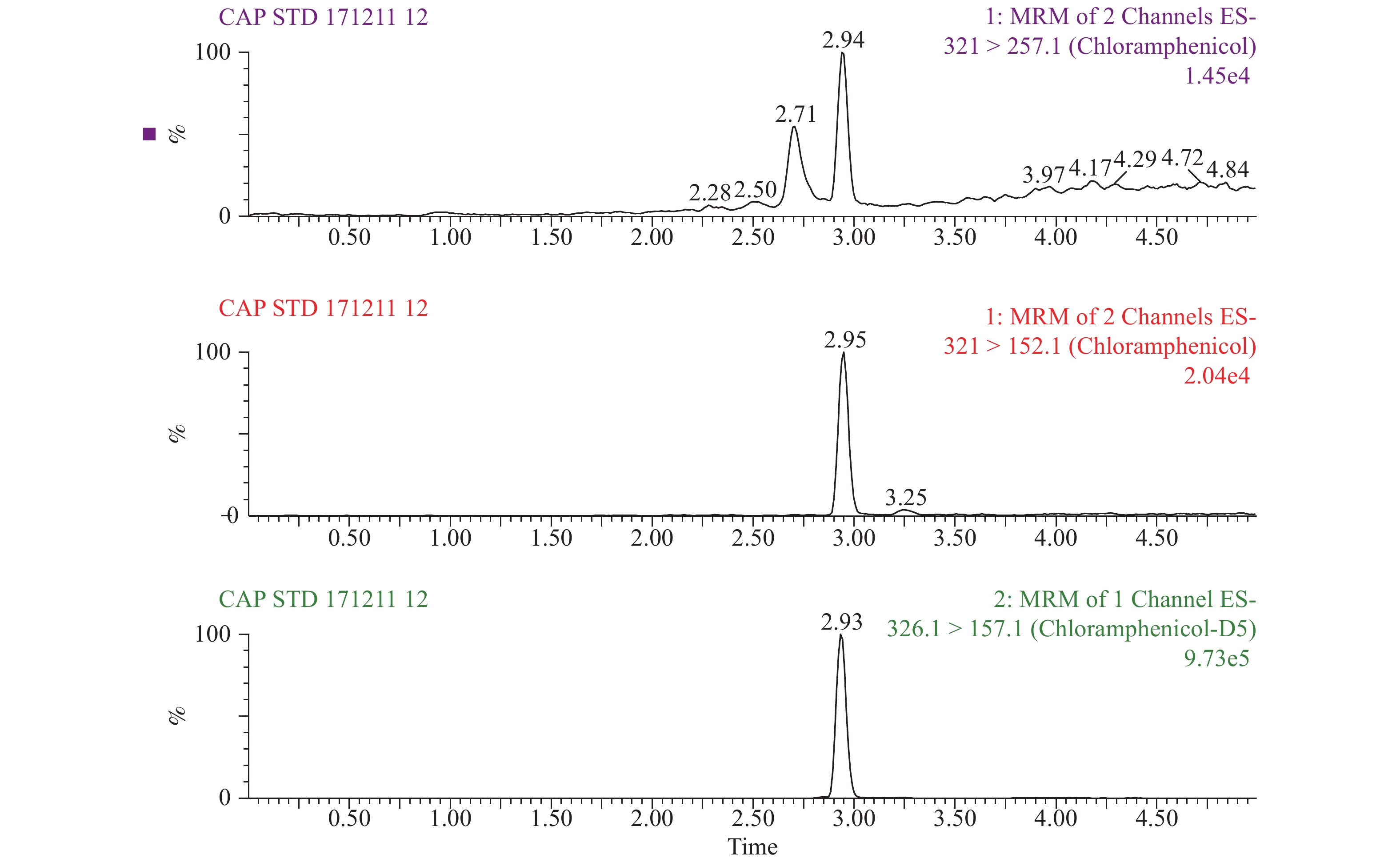
|
图 1 氯霉素和氘代氯霉素质谱图 |
2.2 线性关系与检出限
按照上述实验条件,取外标和内标峰面积的比值y与外标和内标浓度的比值x做线性回归, 线性范围为0.010~0.500 ng/mL,线性方程为y = 2.138 79x – 2.055 01e – 005,相关系数 r = 0.999 9,以取样量50 mL计算,方法的最低检出限为0.000 2 μg/L。
2.3 回收率与精密度(表2)| 表 2 加标实验回收率和精密度(n = 3) |
在50 mL氯霉素阴性的养殖水中加入一定量氯霉素标准使用液和10.0 μL氘代氯霉素标准使用液,按前述方法进行水样处理;分别进行3个水平的加标实验,每个加标水平平行测定3次。结果显示,3个加标水平的方法回收率在80.5 %~105.0 %;RSD为3.31 %~7.37 %。提示,方法回收率较高,相对标准偏差较小,方法较稳定,适合于养殖水中痕量氯霉素的测定。
2.4 养殖水样品中氯霉素含量(表3)| 表 3 养殖水中氯霉素检出情况 |
155份养殖水中3份为鲍鱼养殖水,2份为海蟹养殖水,39份为虾养殖水,111份为鱼养殖水;虾养殖场的养殖水样均采自海水虾养殖场,鱼类养殖场的养殖水样包含普通淡水养殖鱼类(桂花鱼、多宝鱼、鳗鱼、石斑、黄翅鱼等);鲍鱼养殖水样中2份采自养殖场,1份采自运输环节。结果显示,155份养殖水中有31份检出氯霉素,检出率为20 %;虾养殖水中氯霉素检出率明显高于鱼养殖水,39份虾养殖水中共有18份检测出氯霉素,检出率达46.2 %,其中虾养殖场的养殖水检出率为50 %,含量均较低;采自运输环节和批发市场的养殖水氯霉素检出率分别为23.1 %和50 %,含量也均较低;采自超市和餐馆的养殖水检出率为83.3 %,检出率和含量均较高;鱼养殖水各环节氯霉素检出率在5.6 %~15.6 %,低于虾养殖水,且含量均较虾养殖水残留量低。此外,3份鲍鱼养殖水中均未检出氯霉素;1份海蟹养殖水采自养殖场未检出氯霉素,1份帝王蟹运输环节的养殖水中检出氯霉素,含量为0.006 8 μg/L。
3 讨 论研究表明,氯霉素在水产养殖中的频繁、持续使用,能通过生物链富集,使人体产生耐药性,甚至抑制人体骨髓造血功能,引起人粒状白细胞缺乏症,新生儿、早产儿灰色综合症等疾病[5]。因此,氯霉素残留问题一直在水产品监测中备受关注。由于养殖水中氯霉素含量低,分析难度大。本研究建立的超高压液相色谱-串联质谱测定养殖水中痕量氯霉素残留的方法简便、稳定性高、检测限低。应用本方法对福建省9个设区市和平潭实验区的养殖场、批发市场、农贸市场、餐馆、超市和运输车辆的水产品养殖用水进行氯霉素含量检测,结果显示,虾养殖场养殖水中氯霉素检出率较高但残留量低;虾养殖水中运输和销售环节的氯霉素含量明显高于养殖场,其中农贸市场和超市、餐馆环节的养殖水样品氯霉素检出率和含量高于其它环节。这可能与氯霉素的持续使用,部分氯霉素直接扩散到水环境中,并累积于沉积物中[6 – 7]有关,即使养殖池中不再添加氯霉素,底泥中的氯霉素也会不断向水体缓慢释放,导致养殖水中低浓度氯霉素的残留[8]。由于农贸市场和超市、餐馆作为销售链条的末端,随着存放时间延长,虾的伤亡率升高,为降低受伤水产品感染病菌的机率而可能在养殖水中添加氯霉素,因此,销售运输环节的非法添加问题应引起关注。
综上所述,部分养殖水样品中仍残留一定水平的氯霉素,水产养殖过程中氯霉素的残留问题仍需重点关注,应加强对养殖、销售和运输各环节养殖用水的监管,从源头上监控氯霉素的使用情况。
| [1] | 张雷, 张骊, 王树槐, 等. 超高效液相色谱-串联质谱法检测动物源食品中氯霉素类药物及其代谢物残留[J]. 中国兽药杂志, 2009, 43(3): 42–45. DOI:10.3969/j.issn.1002-1280.2009.03.011 |
| [2] | 中华人民共和国农业部. 食品动物禁用的兽药及其它化合物清单[Z]. 北京: 中华人民共和国农业部公告第193号, 2002. |
| [3] | 杨大进, 蒋定国, 王竹天, 等. 畜禽肌肉、内脏及虾中氯霉素残留量的检测技术研究[J]. 卫生研究, 2004, 33(2): 198–201. DOI:10.3969/j.issn.1000-8020.2004.02.017 |
| [4] | 王安伟, 刘天密, 覃锐, 等. 水产品中氯霉素残留检测方法研究进展[J]. 食品安全质量检测学报, 2017, 8(11): 4259–4264. DOI:10.3969/j.issn.2095-0381.2017.11.030 |
| [5] | 刘彦东, 张权, 陈文生, 等. 高效液相色谱法比较3种固相萃取柱净化对乳品种8种抗生素残留检测的影响[J]. 分析测试学报, 2015, 34(3): 362–366. DOI:10.3969/j.issn.1004-4957.2015.03.018 |
| [6] | 宗万里. 同位素内标-液相色谱-串联质谱法测定鱿鱼丝中氯霉素[J]. 生命科学仪器, 2015, 13(6): 42–45. |
| [7] | 周启星, 罗义, 王美娥. 抗生素的环境残留、生态毒性及抗性基因污染[J]. 生态毒理学报, 2007, 2(3): 243–250. |
| [8] | 张素青, 陈永平, 李春春, 等. 高效液相色谱-串联质谱法测定池塘沉积物中氯霉素残留[J]. 中国渔业质量与标准, 2017, 7(4): 14–20. DOI:10.3969/j.issn.2095-1833.2017.04.003 |
 2019, Vol. 35
2019, Vol. 35
