2. 牡丹江市卫生监督所
姜黄素是从姜科植物中提取的一种小分子量的酚类化合物。姜黄素具有抗氧化、抗炎、调控细胞生长和细胞分化以及安全等特性,临床上用于预防和治疗某些慢性疾病[1 – 2]。研究表明姜黄素对糖尿病、癌症、自身免疫,心血管,神经和心理疾病均有治疗作用[3 – 4]。尽管姜黄素有明显的效果,但由于其溶解度差,代谢迅速以及全身消除快,使姜黄素应用受到限制[5]。因此,提高姜黄素的生物利用度成为研究热点。本研究采用H8(以姜黄素为母体结构合成的比姜黄素结构更稳定的姜黄素类似物 [6 – 7])灌胃db/db小鼠(糖尿病模型),探讨H8对小鼠内脏脂肪代谢的影响及作用机制,旨在为开发治疗糖尿病新药物提供技术支撑。结果报告如下。
1 材料与方法 1.1 主要试剂与仪器H8由牡丹江医学院(黑龙江省抗纤维化生物治疗重点实验室)设计合成,其化学名称为(2E,5E)-2,5-双亚苄基环戊酮,高效液相色谱法检测纯度为99.3 %;罗格列酮(成都恒瑞制药有限公司);羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC-Na)(哈尔滨化工化学试剂厂);抗F4/80、脂代谢合成酶(fatty acid synthetase,FAS)、乙酰辅酶A羧化酶1(acetyl coenzyme a carboxylase 1,ACC1)、固醇调节元件绑定蛋白(sterol regulatory element binding protein,SREBP)、辣根过氧化物酶标记山羊抗鼠、山羊抗兔抗体(美国Abcam公司),β-actin(美国Cell Signaling公司);SYBR Green(美国Origene公司);RNA逆转录试剂盒(美国Invitrogen公司)。台式高速离心机(德国SIGMA公司);微型激光共聚焦显微镜(日本奥利巴斯公司);荧光定量PCR仪(美国伯乐公司);自动化学发光凝胶成像分析系统(美国General Electric公司)。
1.2 实验动物及饲养8周龄SPF级db/db小鼠32只,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012 – 0001,体重(23.5 ± 1.5)g。饲养条件:温度18~24 ℃,湿度50 %~70 %,12 h交替照明,自由进食进水。小鼠适应性喂养1周,随机分为4组,每组8只,分别为模型组、阳性对照组(罗格列酮5 mg/kg),H8低、高剂量组(H8 5、10 mg/kg),每天灌胃1次,连续8周,H8用1 %的CMC-Na溶液溶解,模型组小鼠给予1 % CMC-Na溶液灌胃,每周检测1次血糖、体重,观察小鼠状态。末次给药后,禁食12 h,不禁水,称量小鼠体重,麻醉,眼眦静脉取血,收集血液于离心管,于37 ℃孵育30 min,3 000 g离心15 min,吸取血清待测;取内脏脂肪称重并冻存于超低温冰箱备用。
1.3 指标与方法 1.3.1 血液生化指标检测使用自动生化分析仪检测脂蛋白a[lipoprotein a,LP(A)]、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein,LDL)、血糖水平。
1.3.2 脂肪组织病理学观察采用苏木素 – 伊红 (hematoxylin eosin,HE) 染色法观察脂肪组织病理变化,将石蜡包埋的小鼠内脏脂肪组织在切片机上切片,厚度为4 μm;通过固定、脱水,HE染色,中性树脂封片,显微镜下观察各组小鼠内脏脂肪组织中脂肪细胞病理变化。
1.3.3 脂肪组织中F4/80蛋白表达检测采用免疫荧光法,将石蜡切片脱蜡,水化,抗原修复,封闭,加1 : 50稀释的F4/80抗体孵育过夜,1 : 1 000的二抗孵育1 h,中性树脂封片,用激光共聚焦显微镜对组织切片进行拍照,采用数据分析软件进行绿色荧光蛋白光密度分析。
1.3.4 脂肪组织中脂肪合成相关基因mRNA表达检测(表1)| 表 1 脂肪合成相关基因mRNA引物序列 |
采用荧光定量PCR方法,使用RNA提取试剂盒提取小鼠内脏脂肪组织总RNA,逆转录试剂盒将RNA逆转录成cDNA,取稀释好的cDNA 2 μL,加SYBR Green Mix 9 μL,FAS、ACC1、SREBP上下游引物各0.8 μL、内参(ribosomal protein S16,RPS16),ddH2O 7.4 μL,荧光定量PCR仪反应条件如下:95 ℃预变性5 min;95 ℃变性30 s;53~60 ℃退火30 s;扩增40个循环,每份标本做2个平行样,测出基因和内参的Ct值,按照标准曲线,计算相对表达量。
1.3.5 脂肪组织中脂肪合成相关蛋白表达检测采取Western blot法,取小鼠脂肪组织提取蛋白,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳2 h,转膜45 min,封闭1 h,1:1 000稀释的一抗孵育(FAS、ACC1、SREBP、β-actin)过夜,1:10 000稀释的二抗孵育1 h,显色液显色后用自动化学发光凝胶成像分析仪照相,数据分析软件分析蛋白表达量。
1.4 统计分析实验数据用
|
表 2 H8对db/db小鼠内脏脂肪重量影响(
|
与对照组比较,罗格列酮组与低、高剂量H8组小鼠体重与内脏脂肪重量、内脏脂肪系数明显降低(P < 0.05);表明H8可明显减少小鼠内脏脂肪堆积。
2.2 H8对db/db小鼠生化指标影响(表3)|
表 3 H8对db/db小鼠血液生化指标影响(mg/dL, |
与模型组比较,罗格列酮组小鼠血清中胆固醇、甘油三酯、LDL和血糖水平明显降低(P < 0.01),低、高剂量H8组小鼠血清中脂蛋白a、甘油三酯、LDL和血糖水平明显降低( P < 0.05)。
2.3 H8对db/db小鼠内脏脂肪细胞体积影响(图1)

|
注:A模型组;B罗格列酮组;C、D H8低、高剂量组。 图 1 H8对db/db小鼠内脏脂肪细胞体积影响(HE,× 100) |
模型组小鼠脂肪细胞体积为(801.2 ± 44.0);罗格列酮组小鼠脂肪细胞体积为(729.3 ± 64.5);低、高剂量H8组小鼠脂肪细胞体积分别为(304.7 ± 24.8)和(331.3 ± 18.0);与模型组比较,罗格列酮组和低、高剂量H8组小鼠内脏脂肪细胞体积均明显减小(P < 0.01)。
2.4 H8对db/db小鼠内脏脂肪组织F4/80表达影响(图2)

|
注:A模型组;B罗格列酮组;C、D H8低、高剂量组。 图 2 H8对db/db小鼠脂肪组织F4/80蛋白表达影响(免疫荧光,× 100) |
模型组、罗格列酮组、低、高剂量H8组小鼠内脏脂肪组织中F4/80表达量(光密度)分别为(1.0 ± 0.0)、(0.79 ± 0.03)、(0.39 ± 0.06)和(0.43 ± 0.04);与模型组比较,罗格列酮组和低、高剂量H8组小鼠内脏脂肪组织中F4/80蛋白表达明显降低(P < 0.01)。
2.5 H8对db/db小鼠内脏脂肪组织中脂肪合成相关基因表达影响(表4)|
表 4 H8对db/db小鼠脂肪组织中脂肪合成相关基因表达影响(
|
与模型组比较,罗格列酮组、低、高剂量H8组小鼠内脏脂肪组织中FAS、ACC1、SREBP的mRNA表达明显降低(P < 0.05)。
2.6 H8对db/db小鼠内脏脂肪组织中脂肪合成相关蛋白表达影响(图3、表5)
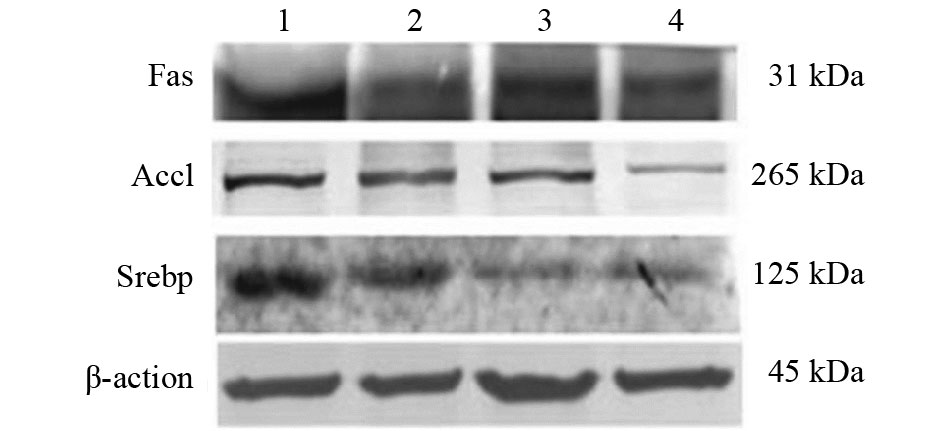
|
注:1 模型组;2 罗格列酮组;3、4低、高剂量H8组。 图 3 H8对db/db小鼠脂肪组织中脂肪合成相关蛋白表达影响 |
|
表 5 H8对db/db小鼠脂肪组织中脂肪合成相关蛋白表达影响(
|
与模型组比较,罗格列酮组、低、高剂量H8组小鼠内脏脂肪组织中FAS、ACC1、SREBP蛋白表达显著降低(P < 0.05)。
3 讨 论临床上2型糖尿病是常见的慢性疾病,常伴随多种并发症[8]。目前中药治疗2型糖尿病成为国内外研究热点。本研究结果显示,与模型组比较,各剂量H8组小鼠脂肪系数下降、脂蛋白a、胆固醇、甘油三酯、LDL、血糖水平明显降低,而HDL升高。提示,姜黄素类似物H8对2型糖尿病小鼠具有明显的降糖和降血脂作用。研究显示,内脏脂肪组织炎症的主要参与者是巨噬细胞,可导致肥胖症慢性低度炎症[9],而F4/80是脂肪组织巨噬细胞特异性标记蛋白[10]。本研究结果显示,模型组小鼠脂肪组织变性,脂肪细胞肥大;与模型组比较,各剂量H8组小鼠脂肪细胞体积缩小,脂肪组织中F4/80蛋白表达明显降低。提示,H8对脂代谢具有改善作用。
FAS、ACC1、SREBP是参与脂肪合成的关键酶[11]。FAS是机体内脂肪合成、堆积的最关键酶之一。当机体FAS含量升高时,催化丙二酰CoA成脂肪酸,机体内过多的脂肪酸能够通过酯化作用形成脂肪,导致机体内的脂肪沉积[12]。ACC是机体内脂肪酸合成的限速酶之一,存在于脂肪细胞和肝脏细胞中,通过催化乙酰CoA生成丙二酰辅酶CoA,而后者是脂肪酸合成的主要底物,目前已知的ACC分为两类,ACC1和ACC2[13]。SREBP是调节机体内脂肪合成代谢的最关键转录因子之一,受到胆固醇、营养因子、激素的共同调控,目前发现的SREBP有3种亚型:SREBP-1a、SREBP-1c和SREBP-2。SREBP-1c主要调节机体内葡萄糖转化生成脂肪酸的初始合成途径,通过激活下游靶基因,促进甘油三酯和脂肪酸合成中多个限速酶的表达[14]。本研究结果显示,与模型组比较,各剂量H8组小鼠脂肪组织中FAS、ACC1、SREBP基因和蛋白表达均明显降低。提示,姜黄素类似物H8对2型糖尿病小鼠具有明显的降血糖和调节血脂代谢作用,其机制可能与H8抑制脂肪组织中脂肪合成相关基因FAS、ACC1和SREBP表达有关。
| [1] | Chen QY, Zheng Y, Jiao DM, et al. Curcumin inhibits lung cancer cell migration and invasion through Rac1-dependent signaling pathway[J]. J Nutr Biochem, 2014, 25(2): 177–185. DOI:10.1016/j.jnutbio.2013.10.004 |
| [2] | He Y, Yue Y, Zheng X, et al. Curcumin, inflammation, and chronic diseases: how are they linked?[J]. Molecules, 2015, 20(5): 9183–9213. DOI:10.3390/molecules20059183 |
| [3] | Naksuriya O, Okonogi S, Schiffelers RM, et al. Curcumin nanoformulations: a review of pharmaceutical properties and preclinical studies and clinical data related to cancer treatment[J]. Biomaterials, 2014, 35(10): 3365–3383. DOI:10.1016/j.biomaterials.2013.12.090 |
| [4] | 秦培洁, 张栋伟, 莫芳芳, 等. 姜黄素对胰岛素抵抗3T3-L1前脂肪细胞糖脂代谢及细胞分化的影响[J]. 北京中医药大学学报, 2014, 37(4): 236–239. DOI:10.3969/j.issn.1006-2157.2014.04.005 |
| [5] | Aggarwal BB, Gupta SC, Sung B, et al. Curcumin: an orally bioavailable blocker of TNF and other pro-inflammatory biomarkers[J]. Br J Pharmacol, 2013, 169(8): 1672–1692. DOI:10.1111/bph.12131 |
| [6] | Yuan X, Li H, Bai H, et al. The 11β-hydroxysteroid dehydrogenase type 1 inhibitor protects against the insulin resistance and hepatic steatosis in db/db mice[J]. Eur J Pharmacol, 2016, 788: 140–151. DOI:10.1016/j.ejphar.2016.05.034 |
| [7] | Yuan XH, Li H, Bai H, et al. Synthesis of novel curcumin analogues for Inhibition of 11β-hydroxysteroid dehydrogenase type 1 with anti-diabetic properties[J]. Eur J Med Chem, 2014, 77: 223–230. DOI:10.1016/j.ejmech.2014.03.012 |
| [8] | 于冬青, 邓华聪. 姜黄素对糖尿病大鼠糖、脂代谢及氧化应激的影响[J]. 重庆医学, 2015, 34(1): 37–39. |
| [9] | Bettaieb A, Cremonini E, Kang H, et al. Anti-inflammatory actions of (-)-epicatechin in the adipose tissue of obese mice[J]. Int J Biochem Cell Biol, 2016, 81(Pt B): 383–392. |
| [10] | Masi LN, Martins AR, Crisma AR, et al. Combination of a high-fat diet with sweetened condensed milk exacerbates inflammation and insulin resistance induced by each separately in mice[J]. Sci Rep, 2017, 7(1): 3937–3947. DOI:10.1038/s41598-017-04308-1 |
| [11] | Alsanea S, Liu D. BITC and S-carvone restrain high-fat diet-induced obesity and ameliorate hepatic steatosis and insulin resistance[J]. Pharm Res, 2017, 34(11): 2241–2249. DOI:10.1007/s11095-017-2230-3 |
| [12] | 占敏霞, 巫冠中. 脂肪酸合成酶与疾病[J]. 亚太传统医药, 2012, 8(9): 210–212. DOI:10.3969/j.issn.1673-2197.2012.09.117 |
| [13] | Palou M, Priego T, Sánchez J, et al. Gene expression patterns in visceral and subcutaneous adipose depots in rats are linked to their morphologic features[J]. Cell Physiol Biochem, 2009, 24(5-6): 547–556. DOI:10.1159/000257511 |
| [14] | Oberkofler H, Fukushima N, Esterbauer H, et al. Sterol regulatory element binding proteins: relationship of adipose tissue gene expression with obesity in humans[J]. Biochim Biophys Acta, 2002, 1575(1-3): 75–81. DOI:10.1016/S0167-4781(02)00279-8 |
 2019, Vol. 35
2019, Vol. 35


