2. 青岛大学基础医学院
动脉粥样硬化是心血管疾病的病理基础,城乡居民疾病死亡构成比中,心血管疾病占首位[1 – 2]。有研究显示肠道菌群可能参与动脉粥样硬化发病机制,其可能经肠道屏障进入人体[3]。红曲是以大米为原料,经红曲菌发酵而成的一种紫红色米曲,具有降血脂[4]、降血糖[5]等作用。本研究通过红曲干预ApoE-/-小鼠,对小鼠结肠病理,结肠组织紧密连接蛋白ZO-1、claudin-1表达进行检测,从而探讨红曲对ApoE-/-小鼠肠道屏障的作用。
1 材料与方法 1.1 主要试剂和仪器红曲,monacolin K含量2~40(0.2~4.0 %)mg/g(杭州禾田生物技术有限公司);10 %中性甲醛、油红O、异丙醇(南京建成生物科技有限公司);claudin-1一抗和二抗、ZO-1一抗和二抗、β-actin内参、ECL发光试剂盒(北京中杉金桥生物技术有限公司)。JEM-1200EX透射电镜(日本JEOL公司),制冰机IM-20Kr25型(英国Hoshizaki公司),超低温冰箱(美国Thermo公司),BX53型显微(日本Olympus公司),光镜Olympus BX60型(日本Olympus公司),转移脱色摇床(海门其林贝尔仪器制造公司),电泳仪(北京百晶生物技术有限公司)。
1.2 动物SPF级8周龄雄性ApoE-/-小鼠18只,野生型(wide type,WT)雄性C57BL/6J小鼠6只,体重(22 ± 2)g,购自北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2016 – 0011。
1.3 实验方法 1.3.1 动物分组及给药方法18只8周龄雄性ApoE-/-小鼠,6只8周龄雄性C57BL/6J小鼠,体重(22 ± 2)g。适应性喂养1周后C57BL/6J小鼠作为正常对照组;ApoE-/-小鼠随机分为:动脉粥样硬化模型组;阿托伐他汀组;红曲组。红曲组每天0.34 g/kg.d红曲灌胃。他汀组每天10 mg/kg.d阿托伐他汀灌胃,其它组生理盐水灌胃。动脉粥样硬化模型组,红曲组,阿托伐他汀组喂食高脂高胆固醇饲料(含15 %猪油 + 0.25 %胆固醇)。实验周期为12周。
1.3.2 标本的收集及指标检测小鼠禁食12 h后,摘取眼球取血,离心,取血清,– 80 ℃冰箱保存。将小鼠行心脏灌注。灌注完毕,在冰上取出主动脉和小肠。
1.3.3 主动脉大体油红O染色用异丙醇配置油红O工作液。将主动脉在解剖显微镜下分离干净,纵向剖开,在蒸馏水中浸洗10 min,在60 %异丙醇中5 min,用油红O避光、密封染色1 h,60 %异丙醇分化至背景清晰。用斑块面积比血管总面积表示动脉粥样硬化的严重程度。
1.3.4 结肠组织超微结构观察将肠组织1 mm3于2.5 %戊二醛固定4 h,PBS缓冲液冲洗3次,每次10 min。1 %锇酸固定2 h。PBS(phosphate-buffered saline)缓冲液冲洗3次,每次10 min。乙醇系列梯度脱水;环氧树脂包埋,温箱固化。超薄切片机切片,醋酸双氧铀硝酸铅染色,透射电镜观察。
1.3.5 结肠病理结构观察取约1 cm结肠组织,于10 %中性甲醛固定,石蜡包埋,切片,脱蜡,苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,中性树胶封片,光镜观察。肠绒毛高度为绒毛基部(肠腺与绒毛连接处)到绒毛顶端的距离。
1.3.6 免疫印迹法(Western blot,WB)法检测结肠组织claudin-1和ZO-1紧密连接蛋白的表达称取100 mg肠组织研至粉末状加入1 mL裂解液,静置,离心,取上清。制备SDS-PAGE(sodium dodecyl-polyacryl gradient gel electrophoresis)凝胶,样品变性及电泳,凝胶转膜及其检测,采用Tanon1600对胶片进行扫描,用Tanon Gis软件分析。
1.3.7 统计分析采用SPSS 24.0统计软件进行统计学分析,数据以
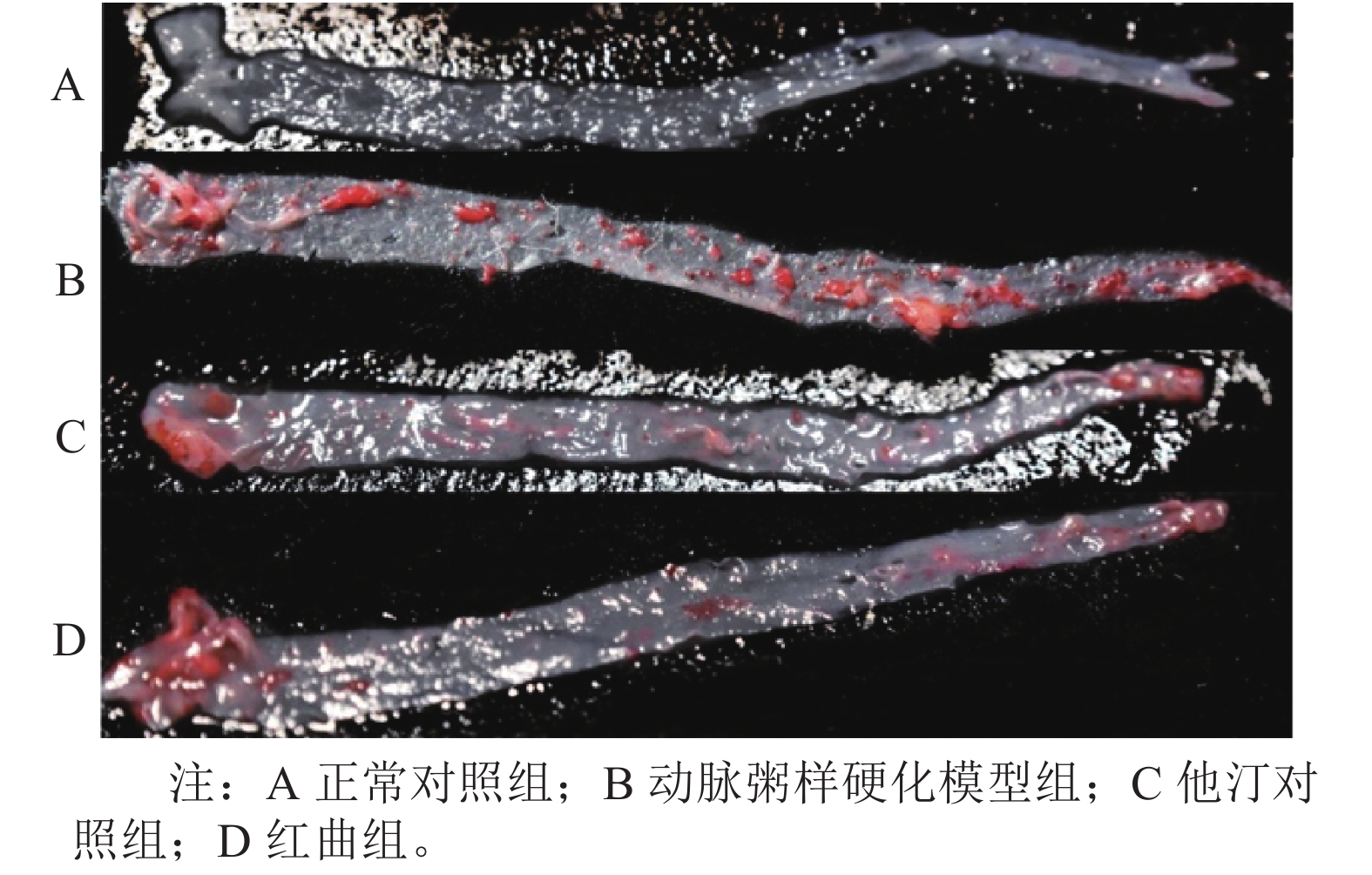
|
图 1 小鼠主动脉大体油红O染色观察 |
|
表 1 主动脉斑块面积(%)(
|
对小鼠主动脉行油红O染色后,进行分析统计。正常对照组无斑块形成,动脉粥样硬化模型组斑块面积为(22.46 ± 8.33)%,他汀组斑块面积为(8.89 ± 0.62)%,红曲组斑块面积为(7.00 ± 2.65)%。与动脉粥样硬化模型组相比他汀组和红曲组斑块减少都有统计学意义(P < 0.05),红曲组斑块面积与他汀组相比,差异无统计学意义( P > 0.05)。
2.2 红曲对结肠病理的影响(图2,表2)

|
图 2 小鼠结肠组织光镜观察(HE,X200) |
|
表 2 红曲对小鼠结肠组织绒毛高度的影响(
|
HE染色结果显示,正常对照组肠组织无病理性改变,绒毛丰富无脱失,黏膜正常;与正常对照组相比,动脉粥样硬化模型组肠黏膜表面上皮大量脱失,黏膜充血,肠绒毛不清,结肠绒毛高度明显降低(P < 0.05);与动脉粥样硬化模型组相比,他汀组结肠绒毛顶端轻度脱失,肠绒毛高度显著增加( P < 0.05);与模型组相比红曲组结肠绒毛丰富,绒毛顶端轻度脱失,黏膜基本正常,结肠绒毛高度度显著增加( P < 0.05);他汀组和红曲组结肠绒毛高度无显著性差异( P > 0.05)。
2.3 红曲对结肠组织超微结构的影响(图3,表3)

|
图 3 小鼠结肠组织透射电镜观察 |
|
表 3 红曲对小鼠结肠组织微绒毛长度的影响(
|
电镜结果显示,正常对照组结肠微绒毛丰富,排列整齐,柱状上皮细胞结构完整,细胞间连接结构正常。与正常对照组相比,动脉粥样硬化模型组微绒毛长短不一,紧密连接松弛,绒毛根部变细,头部膨大;与模型组相比他汀组与红曲组微绒毛丰富,细胞间连接结构正常。与正常对照组相比动脉粥样硬化模型组、他汀组、红曲组结肠微绒毛长度分别缩短了50 %、28 %、36 %,差异具有显著性(P < 0.05)。与动脉粥样硬化模型组相比他汀组、红曲组微绒毛长度分别增长了44 %、30 %,差异具有显著性( P < 0.05)。他汀组和红曲组结肠微绒毛长度无显著性差异( P > 0.05)。
2.4 红曲对结肠紧密连接蛋白的影响(图4,表4)
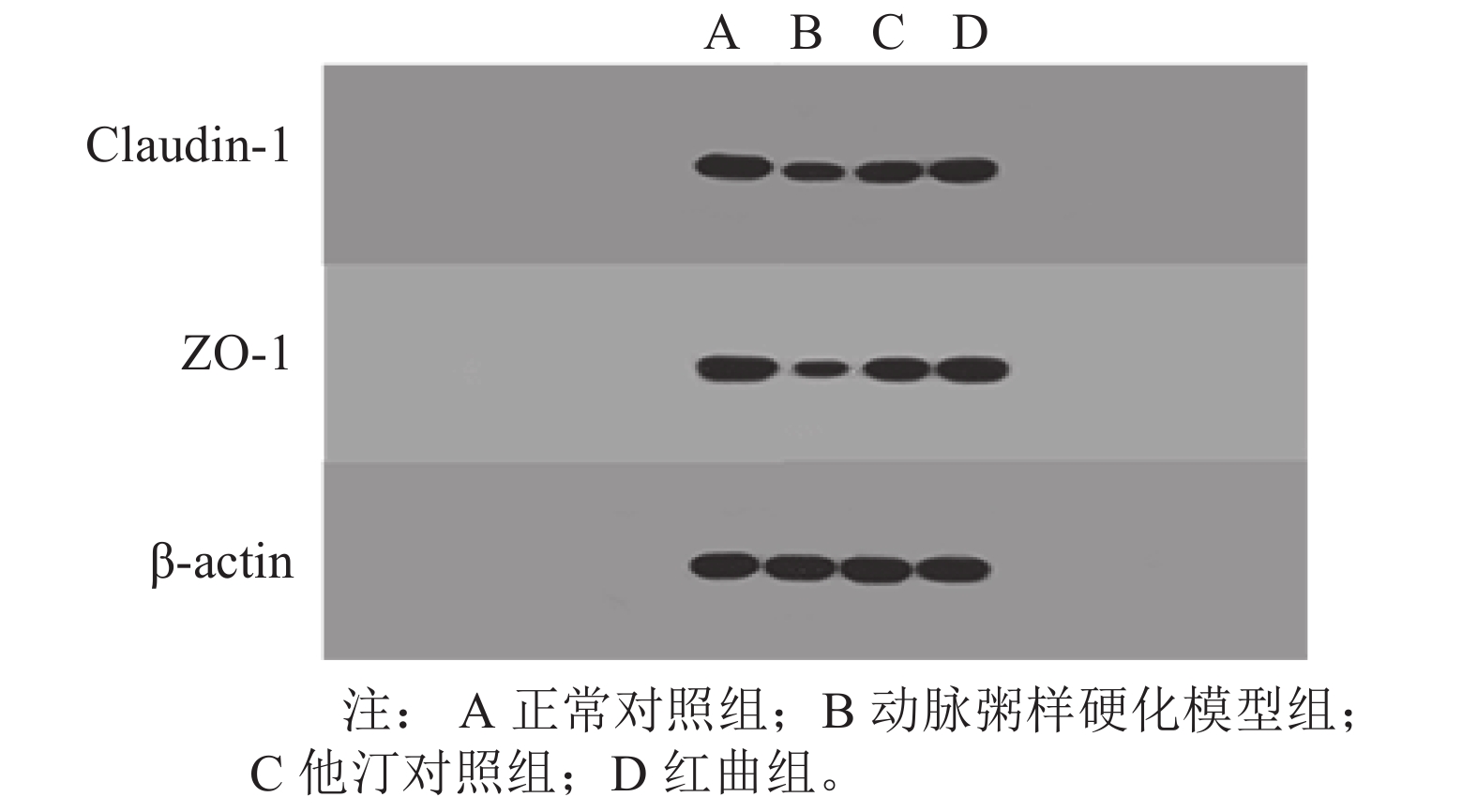
|
图 4 红曲对对小鼠结肠组织紧密连接蛋白claudin-1和ZO-1表达的影响 |
|
表 4 红曲对小鼠结肠组织紧密连接蛋白ZO-1 和claudin-1 表达的影响(
|
与正常对照组相比,模型组claudin-1和ZO-1蛋白的表达均显著降低(P < 0.05); 与模型组相比,他汀组和红曲组claudin-1和ZO-1蛋白的表达均显著升高( P < 0 .05)。他汀组和红曲组claudin-1和ZO-1蛋白的表达均无显著性差异( P > 0.05)。
3 讨 论肠道屏障是指肠道能够阻止有害物质如细菌、毒素等进入血液及人体其他组织,由机械屏障、化学屏障、免疫屏障和生物屏障组成,其中以机械屏障最为重要[6]。有研究显示肠道屏障功能障碍会导致细菌及内毒素等进入人体导致机体炎症性疾病易感性增加进而导致动脉粥样硬化的发病[7 – 9]。因此调节肠道屏障功能可以预防动脉粥样硬化的发生发展。红曲作为一种中药可以通过调节脂质代谢防治心脑血管疾病的发生发展[10],但是红曲能否通过保护肠道屏障功能预防动脉粥样硬化的发生发展这一问题值得探究。本研究选择红曲对ApoE-/-小鼠进行干预,观察对动脉粥样硬化小鼠肠道屏障功能是否有保护作用。
研究显示ApoE-/-小鼠可自发形成动脉粥样硬化斑块,高脂高胆固醇饮食可加速粥样硬化斑块形成[11],故本实验选择ApoE-/-小鼠喂养高脂高胆固醇饮食12周进行造模。结果显示动脉粥样硬化模型组形成了典型的动脉粥样硬化斑块,成功制备动脉粥样硬化小鼠模型。红曲有降低动脉粥样斑块形成的作用,这与郑广娟等[12]研究结果相一致。肠黏膜组织学观察是一种公认的评价肠黏膜屏障功能最常用和最直接的方法,包括光学显微镜、扫描电镜、透射电镜等,其中光学和电子显微镜是观察肠黏膜改变最常用的方法[13]。本研究通过光镜和透射电镜评价肠道屏障功能。结果显示,动脉粥样硬化模型组小鼠存在肠道屏障功能损伤。红曲对小肠绒毛损伤及紧密连接都有一定的保护作用。
肠粘膜机械屏障由肠粘膜上皮细胞及细胞间连接构成,其中细胞间连接包括紧密连接、缝隙连接、黏附连接以及桥粒等。紧密连接在多种连接中最重要,它可它防止肠腔内有毒物质及细菌等进入其他组织[14]。紧密连接由众多蛋白组成,其中claudin-1蛋白是构成紧密连接的主要骨架蛋白[15],其表达异常可导致紧密连接的结构和功能受损,引起屏障功能紊乱[16 – 17]。ZO-1蛋白可以使紧密连接结构更加稳定[18],肠粘膜屏障功能与ZO-1蛋白关系密切[19 – 20]。Ghosh等研究发现通过姜黄素干预可上调人肠上皮Caco-2细胞中ZO-1和Claudin-1蛋白的表达,从而改善屏障功能并降低细胞旁通透性[21]。有研究显示,大黄等中药可通过上调ZO-1蛋白的表达,保护紧密连接,改善肠粘膜屏障功能[22 – 23]。为了进一步研究红曲对肠道屏障功能的影响,本研究采用WB法检测结肠组织claudin-1及ZO-1紧密连接相关蛋白的表达。结果显示,与正常对照组相比,模型组claudin-1和ZO-1紧密连接蛋白的表达均显著降低,红曲干预后均显著升高。表明红曲可通过上调结肠组织紧密连接蛋白claudin-1和ZO-1的表达,降低肠粘膜通透性,改善肠道屏障功能。
综上所述,高脂高胆固醇喂养的ApoE-/-小鼠存在肠道屏障功能破坏,红曲干预后可以改其损伤程度,其机制可能与修复结肠绒毛和上调结肠claudin-1和ZO-1紧密连接蛋白有关。
| [1] | Mozaffarian D, Benjamin EJ, Go AS, et al. Executive summary: heart disease and stroke statistics – 2016 update: a report from the American Heart Association[J]. Circulation, 2016, 133(4): 447–454. DOI:10.1161/CIR.0000000000000366 |
| [2] | 中国心血管病报告编写组. 《中国心血管病报告2016》概要[J]. 中国循环杂志, 2017, 32(6): 521–530. DOI:10.3969/j.issn.1000-3614.2017.06.001 |
| [3] | 胡章雪. Zonulin在动脉粥样硬化发病机制中的作用研究与甘氨鹅脱氧胆酸细胞毒性的体外实验研究[D]. 第三军医大学, 2013. |
| [4] | Cicero AFG, Martino M, Angelo P, et al. Effect of red yeast rice combined with antioxidants on lipid pattern, hs-CRP level, and endothelial function in moderately hypercholesterolemic subjects[J]. Therapeutics and Clinical Risk Management, 2016, 12(1): 281–286. |
| [5] | Hsu WH, Lu SS, Lee BH, et al. Monacolin K and monascin attenuated pancreas impairment and hyperglycemia induced by advanced glycation endproducts in BALB/c mice[J]. Food and Function, 2013, 4(12): 1742–1750. DOI:10.1039/c3fo60268k |
| [6] | Groschwitz KR, Hogan SP. Intestinal barrier function: molecular regulation and disease pathogenesis[J]. J Allergy Clin Immunol, 2009, 124(1): 3–20. DOI:10.1016/j.jaci.2009.05.038 |
| [7] | Cani PD, Amar J, Iglesias MA, et al. Metabolic endotoxemia initiates obesity and insulin resistance[J]. Diabetes, 2007, 56(7): 1761–1772. DOI:10.2337/db06-1491 |
| [8] | 何桂珍. 肠道屏障功能与细菌移位[J]. 协和医学杂志, 2012, 3(3): 260–264. DOI:10.3969/j.issn.1674-9081.2012.03.003 |
| [9] | Jialal I, Rajamani U. Endotoxemia of metabolic syndrome: a pivotal mediator of meta-inflammation[J]. Metab Syndr Relat Disord, 2014, 12(9): 454–456. DOI:10.1089/met.2014.1504 |
| [10] | Liu J, Zhang J, Shi Y, et al. Chinese red yeast rice (Monascus purpureus) for primary hyperlipidemia: a meta-analysis of randomized controlled trials [J]. Chinese Medicine, 2006, 1(1): 1–13. |
| [11] | Imaizumi K. Diet and atherosclerosis in apolipoprotein E-deficient mice[J]. Journal of the Agricultural Chemical Society of Japan, 2011, 75(6): 1023–1035. |
| [12] | 郑广娟, 刘龙涛, 张文高, 等. 降脂红曲微粉对载脂蛋白E基因敲除小鼠动脉粥样硬化的影响[C]. 中国中西医结合学会会议论文集, 2006, 347-349. |
| [13] | 胡红莲, 高民. 肠道屏障功能及其评价指标的研究进展[J]. 中国畜牧杂志, 2012, 48(17): 78–82. DOI:10.3969/j.issn.0258-7033.2012.17.021 |
| [14] | Shen L, Weber CR, Raleigh DR, et al. Tight junction pore and leak pathways: a dynamic duo[J]. Annual Review of Physiology, 2011, 73(1): 283–309. DOI:10.1146/annurev-physiol-012110-142150 |
| [15] | Kazuaki U, Junichi I, Sayaka K, et al. ZO-1 and ZO-2 indepen- dently determine where claudins are polymerized in tight-junction strand formation[J]. Cell, 2006, 126(4): 741–754. DOI:10.1016/j.cell.2006.06.043 |
| [16] | Chen L, Chen Z, Ge M, et al. Monocytic cell junction proteins serve important roles in atherosclerosis via the endoglin pathway[J]. Molecular Medicine Reports, 2017, 16(5): 6750–6756. DOI:10.3892/mmr.2017.7444 |
| [17] | Günzel D, Yu AS. Claudins and the modulation of tight junction permeability[J]. Physiological Reviews, 2013, 93(2): 525–569. DOI:10.1152/physrev.00019.2012 |
| [18] | Shen L. Tight junctions on the move: molecular mechanisms for epithelial barrier regulation[J]. Annals of the New York Academy of Sciences, 2012, 1258(1): 9–18. DOI:10.1111/j.1749-6632.2012.06613.x |
| [19] | 甘元涛, 赵少勇. 肠黏膜屏障损伤与紧密连接蛋白ZO-1的关系研究进展[J]. 现代医药卫生, 2016, 32(7): 1027–1029. DOI:10.3969/j.issn.1009-5519.2016.07.023 |
| [20] | Fanning AS, Ma TY, Anderson JM. Isolation and functional characterization of the actin binding region in the tight junction protein ZO-1[J]. Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology, 2002, 16(13): 1835–1837. DOI:10.1096/fj.02-0121fje |
| [21] | Ghosh SS, Bie J, Wang J, et al. Oral supplementation with non-absorbable antibiotics or curcumin attenuates western diet-induced atherosclerosis and glucose intolerance in LDLR-/- mice – role of intestinal permeability and macrophage activation[J]. PLoS One, 2014, 9(9): e108577. DOI:10.1371/journal.pone.0108577 |
| [22] | 张迪迪, 韩振国, 王静. 大黄对胃肠手术后大鼠肠道黏膜屏障损伤的影响[J]. 中国医药指南, 2013, 11(13): 474–475. DOI:10.3969/j.issn.1671-8194.2013.13.370 |
| [23] | 刘玉晖, 胡婕, 易文凤, 等. 参苓白术散治疗炎症性肠病与肠上皮细胞紧密连接的关系探讨[J]. 中国实验方剂学杂志, 2015, 21(3): 130–133. |
 2019, Vol. 35
2019, Vol. 35


