2. 西安交通大学医学部公共卫生学院
年龄相关性黄斑变性病(age-related macular degeneration,AMD)是一种中老年人的常见致盲性眼病[1]。该病发生可能与遗传、代谢、环境、炎症、免疫等多种因素有关[2]。有研究证实氧化应激诱导视网膜色素上皮细胞(retinal pigment epithelium,RPE)细胞紊乱及功能失调,参与AMD的发生与发展[3]。因此,深入阐明氧化应激诱导RPE细胞的分子生物学机制,有望为AMD治疗提供新策略。Sirtuin(SIRT)家族蛋白是一类依赖烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)、核心区域高度保守的蛋白去乙酰化酶和ADP核糖基转移酶。作为该家族的重要成员,SIRT1在调控衰老及与年龄有关代谢疾病的发生发挥重要作用[4]。Maloney等[5]通过免疫组化检查发现AMD患者脉络膜新生血管化膜较非AMD对照眼中的SIRT1表达水平升高。Golestaneh等[6]证实SIRT1/PGC-1a通路下调,介导抑制线粒体的生物合成,在AMD发生进程中发挥重要作用;因此,在AMD发病过程中SIRT1参与氧化还原的机制仍需进一步深入探讨。本研究使用H2O2刺激RPE细胞建立氧化损伤模型,探讨氧化应激对RPE细胞形态的影响,进而明确不同的氧化应激处理时间对SIRT1表达的影响,从而揭示氧化应激诱导RPE细胞不同时间点SIRT1表达水平的变化,为进一步研究AMD的发病机制提供参考和依据。
1 材料与方法 1.1 细胞培养视网膜色素上皮细胞ARPE-19细胞株购自广州吉妮欧生物有限公司,培养基成分包括RPMI-1640(美国Glibco公司);胎牛血清(FBS)(美国Hyclone公司);青霉素(山东鲁抗医药股份有限公司);链霉素(哈药集团制药总厂)。冻存的ARPE-19细胞从液氮罐中迅速投入至37 ℃水浴锅中融化,加入含10 %的FBS的细胞培养液,在800 r/min、21 ℃条件下离心5 min,除去上清液,加入适量培养液重悬,接种于10 cm培养皿,置于37 ℃、饱和湿度、5 % CO2孵箱中培养,每2 d换1次液。待细胞长满70 %~80 %,取对数生长期的ARPE-19细胞接种于6孔板中进行实验。
1.2 试验分组H2O2处理组不同浓度H2O2(200、300 μmol/L)孵育ARPE-19细胞24 h,诱导短期氧化应激,实验正常对照组RPMI-1640培养液培养24 h;H2O2处理组不同浓度(200、300 μmol/L)孵育ARPE-19细胞72 h,诱导长期氧化应激,实验正常对照组RPMI-1640培养液培养72 h。
1.3 吉姆萨染色将ARPE-19细胞以5 × 104个/孔浓度接种于24孔板,每孔预先放入一已灭菌的盖玻片以制备细胞爬片;常规培养24 h待细胞长到30 %~40 %密度弃去旧培养液,磷酸盐缓冲液(phosphate buffer saline,PBS)溶液漂洗3次;各组细胞分别加入含梯度浓度H2O2(0、200和300 µmol/L)的培养液,常规培养24 h,弃去旧培养液;加入4 %多聚甲醛4 ℃固定1 h,弃去液体,PBS溶液漂洗3次,每次5 min;弃去液体,待其自然干燥。之后将自然干燥的细胞爬片水平置于染色架上;将I液(迈格染料1 g、甲醇100 mL)滴于细胞爬片上染色15 min;弃去爬片上的I液,自来水漂洗干净;立即滴盖Ⅱ液(姬氏染粉0.6 g、甘油20 mL、甲醇100 mL)在爬片上染色15 min弃去涂片上的Ⅱ液,自来水漂洗干净;待细胞爬片自然干燥后,以中性树胶固定于载玻片,待干后在显微镜下观察。
1.4 实时定量PCR检测将用不同浓度H2O2处理了24、72 h的ARPE-19的细胞用PBS冲洗2遍弃去残留的细胞培养基,6孔板中每孔加入1 mL的Trizol(美国Invitrogen公司),按照试剂说明书提取RNA,简要步骤如下:室温静置加入Trizol的细胞10 min,使样品充分裂解;转移至无菌EP管,加入0.2 mL的氯仿,涡旋震荡后静置10 min;4 ℃、12 000 r/min,离心15 min,将上层水相移至无RNA酶的EP管中;加入等体积的异丙醇,混匀室温静置10 min;4 ℃、12 000 r/min,离心20 min,弃去上清液,加入1 mL 75 %的无水乙醇,涡旋混匀;4 ℃、7 500 r/min,离心5 min,弃去上清液,干燥后的用20μL DEPC水溶解RNA,– 80 ℃保存。取RNA样品测定A260值,A260/A280的比值,计算RNA浓度和评估质量。根据HiScriptTMQpcr SquperMix逆转录试剂盒(美国Vazyme公司)说明书混合反转录试剂,在PCR仪中设置65 ℃、10 min,42 ℃、30 min,85 ℃、5 min程序进行RNA反转录。反转录后cDNA与SIRT1特异性引物(上游:5′-AAGTTGACTGTGAAGCTGTACG-3′)下游:5′-TGCTACTGGTCTTACTTTGAGGG-3′)以及SYBR Green Master MIX(美国Promega公司);GAPDH为内参(上游:5′-ACC ACA GTC CAT GCC ATC AC-3′下游:5′-TCC ACC ACC CTG TTG CTG TA-3′)分别加入8联管中,混匀离心,将8联管依次放入real-time PCR扩增仪内,将程序设定为:预变性:95 ℃,10 min;循环(40 cycles):95 ℃,30 s;60 ℃,30 s;72 ℃,30 s;溶解曲线:60 ℃,1 min;95 ℃,30 s,60 ℃,15 s。
1.5 免疫蛋白印迹(Western blot,WB)分析将不同组H2O2浓度处理的细胞用蛋白裂解液(含有蛋白酶抑制剂)溶解提取总蛋白。蛋白上样量为30 μg/孔,以12 %SDS-PAGE分离不同分子质量的蛋白,切取含目的蛋白的胶湿转至PVDF膜上,用含5 %脱脂奶粉的封闭液于摇床上室温封闭膜1 h;分别加入1 : 1 000稀释的兔抗人SIRT1抗体、4 ℃孵育过夜;用洗膜缓冲液(Tris buffered saline Tween,TBST)洗涤3次,每次5 min后,加入1 : 5 000山羊抗兔二抗于室温孵育1 h;ECL显色,采用化学发光法采集图像。得到条带用Image-lab进行灰度值分析。
1.6 统计分析采用SPSS 13.0统计软件,数据资料以

|
图 1 不同浓度的H2O2处理RPE细胞的吉姆萨染色结果 |
吉姆萨染色结果显示,H2O2处理RPE细胞24 h后,阴性对照组细胞呈现多角形或扁圆形、核膜完整、胞浆均匀;H2O2浓度200 µmol/L组有少量细胞拉长、细胞核固缩、呈深染、可见少量凋亡小体;300 µmol/L组细胞边界不清、细胞核破碎、可见细胞碎片和凋亡小体。
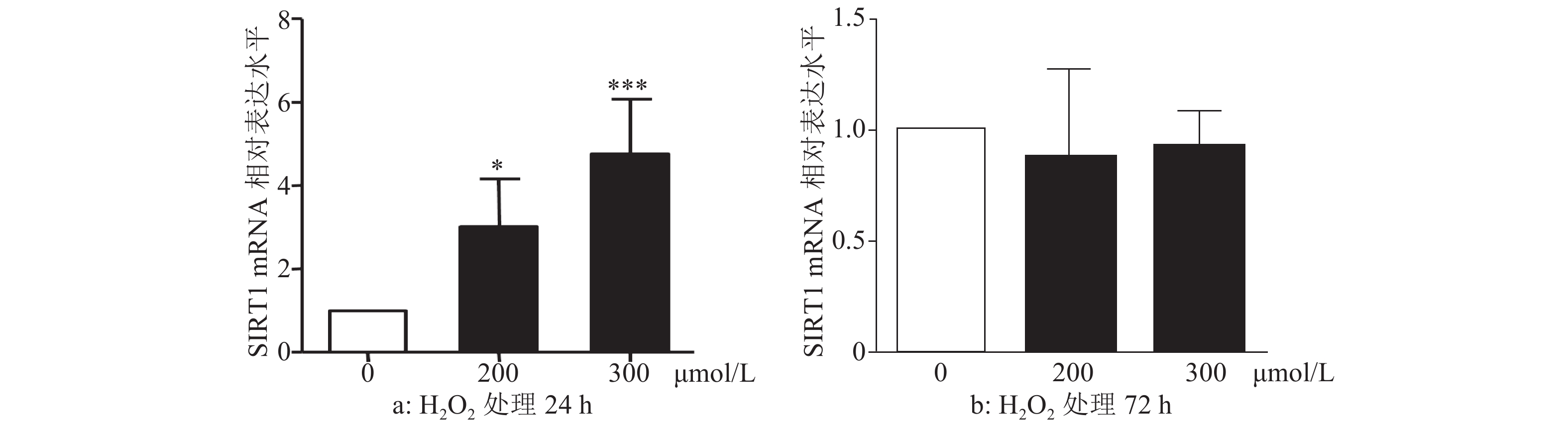
2.2 不同浓度H2O2处理RPE细胞中SIRT1 mRNA的表达变化(图2)
|
图 2 不同浓度H2O2处理RPE细胞对SIRT1mRNA表达的影响 |
从实时荧光定量PCR结果可知,随着H2O2处理浓度的增大,处理24 h的RPE细胞中SIRT1的mRNA呈浓度依赖上升趋势,P < 0.05,F = 13.83,差异有统计学意义;而处理时间72 h的RPE细胞中SIRT1有下降趋势。
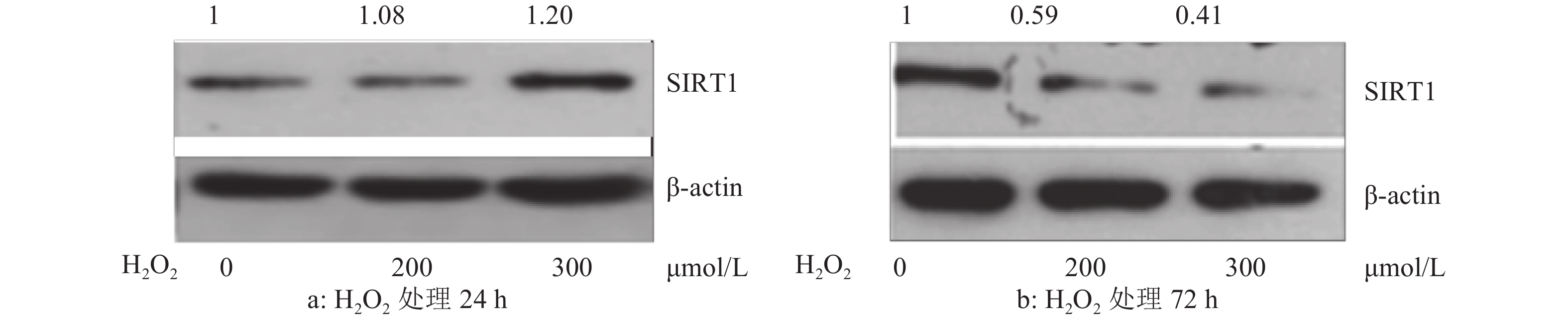
2.3 不同浓度H2O2处理RPE细胞中SIRT1蛋白表达变化(图3)
|
图 3 不同浓度H2O2处理RPE细胞对SIRT1的蛋白表达的影响 |
由WB检测结果可知,随着H2O2处理浓度的增强,RPE细胞中SIRT1的蛋白表达在24 h处理后有上升趋势,而处理72 h后表达显著下调,P < 0.05,F = 21.01,各浓度组间差异有统计学差异。
3 讨 论在生理条件下,RPE细胞随着年龄增长氧化损伤效应会逐步累积,引起功能失调,最终导致细胞凋亡与坏死[7]。近年来,研究发现氧化应激机制参与AMD的发生与发展,活性氧(reactive oxygen species,ROS)的累积引发RPE细胞进行性损伤,在细胞衰老过程中诱导其形态与功能异常[8]。本研究采用H2O2诱导RPE细胞氧化应激的模型,结果显示氧化损伤可导致体RPE细胞形态改变,且随H2O2浓度升高而严重。
SIRT1在维持细胞新陈代谢和氧化代谢平衡等方面发挥重要作用[9 – 10],其已被证明可通过上调抗氧化基因和调控特定转录因子以保护细胞免受氧化应激[11 – 12]。在人内皮细胞与巨噬细胞暴露于氧化应激条件下,SIRT1的表达和活性水平下降[13 – 14]。流行病学研究发现中国汉族人群SIRT1的单核苷酸多态性与AMD的发生相关[15],在分子生物学研究中发现SIRT1激活剂白藜芦醇可通过去乙酰化p53延缓RPE细胞的衰老[16]。也有研究证实抗氧化剂可通过激活SIRT1抑制细胞的炎症反应与凋亡[17],Li等[18]发现经H2O2和ox-LDL处理24 h后的RPE细胞SIRT1的表达下降。本研究在外源H2O2作用于RPE细胞24 h后,SIRT1在转录水平表达增加;而外源H2O2作用于RPE细胞72 h后,SIRT1在蛋白水平上呈现浓度依赖性显著降低。以往研究已发现,在正常情况下氧化还原反应对于机体防御机制可增强机体的抗炎和免疫能力,但当氧化代谢产物不断累积,抗氧化水平下降时则会打破原有的平衡从而启动氧化应激的损伤机制[19]。本研究结果表明在AMD的发生早期,SIRT1可能作为机体抗氧化应激的代偿机制;随着氧化应激逐步累积,机体抗氧化应激的代偿能力严重受损,导致机体氧化与抗氧化系统失衡,使得SIRT1表达水平下降,提示SIRT1在AMD发生过程在维持氧化与抗氧化应激系统平衡中发挥重要作用。
综上所述,在短期氧化应激下SIRT1通过上调参与抗氧化应激,而长期氧化应激下,SIRT1有浓度依赖性降低,证实SIRT1参与在AMD发生过程中氧化应激平衡环节,为其成为AMD新治疗靶点提供依据和参考。
| [1] | Beatty S, Koh H, Phil M, et al. The role of oxidative stress in the pathogenesis of age-related macular degeneration[J]. Survey of Ophthalmology, 2000, 45(2): 115–134. DOI:10.1016/S0039-6257(00)00140-5 |
| [2] | Cheung CM, Li X, Cheng CY, et al. Prevalence, racial variations, and risk factors of age-related macular degeneration in Singaporean Chinese, Indians, and Malays[J]. Ophthalmology, 2014, 121(8): 1598–1603. DOI:10.1016/j.ophtha.2014.02.004 |
| [3] | Jarrett SG, Boulton ME. Consequences of oxidative stress in age-related macular degeneration[J]. Molecular Aspects of Medicine, 2012, 33(4): 399–417. DOI:10.1016/j.mam.2012.03.009 |
| [4] | Lee IH, Cao L, Mostoslavsky R, et al. A role for the NAD-dependent deacetylase Sirt1 in the regulation of autophagy[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(9): 3374. DOI:10.1073/pnas.0712145105 |
| [5] | Maloney SC, Antecka E, Granner T, et al. Expression of SIRT1 in choroidal neovascular membranes[J]. Retina, 2013, 33(4): 862–866. DOI:10.1097/IAE.0b013e31826af556 |
| [6] | Golestaneh N, Yi C, Cheng SK, et al. Repressed SIRT1/PGC-1α pathway and mitochondrial disintegration in iPSC-derived RPE disease model of age-related macular degeneration[J]. Journal of Translational Medicine, 2016, 14(1): 344. DOI:10.1186/s12967-016-1101-8 |
| [7] | 邹玉凌. 绿原酸对氧化应激损伤人视网膜色素上皮细胞保护作用的分子机制[D]. 南昌大学医学院南昌大学, 2014. |
| [8] | Plafker SM, O'Mealey GB, Szweda LI. Mechanisms for countering oxidative stress and damage in retinal pigment epithelium[J]. International Review of Cell and Molecular Biology, 2012: 135–298. DOI:10.1016/B978-0-12-394309-5.00004-3 |
| [9] | Drobek-Så OM, Karczewicz D, Safranow K. The potential role of oxidative stress in the pathogenesis of the age-related macular degeneration (AMD)[J]. Postepy Hig Med Dosw, 2007, 61: 28–37. |
| [10] | Tanno M, Kuno A, Yano T, et al. Induction of manganese superoxide dismutase by nuclear translocation and activation of SIRT1 promotes cell survival in chronic heart failure[J]. Journal of Biological Chemistry, 2010, 285(11): 8375–8382. DOI:10.1074/jbc.M109.090266 |
| [11] | Kops GJ, Dansen TB, Polderman PE, et al. Forkhead transcription factor FOXO3a protects quiescent cells from oxidative stress[J]. Nature, 2002, 419(6904): 316–321. DOI:10.1038/nature01036 |
| [12] | Kawai Y, Garduño LK, Theodore M, et al. Acetylation-deacetylation of the transcription factor Nrf2(nuclear factor erythroid 2-related factor 2) regulates its transcriptional activity and nucleocytoplasmic localization[J]. Journal of Biological Chemistry, 2011, 286(9): 7629. DOI:10.1074/jbc.M110.208173 |
| [13] | Yang SR, Wright J, Bauter M, et al. Sirtuin regulates cigarette smoke-induced proinflammatory mediator release via RelA/p65 NF-κB in macrophages in vitro and in rat lungs in vivo: implications for chronic inflammation and aging [J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2007, 292(2): 567–576. DOI:10.1152/ajplung.00308.2006 |
| [14] | Arunachalam G, Yao H, Sundar IK, et al. SIRT1 regulates oxidant- and cigarette smoke-induced eNOS acetylation in endothelial cells: role of resveratrol[J]. Biochem Biophys Res Commun, 2010, 393(1): 66–72. DOI:10.1016/j.bbrc.2010.01.080 |
| [15] | Chen Z, Yi Z, Wei Z, et al. Single nucleotide polymorphisms of the Sirtuin 1(SIRT1) gene are associated with age-related macular degeneration in Chinese Han individuals: a case-control pilot study[J]. Medicine, 2015, 94(49): e2238. DOI:10.1097/MD.0000000000002238 |
| [16] | Zhuge CC, Xu JY, Zhang J, et al. Fullerenol protects retinal pigment epithelial cells from oxidative stress-induced premature senescence via activating SIRT1[J]. Investigative Ophthalmology and Visual Science, 2014, 55(7): 4628–4638. DOI:10.1167/iovs.13-13732 |
| [17] | Hytti M, Piippo N, Korhonen E, et al. Fisetin and luteolin protect human retinal pigment epithelial cells from oxidative stress-induced cell death and regulate inflammation[J]. Scientific Reports, 2015, 5: 17645. |
| [18] | Li L, Wei W, Zhang Y, et al. SirT1 and STAT3 protect retinal pigmented epithelium cells against oxidative stress[J]. Molecular Medicine Reports, 2015, 12(2): 2231. DOI:10.3892/mmr.2015.3570 |
| [19] | Kumar A, Ratan RR. Oxidative stress and Huntington's disease: the good, the bad, and the ugly[J]. J Huntingtons Dis, 2016, 5(3): 217–237. DOI:10.3233/JHD-160205 |
 2018, Vol. 34
2018, Vol. 34


