2. 贵阳医学院2013届研究生;
3. 贵阳医学院2012届本科生;
4. 贵阳医学院2015届研究生
砷中毒致氧化应激作用研究已有许多报道,但均基于血液和肝细胞等研究[1 – 2]。随着对砷中毒研究的深入,砷可通过血脑屏障在脑中蓄积,影响脑组织的化学稳定性、人类学习以及行为活动,砷对中枢神经系统的毒性作用越来越引起人们重视[3 – 4]。本研究通过建立亚急性砷中毒模型观察砷对大鼠脑组织c-fos、c-jun蛋白表达、还原型谷胱甘肽(L-glutathione, GSH)和 γ – 谷氨酰半胱氨酸合成酶(gamma-glutamylcysteine, γ-GCS)活性改变,探讨砷对脑神经元氧化应激影响及机制。结果报告如下。
1 材料与方法 1.1 实验动物清洁级SD大鼠56只,体重(170 ± 20)g,雌雄各半,由贵阳医学院动物实验中心提供并饲养,许可证号:SCXK(黔)2012 – 001。实验前大鼠适应性饲养1周,饲养环境温度为(20 ± 2)℃,光照周期为自然光10/14 h昼/夜循环,自由饮水进食。
1.2 主要试剂与仪器亚砷酸钠(分析纯)(上海晶纯试剂有限公司),砷标准应用液1 000 μg/L(国家标准物质研究中心),微量GSH测定试剂盒、γ-GCS测试盒(南京建成生物工程研究所),兔抗c-fos抗体(北京博奥森生物技术有限公司),兔抗c-jun抗体、二抗、浓缩型二氨基联苯胺染色试剂盒(北京中杉金桥生物技术有限公司)。MQX 200酶标仪(美国Bio-Tek公司),VISTA-MPS SPECTROME电感耦合等离子体发射光谱仪(ICP-AES)(美国安捷伦公司),BX 51 TRF奥林巴斯成像系统(中国广州市明美科技有限公司)。
1.3 分组与处理56只大鼠随机分为4组,每组14只,雌雄各半,适应性饲养1周后采用亚砷酸钠溶液自由饮水染毒。依据亚砷酸钠对大鼠的急性毒性LD50为41 mg/kg(经口)和大鼠的饮水量[5],饮水中亚砷酸钠浓度分别配置为50、10、2 mg/L,每隔1周称重并记录,计算每组大鼠平均体重,染毒时间30 d。乙醚麻醉大鼠,股动脉放血处死大鼠,收集血液,并迅速取出脑组织,放入装有冰浴生理盐水中漂洗,称重。取一侧大脑置于4 %甲醛溶液中固定、脱水、石蜡包埋、切片(5 μm)。每只大鼠切7张片,1张做苏木素伊红(hematoxylin-eosin,HE)染色,另6张分别用于c-fos、c-jun免疫组化染色。
1.4 指标与方法 1.4.1 大鼠血、脑砷水平测定取大鼠血液0.5 mL或大鼠脑组织0.2 g,加入6 mL硝酸和2 mL过氧化氢,放入微波消解仪中消解。每次至少有1个样品空白。ICP-AES测定标准系列和样品,计算样品中砷含量,其中血砷为mg/L,脑砷为μg/g。
1.4.2 大鼠脑组织病理检测切片经过常规脱蜡、水合后苏木素染色10 min,冲洗,置伊红液2 min,常规脱水,透明,封片。观察海马区神经元肿胀、变性、坏死等病理现象[6],其中,肿胀:表现为神经元体积较正常增大,胞浆染色变浅,胞核体积较正常增大,染色变浅;变性:神经元体积较正常增大,细胞浆染色变浅及尼氏体消失,其内可有大小不等圆形或类圆形空泡;坏死:神经元结构模糊或破坏,突起消失,细胞浆染色加深,细胞核结构模糊、固缩、碎裂、消失或胞体增大/缩小,核固缩/消失。计算各组神经元肿胀、变性、坏死百分率。
1.4.3 体重与脑重指标观察每隔1周称重并记录,计算每组大鼠平均体重。处死大鼠后,迅速取大脑,称重,并计算脑系数,单位:g/100 g。
1.4.4 大鼠脑组织中GSH水平和 γ-GCS活性测定分别用5,5–二硫二硝基苯甲酸速率微板法测定脑组织GSH含量,微量定磷法测定脑组织中 γ-GCS活性。
1.4.5 大鼠脑组织c-fos、c-jun蛋白表达检测6张切片经60 ℃烘片1 h,脱蜡至水合,3 %过氧化氢37 ℃孵育20 min,以消除内源性过氧化物酶活性。分别采用煮沸(用于c-fos蛋白)、高压法(用于c-jun蛋白)进行抗原修复,用10 %正常山羊血清37 ℃孵育20 min封闭。加一抗c-fos(1 : 300)、c-jun(1 : 100),4 ℃冰箱过夜;加二抗,37 ℃孵育20 min,加辣根酶,37 ℃孵育20 min,二氨基联苯胺染色,显微镜观察显色,苏木素复染,封片。c-fos以胞核呈棕黄色为抗原阳性,反之则为阴性细胞,c-jun以胞核显棕色或棕黄色为抗原阳性,胞核蓝色为阴性细胞;每组取6张切片,每张切片在海马和皮质区随机选择5个高倍视野( × 400)计数阳性细胞数和总细胞数,取平均数,计算阳性细胞表达率。
1.5 统计分析数据以
|
表 1 染砷对大鼠血砷与脑砷含量影响(
|
与对照组比较,各剂量染砷组大鼠血砷水平明显升高,差异有统计学意义(P < 0.05),呈剂量效应关系( P < 0.05);与对照组比较,各剂量染砷组大鼠脑砷含量升高,中、高剂量染砷组大鼠脑砷水平高于低剂量染砷组,差异有统计学意义( P < 0.05)。相关分析结果显示,大鼠脑砷水平和血砷水平呈正相关( r=0.749,P < 0.001)。
2.2 染砷对大鼠脑组织病理学影响(图1)
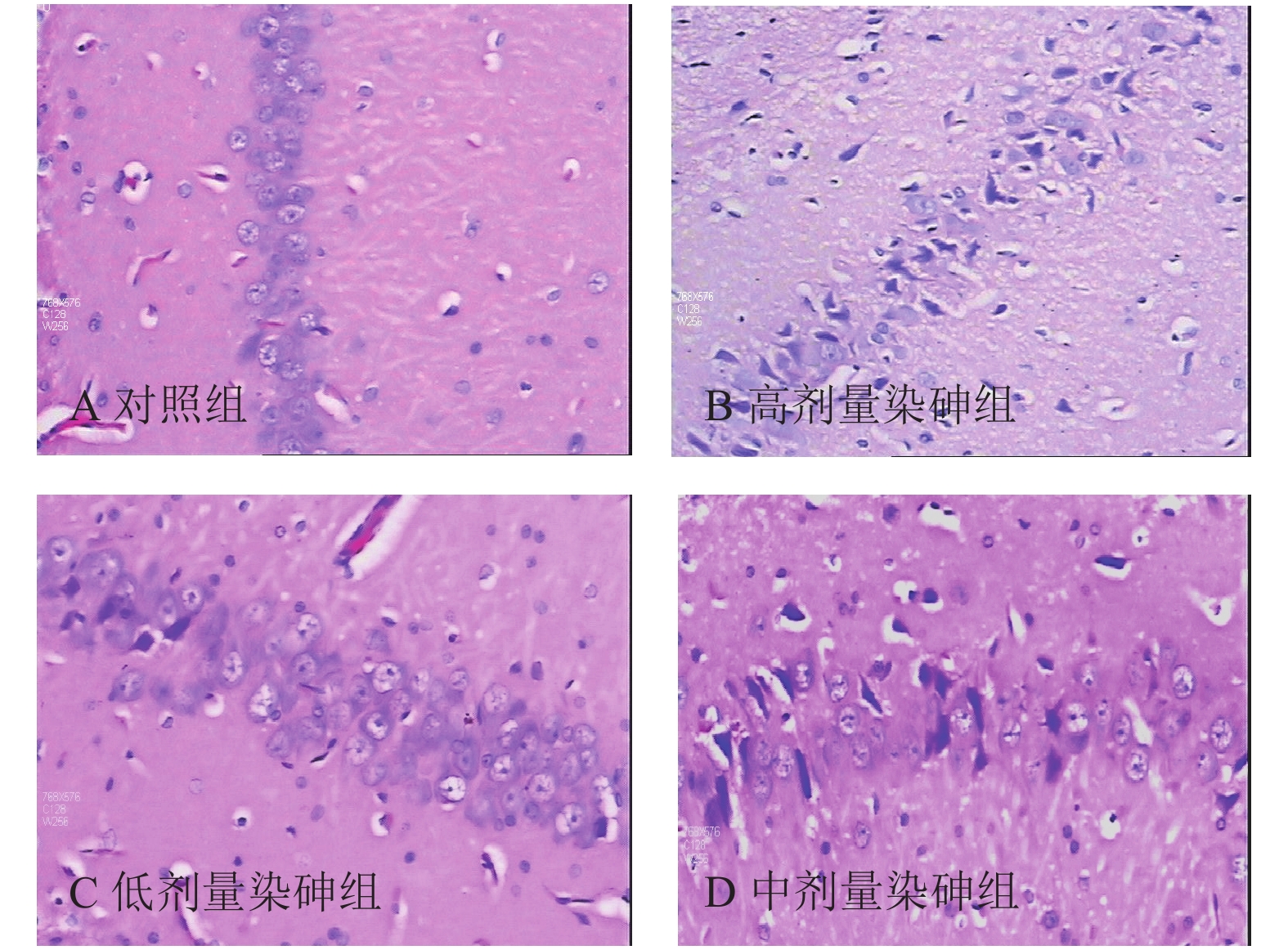
|
注:A:对照组;B、C、D:高、中、低剂量染砷组。 图 1 染砷对大鼠脑海马神经元病理学影响(HE,× 200) |
结果显示,对照组及低、中、高剂量染砷组大鼠海马区神经元肿胀率分别为0、50 %、30 %、50 %;神经元变性率分别为0、40 %、30 %、40 %;神经元坏死率分别为0、0、20 %、40 %。
2.3 染砷对大鼠脑发育及抗氧化能力影响(表2)|
表 2 染砷对大鼠脑发育及抗氧化能力影响(
|
各组大鼠体重、脑系数差异无统计学意义(F=0.612、0.017,P > 0.05);与对照组比较,各染砷组大鼠脑组织中 γ-GCS活性和GSH含量均明显下降,差异有统计学意义( F=54.821、75.902,P < 0.05),呈剂量效应关系( P < 0.05)。
2.4 染砷对大鼠脑组织c-fos和c-jun表达影响(表3)|
表 3 染砷对大鼠脑海马区及皮质c-fos和c-jun表达影响(%, |
与对照组比较,各染砷组大鼠脑海马区、皮质区c-fos阳性率升高(F=199.276、126.623,P < 0.05);与对照组比较,各染砷组大鼠脑海马区、皮质区c-jun阳性率升高,差异有统计学意义( F=274.144、258.523,P < 0.05)。多元相关分析结果显示,脑组织 γ-GCS活性与脑组织c-fos和c-jun表达水平呈负相关( P < 0.05)。
3 讨 论本研究结果显示,染砷组大鼠血砷含量显著高于对照组,且血砷值随饮水砷浓度增加而升高;大鼠脑砷含量也呈现相同趋势,表明染砷组大鼠通过饮水,砷已蓄积于脑组织内,并出现病理改变。提示亚急性砷中毒模型建立成功。GSH是体内重要的抗氧化物质,又可提供还原性巯基,使细胞内含巯基酶和蛋白巯基免受损害,所以细胞内GSH含量通常表征细胞的抗氧化能力。γ-GCS是GSH合成的限速酶,通过转录和翻译后调节来控制GSH合成[7],并能调节细胞内GSH水平[8 – 9],因此 γ-GCS活性也可反映机体细胞的抗氧化能力。研究显示,肺组织损伤可致 γ-GCS mRNA表达上升,提高抗氧化能力,发生氧化应激[10 – 11];用中成药治疗大鼠急性肝损伤后,γ-GCS蛋白表达明显增加[12];而肾组织损伤 γ-GCS mRNA表达下降,抗氧化能力下降[13 – 14]。本研究结果显示,染砷组大鼠脑组织 γ-GCS活性明显降低,同时GSH含量下降,并呈剂量效应关系。这一结果与已有的研究结果相似[15]。提示砷在脑中蓄积导致 γ-GCS活性降低,进而抑制GSH合成、降低脑组织抗氧化能力可能是亚急性砷暴露致中枢神经毒性作用机制之一。
激活子蛋白–1(activator protion,AP-1)在调节 γ-GCS表达中具有重要作用,可通过MAPK/AP-1信号通路调节 γ-GCS mRNA表达[16]。AP-1蛋白是由Jun和Fos蛋白家族成员通过形成Jun/Jun或Jun/Fos二聚体的形式结合,AP-1的 – 269~– 263 bp位点在氧化应激时参与转录调控 γ-GCS。研究表明镉暴露2 h后即早基因c-jun、c-fos及具有c-jun复合体的AP-1活性变化增加了肺上皮细胞 γ-GCS mRNA、蛋白表达和活性及GSH水平,保护肺细胞免受损害 [17];砷暴露15 d后,大鼠脑海马组织c-fos、c-jun蛋白表达增加,同时脑细胞凋亡指数也增加[18]。在砷暴露肺上皮细胞的研究中显示,砷暴露30 min,细胞内fos、jun mRNA增加;4 h后,γ-GCS mRNA表达增加[19]。本研究结果显示,染砷组大鼠脑海马和皮质神经元内c-fos和c-jun表达明显增加,但fos和jun表达水平与 γ-GCS活性呈负相关(P < 0.05)。可能与砷暴露短时间即早基因c-fos、c-jun蛋白表达上调,γ-GCS表达也上调,发生氧化应激;但随着砷持续暴露后c-fos、c-jun过度表达,导致脑神经细胞凋亡,由于脑神经细胞再生能力极低导致脑组织 γ-GCS活性下降,GSH合成减少有关;还可能与亚急性砷中毒通过影响MAPK/AP-1通路某个位点调节使 γ-GCS表达下降,导致脑组织氧化应激能力降低。其详细机制值得进一步深入研究。
| [1] | 许昭,王舟,李健军,等. 氧化应激在砷中毒中作用研究进展[J]. 中国地方病防治杂志, 2011, 26(5): 339–343. |
| [2] | 周倩,何云,关君. 砷中毒所致氧化应激与肝脏损伤[J]. 中国地方病学杂志, 2007, 26(1): 114–116. DOI:10.3760/cma.j.issn.1000-4955.2007.01.046 |
| [3] | 李军,王三祥,王正辉,等. 砷中毒病区儿童智力水平调查[J]. 中国公共卫生, 2006, 22(7): 856–857. DOI:10.3321/j.issn:1001-0580.2006.07.053 |
| [4] | 王腾, 虞梁. 亚急性砷中毒对中枢神经系统影响的临床研究[J]. 中国地方病防治杂志, 2014, 29(4): 318. |
| [5] | 王朝晖,于远望,赵延红,等. 雄性SD大鼠饮水量及大便量生理值测定[J]. 中国比较医学杂志, 2004, 14(4): 228. DOI:10.3969/j.issn.1671-7856.2004.04.020 |
| [6] | 赵丽,韩威,陈嘉峰,等. 酒精中毒大鼠脑心血管病变及脑组织损伤的病理观察[J]. 中风与神经疾病杂志, 2005, 22(1): 51–53. DOI:10.3969/j.issn.1003-2754.2005.01.016 |
| [7] | Kumar S, Kasturia N, Sharma A, et al. Redox-dependent stability of the γ-glutamylcysteine synthetase enzyme ofEscherichia coli : a novel means of redox regulation [J]. Biochemical Journal, 2013, 449(3): 783–794. DOI:10.1042/BJ20120204 |
| [8] | Narasimhan M, Rathinam M, Patel D, et al. Astrocytes prevent ethanol induced apoptosis of Nrf2 depleted neurons by maintaining GSH homeostasis[J]. Open J Apoptosis, 2012, 1(2): 1–11. |
| [9] | Hassanin KM, Abd El-Kawi SH, Hashem KS. The prospective protective effect of selenium nanoparticles against chromium-induced oxidative and cellular damage in rat thyroid[J]. Int J Nanomedicine, 2013, 8: 1713–1720. |
| [10] | 张伟,孙璐璐,韩伟,等. COPD模型大鼠不同分期肝、肺组织γ-GCSmRNA表达水平的比较研究[J]. 北京中医药, 2012, 31(10): 786–789. |
| [11] | 蔡成,吕勤,陈赫赫,等. 谷胱甘肽与γ-谷氨酰半胱氨酸合成酶在早产新生大鼠高体积分数氧肺损伤中的抗氧化作用[J]. 中华实用儿科临床杂志, 2013, 28(22): 1729–1731. |
| [12] | Zhou LF, Peng HY, Li SJ. Paeoniflorin attenuates CLP-induced acute liver injury by activating Nrf2/γ-GCS in rats[J]. Int J Clin Exp Med, 2016, 9(8): 15935–15941. |
| [13] | 张北平,刘树峰,王海,等. γ-GCS及TGF-β在MRL/1pr雌性小鼠肾组织表达研究[J]. 北方药学, 2016, 13(7): 133–134. |
| [14] | 陈瑞林,陶怡,张北平,等. MRL/lpr狼疮鼠肾组织中氧化状态及γ-GCS的表达[J]. 南方医科大学学报, 2011, 31(1): 138–140. |
| [15] | 李煌元, 吴思英, 石年. 溴氰菊酯对γ-GCS活力和谷胱甘肽含量影响[J]. 中国公共卫生, 2012, 28(12): 1587–1589. DOI:10.11847/zgggws-2012-28-12-12 |
| [16] | Miyahara Y, Ikeda S, Muroya T, et al. Nε-(carboxymethly) lysine indues γ-glutawylcysteine synthetase in RAW214.7 cell [J]. Bioche-mical and Biophysical Reseach Communication, 2002, 296(1): 32–40. DOI:10.1016/S0006-291X(02)00816-1 |
| [17] | Shukla GS, Shukla A, Potts RJ, et al. Cadmium-mediated oxidative stress in alveolar epithelial cells induces the expression of γ-glutamylcysteine synthetase catalytic subunit and glutathione S-transferase α and π isoforms: potential role of activator protein-1[J]. Cell Biology and Toxicology, 2000, 16(6): 347–362. DOI:10.1023/A:1007696610186 |
| [18] | 周华芳,余堃,杨梅,等. 砷对大鼠脑海马c-fos, c-jun表达和细胞调亡影响[J]. 中国公共卫生, 2014, 30(11): 1386–1388. DOI:10.11847/zgggws2014-30-11-07 |
| [19] | Li M, Cai JF, Chiu JF. Arsenic induces oxidative stress and activates stress gene expressions in cultured lung epithelial cells[J]. Journal of Cellular Biochemistry, 2002, 87(1): 29–38. DOI:10.1002/(ISSN)1097-4644 |
 2018, Vol. 34
2018, Vol. 34
