肺炎球菌是引起儿童肺炎、脑膜炎、菌血症等严重疾病的主要病原菌,也是引起急性中耳炎和鼻窦炎等的常见病因。肺炎球菌性疾病(pneumococcal diseases, PDs)是全球严重的公共卫生问题之一,给全球儿童和成人带来了严重的健康威胁和沉重的经济负担,尽早采用疫苗预防可有效降低其发病率和死亡率[1]。13价肺炎球菌多糖蛋白结合疫苗(13-valentpneumococcal conjugate vaccine,PCV13)是继7价肺炎球菌多糖蛋白结合疫苗(7-valent pneumococcal conjugate vaccine,PCV7)和10价肺炎球菌多糖蛋白结合疫苗(10-valent pneumococcal conjugate vaccine,PCV10)以来血清型覆盖率最广的肺炎球菌结合疫苗,于2010年在美国获批上市,包括1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F等13个血清型的荚膜多糖,与蛋白载体CRM197偶联结合成多糖 – 蛋白结合物,为T细胞依赖性抗原,可在婴幼儿体内诱导产生有效的保护性抗体,发挥很好的免疫效果。据世界卫生组织(World Health Orgnization, WHO)估算,2008年约47.6万 < 5岁儿童死于PDs,PDs是全球 < 5岁儿童疫苗可预防的首要死因 [2],且发展中国家PDs的发病率和死亡率远高于发达国家,中国 < 5岁儿童PDs病例数位列全球第二,占总病例数的12 % [3]。WHO建议,在婴儿接种PCV13时,可采用3剂基础免疫方案或替代性的2剂基础免疫加1剂加强免疫方案,但在疾病负担较重的发展中国家建议应尽早开展疫苗接种,以最大程度上降低疾病的发病率和死亡率[3]。因此,中国应尽早开展肺炎球菌疫苗接种。我国目前批准的PCV13推荐免疫程序为2、4、6月龄进行基础免疫,12~15月龄加强免疫,基础免疫可于6周龄开始,但6周龄开始PCV13接种尚缺乏证据支持。因此,本文旨在对国外PCV13及同类疫苗于6周龄开始基础免疫的相关文献进行综述,分析PCV13于6周龄开始基础免疫的免疫原性、有效性及安全性,为我国6周龄开始PCV13接种提供依据。
1 免疫原性分析(表1、图1)6周龄开始PCV13基础免疫各疫苗肺炎球菌血清型在婴幼儿中均具有良好的免疫原性。PCV13于6周龄开始基础免疫的免疫原性研究报道较少。印度2007 — 2009年的一项Ⅲ期随机双盲对照试验将709名健康婴幼儿随机分为2组,一组接种PCV13,另一组接种PCV7,分别在6、10、14周龄进行基础免疫,在12月龄进行加强免疫,然后分别在基础免疫和加强免疫后1个月测定肺炎球菌血清型特异性免疫球蛋白IgG浓度,对比研究PCV13(n = 354)和PCV7(n = 355)在健康婴幼儿中的免疫原性。研究结果发现,PCV13接种组基础免疫和加强免疫1个月后各血清型特异性抗体IgG浓度 ≥ 0.35 μg/mL的受试者比例分别为84.7 %~99.5 %和90.2 %~100.0 %,各血清型IgG几何平均浓度(geometric mean concentration, GMC)分别为0.80~2.84 μg/mL和0.91~14.12 μg/mL(表1),PCV13和PCV7接种组在7个共有血清型方面免疫原性相当,而对于PCV13新增6个血清型而言,PCV13诱导的抗体反应明显高于PCV7接种组[4]。
| 表 1 PCV13在印度健康婴幼儿中于6、10、14周龄基础免疫及12月龄加强免疫后血清型特异性抗体IgG浓度及IgG浓度≥0.35 μg/mL的受试者比例表[4] |
6周龄开始与PCV13同类的PCV7和9价肺炎球菌多糖蛋白结合疫苗(9-valent pneumococcal conjugate vaccine,PCV9)疫苗接种各疫苗血清型也可产生较好的免疫原性。南非2009年10月 — 2010年2月的一项前瞻性纵向队列研究纳入250名健康婴幼儿,分别在其6、14和40周龄时接种PCV7,然后在第1、2剂接种后1个月和第3剂接种前、后2周分别测定血清型特异性抗体IgG浓度,结果如图1所示,发现婴幼儿接种2剂PCV7后除血清型6B外,其他血清型特异性抗体IgG浓度 ≥ 0.35 μg/mL的比例均 ≥ 89 %,血清型6B的抗体浓度 ≥ 0.35 μg/mL的比例为84 %,而接种第3剂后抗体浓度显著升高,各血清型特异性抗体IgG浓度 ≥ 0.35 μg/mL的比例均 > 96.8 % [5]。南非索韦托地区另一项随机双盲安慰剂对照研究将500名婴幼儿随机分成2组,其中250名婴幼儿于6、10和14周龄时接种PCV9,另外250名婴幼儿在相同时间接种安慰剂,然后在18周龄时分别测定血清型特异性抗体浓度,发现9个疫苗血清型特异性抗体GMC在2.91~7.31 μg/mL,显著高于安慰剂组(各血清型均 < 0.35 μg/mL) [6]。

|
图 1 南非婴幼儿6、14和40周龄接种PCV7前后血清型特异性抗体浓度变化图[5] |
综上所述,一项研究综述了2月龄开始PCV13基础免疫的免疫原性,发现3剂次基础免疫后各血清型IgG抗体 ≥ 0.35 ug/mL的比例均 ≥ 82 %,且各血清型抗体GMC在0.5~14 μg/mL[7]。因此,6周龄开始PCV13基础免疫与2月龄开始PCV13基础免疫具有相似的免疫原性。
2 疫苗有效性分析(表2、图2)6周龄开始PCV13基础免疫的免疫程序对儿童及成人均具有较好的保护效果,可显著降低儿童及成人侵袭性肺炎球菌性疾病(invasive pneumococcal diseases, IPD)发病率,同时降低肺炎球菌对抗生素的耐药性。南非2009年引入PCV7,用于婴幼儿于6、14和36周龄接种,2011年8月由PCV13代替,到2012年,12月龄婴幼儿疫苗三剂接种率达81 %[8 – 9]。南非2012年1月 — 2014年12月的一项针对PCV13疫苗效果的病例对照研究选取2011年8月以后出生且 ≥ 16周龄的240名未感染艾滋病病毒(human immunodeficiency virus,HIV)和75例感染HIV的IPD患儿作为研究组,同时在医院选取1 118名未感染HIV和283例感染HIV的儿童作为相应的对照组,收集IPD病例标本检测肺炎球菌血清型,然后结合每名儿童的PCV13接种情况,研究接种 ≥ 2剂PCV13与不接种PCV13相比对预防儿童IPD的效果,研究结果如表2所示,结果发现在HIV未感染儿童中,接种 ≥ 2剂PCV13对预防儿童PCV13疫苗血清型IPD的效果为85 %(95 % CI = 37 %~96 %),而在HIV感染儿童中效果高达91 %(95 % CI = – 35 %~100 %),此外,PCV13预防HIV未感染儿童全因血清型IPD效果为52 %,预防19A血清型IPD的效果为94 % [9]。南非的一项全国性主动监测研究分析了从PCV7引入前到PCV13引入后的8年间(2005 — 2012年)各年龄段人群IPD发病率的变化,8年间共监测到IPD病例35 192例,全人群IPD年发病率从PCV7引入前的9.4/10万下降到2012年的5.7/10万,降幅达40 %(95 % CI = 37 %~42 %);其中,发病率下降最显著的为 < 2岁儿童,其从PCV7引入前的54.8/10万降至2012年的17.0/10万,降幅达69 %(95 % CI = 65 %~72 %);2012年,PCV13相对于PCV7新增的6个血清型儿童IPD年发病率显著下降了57 %(95 % CI = 42 %~68 %),其中主要来源于19A血清型IPD发病率的下降(70 %,95 % CI = 55 %~81 %),此外,其他年龄段儿童及成人IPD发病率也显著下降。8年间青霉素和头孢曲松不敏感型IPD年发生率分别下降了82 %(95 % CI = 78 %~85 %)和85 %(95 % CI = 77 %~91 %),由多重耐药菌株引起的病例数下降了84 %(95 % CI = 79 %~88 %)[8]。南非另一项针对儿童脓胸发病情况的调查研究发现,2006年12月 — 2011年12月 < 12岁儿童脓胸发病率为10.4 ‰,而PCV13引入后的2012年1月 — 2014年12月脓胸发病率降为4.2 ‰,降幅达50 % [10]。
| 表 2 接种≥2剂PCV13与不接种PCV13相比预防儿童IPD的效果 |
6周龄开始PCV13基础免疫的免疫程序可显著降低儿童及成人肺炎球菌鼻咽部定殖率。南非索韦托地区2009年将PCV7纳入免疫规划,用于婴幼儿6、14和40周龄接种,2011年5月由PCV13代替[11]。索韦托地区一项研究于2010年5月 — 2011年2月纳入1 376名母亲及其1 411名0~12岁儿童(其中35名母亲有2名儿童入组),其中HIV感染的母亲和儿童分别为704和713例,然后于PCV13引入后的2012年5月 — 2013年4月再纳入1 556名母亲及其1 649名儿童,其中HIV感染的母亲和儿童分别为608和616例,2个时期均分别收集入组母亲及儿童的鼻咽拭子样本,检测肺炎球菌鼻咽部定殖情况,研究结果如 图2所示,结果发现PCV13引入后,PCV13疫苗血清型肺炎球菌鼻咽部定殖率相对于PCV7时期显著下降,HIV未感染儿童2个时期的疫苗血清型肺炎球菌鼻咽部定殖下降的OR值为0.32(95 % CI = 0.25~0.40),而HIV感染儿童则为0.37(95 % CI = 0.28~0.49);此外,HIV未感染母亲2个时期的疫苗血清型肺炎球菌鼻咽部定殖下降OR值为0.44(95 % CI = 0.23~0.81),HIV感染母亲PCV13疫苗血清型肺炎球菌鼻咽部定殖在PCV13引入后也显著下降[11]。
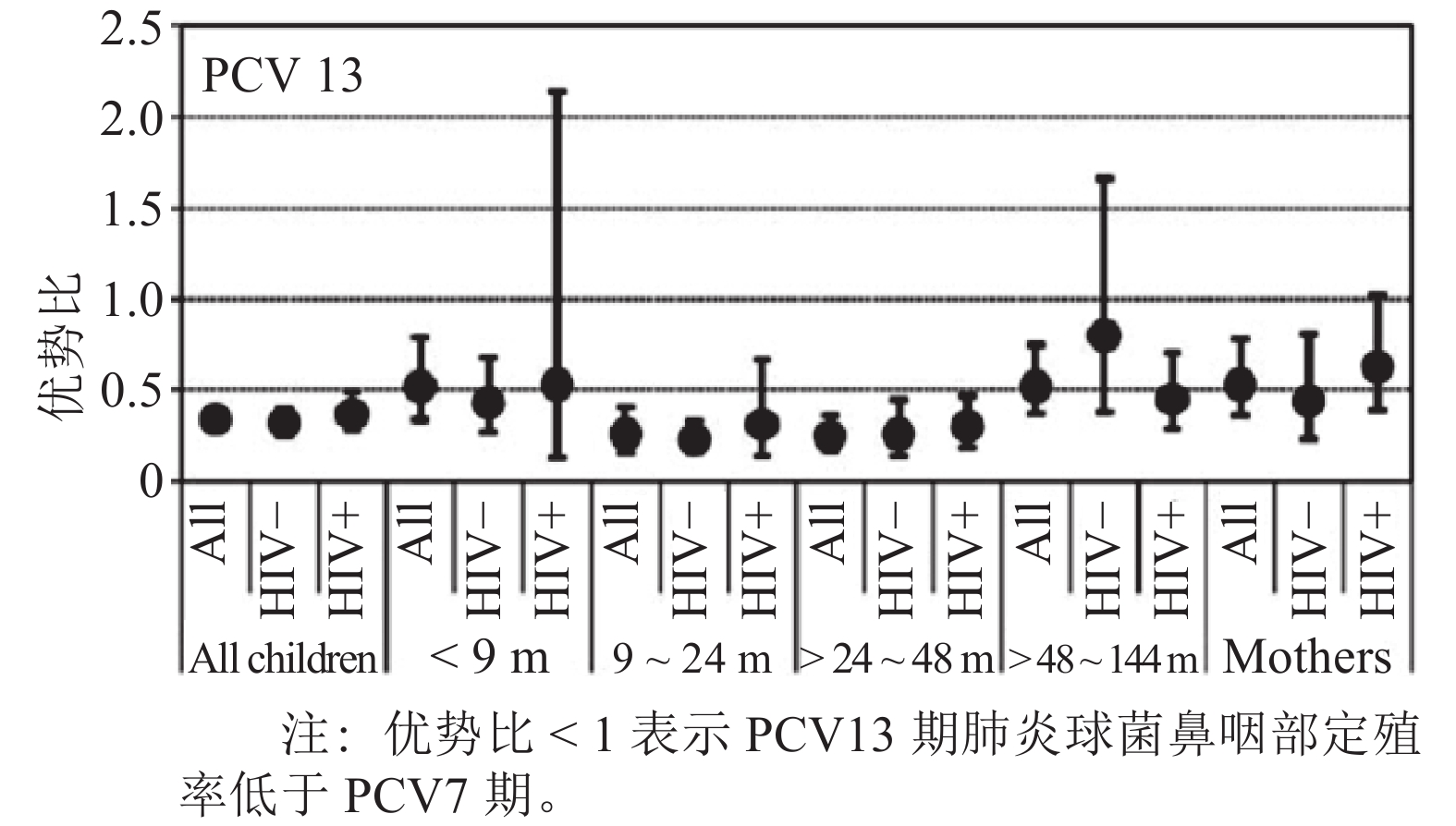
|
图 2 南非索韦托地区儿童及其母亲PCV7期(2010年5月 — 2011年2月)与PCV13期(2012年5月 — 2013年4月)PCV13疫苗血清型肺炎球菌鼻咽部定殖情况对比图[11] |
6周龄开始接种与PCV13同类的PCV7和PCV9也可显著降低儿童IPD发生率,同时显著降低耐药性肺炎球菌的感染。但PCV13具有更广的血清型覆盖率,由此可推测PCV13预防IPD的效果优于PCV7和PCV9。南非一项针对PCV7疫苗效果的病例对照研究中,PCV7用于婴幼儿6、14周龄和9月龄接种,结果发现在HIV未感染儿童中接种 ≥ 2剂PCV7预防疫苗血清型IPD的效果为74 %(95 % CI = 25 %~91 %),而在HIV未感染儿童中接种 ≥ 2剂PCV7预防所有血清型多重耐药IPD的效果为96 %(95 % CI = 62 %~100 %),在HIV未感染和感染儿童中接种 ≥ 3剂PCV7对疫苗血清型IPD的效果分别为90 %(95 % CI = 14 %~99 %)和57 %(95 % CI = – 371 %~96 %),而在有HIV暴露但未感染的儿童中,接种 ≥ 2剂PCV7对疫苗血清型IPD的效果为92 %(95 % CI = 47 %~99 %)[12]。南非地区另一项针对PCV9的随机双盲临床试验,选取19 922名儿童在6、10和14周龄各接种1剂PCV9,另外选取19 914名儿童在相同时间接种安慰剂,然后分别进行随访,研究发现在未感染HIV的儿童中PCV9疫苗血清型IPD发生率下降了83 %(95 % CI = 39 %~97 %),而在HIV感染儿童中疫苗血清型IPD发生率则下降了65 %(95 % CI = 24 %~86 %);此外,在IPD病例中,PCV9接种组青霉素耐药型病例发生率降低了67 %(95 % CI = 19 %~88 %),复方新诺明耐药型病例发生率降低了56 %(95 % CI = 16 %~78 %),而对 ≥ 1种抗生素(青霉素、四环素、红霉素、克林霉素、氯霉素、利福平或复方新诺明)耐药的病例发生率则降低了56 %(95 % CI = 21 %~77 %)[13]。
未检索到6周龄开始PCV13接种与2月龄开始接种效果比较的文献,而不同研究由于随访时间、结局变量定义等不同,无法直接比较,故无法给出与2月龄开始接种的有效性比较结论。
3 安全性分析PCV13于6周龄开始基础免疫在婴幼儿中具有良好的安全性。印度的一项研究将PCV7和PCV13分别用于婴幼儿在6、10、14周龄进行基础免疫,12月龄进行加强免疫,对比研究PCV13与PCV7在婴幼儿中的安全性,研究结果表明2种疫苗接种组局部反应均为轻度,且2组发生率相当,PCV13组婴幼儿出现明显压痛的儿童比例为15.8 %~42.2 %,而PCV7组为17.1 %~40.5 %,无出现严重肿胀和红肿病例;此外,2种疫苗接种组出现发热的儿童比例也相似,PCV13接种组出现失眠和使用退烧药的婴幼儿比例均显著低于PCV7组;2种疫苗接种组不良事件发生率与正常儿童患病率相当,PCV13和PCV7组在基础免疫中出现 ≥ 1次不良事件的发生率分别为47.0 %和48.2 %,而在加强免疫中的发生率分别降为15.2 %和12.5 %,2组不良事件发生率相似,均未出现与疫苗接种相关的严重不良事件,说明PCV13用于婴幼儿在6、10、14周龄进行基础免疫,12月龄进行加强免疫(3 + 1免疫程序)的安全性与PCV7相当,均在可接受范围内[4]。
与PCV13同类的PCV9于6周龄开始接种也具有良好的安全性,由此推断,PCV13用于婴幼儿6、10和14周龄接种(3 + 0免疫程序)可能具有同样良好的安全性。南非索韦托地区关于PCV9用于婴幼儿6、10和14周龄接种的安全性研究显示,每剂PCV9接种后,接种组与安慰剂对照组儿童局部不良反应无明显差异,2组婴幼儿接种当天出现烦躁症状的儿童比例均约为30 %,且2组均有约15 %的婴幼儿在接种后服用了扑热息痛;此外,接种当天安慰剂对照组约4 %的婴幼儿出现食欲不佳,而PCV9接种组出现食欲不佳的儿童比例仅1.2 %,2组在其他全身不良事件方面均无明显差异[6]。
未检索到6周龄开始PCV13接种与2月龄开始接种安全性比较的文献,而不同研究由于安全性监测方法、判定标准不同,无法直接比较,故无法给出与2月龄开始接种的安全性比较结论。
4 小 结PCV13用于6周龄开始基础免疫可诱导婴幼儿体内产生良好的免疫应答,6周龄开始接种的免疫程序在婴幼儿中具有较强的免疫原性,与2月龄开始PCV13基础免疫诱导的免疫应答相似,且不良事件发生率在可接受范围内,表现出良好的安全性。此外,PCV13于6周龄开始基础免疫时可显著降低儿童的IPD发病率,减少儿童肺炎球菌鼻咽部定殖,降低肺炎球菌对抗生素的耐药性,同时表现出对非疫苗接种目标人群的间接保护效果。综上所述,PCV13于6周龄开始基础免疫的免疫程序在婴幼儿中具有良好的免疫原性、有效性和安全性。
| [1] | 裴迎新, 曾光. 7价肺炎球菌多糖结合疫苗对全球肺炎球菌疾病的影响[J]. 中国疫苗和免疫, 2014, 20(5): 465–472. |
| [2] | World Health Organization. Pneumococcal vaccines WHO position paper – 2012[J]. Wkly Epidemiol Rec, 2012, 87(14): 129–144. |
| [3] | World Health Organization. Estimates of disease burden and cost-effectiveness[EB/OL]. [2017 – 11 – 15]. http://www.who.int/immunization/monitoring_surveillance/burden/estimates/en/. |
| [4] | Amdekar YK, Lalwani SK, Bavdekar A, et al. Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine in healthy infants and toddlers given with routine vaccines in India[J]. Pediatr Infect Dis J, 2013, 32(5): 509–516. DOI:10.1097/INF.0b013e31827b478d |
| [5] | Jones SA, Groome M, Koen A, et al. Immunogenicity of seven-valent pneumococcal conjugate vaccine administered at 6, 14 and 40 weeks of age in South African infants[J]. PLoS One, 2013, 8(8): e72794. DOI:10.1371/journal.pone.0072794 |
| [6] | Mbelle N, Huebner RE, Wasas AD, et al. Immunogenicity and impact on nasopharyngeal carriage of a nonavalent pneumococcal conjugate vaccine[J]. J Infect Dis, 1999, 180(4): 1171–1176. DOI:10.1086/jid.1999.180.issue-4 |
| [7] | Nunes MC, Madhi SA. Review on the immunogenicity and safety of PCV-13 in infants and toddlers[J]. Expert Rev Vaccines, 2011, 10(7): 951–980. DOI:10.1586/erv.11.76 |
| [8] | von Gottberg A, de Gouveia L, Tempia S, et al. Effects of vaccination on invasive pneumococcal disease in South Africa[J]. N Engl J Med, 2014, 371(20): 1889–1899. DOI:10.1056/NEJMoa1401914 |
| [9] | Cohen C, von Mollendorf C, de Gouveia L, et al. Effectiveness of the 13-valent pneumococcal conjugate vaccine against invasive pneumococcal disease in South African children: a case-control study[J]. Lancet Glob Health, 2017, 5(3): e359–369. DOI:10.1016/S2214-109X(17)30043-8 |
| [10] | Zampoli M, Kappos A, Wolter N, et al. Etiology and incidence of pleural empyema in South African Children[J]. Pediatr Infect Dis J, 2015, 34(12): 1305–1310. DOI:10.1097/INF.0000000000000880 |
| [11] | Nzenze SA, von Gottberg A, Shiri T, et al. Temporal changes in pneumococcal colonization in HIV-infected and HIV-uninfected mother-child pairs following transitioning from 7-valent to 13-valent pneumococcal conjugate vaccine, Soweto, South Africa[J]. J Infect Dis, 2015, 212(7): 1082–1092. DOI:10.1093/infdis/jiv167 |
| [12] | Cohen C, von Mollendorf C, de Gouveia L, et al. Effectiveness of 7-valent pneumococcal conjugate vaccine against invasive pneumococcal disease in HIV-infected and -uninfected children in South Africa: a matched case-control study[J]. Clin Infect Dis, 2014, 59(6): 808–818. DOI:10.1093/cid/ciu431 |
| [13] | Klugman KP, Madhi SA, Huebner RE, et al. A trial of a 9-valent pneumococcal conjugate vaccine in children with and those without HIV infection[J]. N Engl J Med, 2003, 349(14): 1341–1348. DOI:10.1056/NEJMoa035060 |
 2018, Vol. 34
2018, Vol. 34
