2. 国家中药品种保护评审委员会
二甘醇是一种无色透明的粘稠液体,由于其具有较好的溶解性和保湿性,且价格便宜,常常作为丙二醇和甘油的替代品,作为保湿剂添加于化妆品中[1 – 2]。虽然二甘醇属于低毒类化学物质,但摄入相对高剂量的二甘醇可导致中枢神经的抑制和肝肾的损害[3 – 4]。2015年我国首次将二甘醇作为禁用组分列入了《化妆品技术规范》(2015年版),规定不得向化妆品中添加二甘醇,由原料带入二甘醇的量不得超过0.1 %。化妆品基质复杂,不同基质的前处理方法不同,而目前《化妆品规范》中仅规定了化妆品原料丙二醇中二甘醇含量的测定方法,未提出不同基质的测定方法和区别,在实际运用时存在许多局限性。本研究就不同基质的化妆品进行了深入的研究。结果报告如下。
1 材料与方法 1.1 主要仪器和试剂6890型气相色谱仪,配有氢火焰离子化检测器(美国Agilent公司);LD-2A型低速离心机(北京医用离心机厂);VORTEX-5型涡旋混合仪(海门市其林贝尔仪器制造有限公司);KQ3200E型超声波清洗器(昆山市超声仪器有限公司);Heal Force SMART-N高纯水机(上海力康仪器有限公司);有机微孔滤膜(0.22 μm);甲醇(色谱纯,美国Fisher公司);二甘醇标准品(纯度 ≥ 99 %,J&K百灵威);丙酮、乙酸乙酯,氯仿均为国产分析纯。
1.2 标准储备液及工作液制备 1.2.1 标准储备液准确称取二甘醇标准品1 g(称准至0.1 mg)于100 mL容量瓶中,用甲醇稀释至刻度,配制成10 mg/mL的标准储备液,储存于4 ℃冰箱中。
1.2.2 标准工作溶液工作溶液1:将标准储备液用甲醇稀释成50、100、200、500、800、1 000 μg/mL的标准溶液,置于4 ℃冰箱中备用。工作溶液2:将标准储备液用甲醇稀释成1、5、10、20、50、80、100 μg/mL的标准溶液,置于4 ℃冰箱中备用。
1.3 样品处理 1.3.1 化妆水准确称取1 g不含二甘醇的水状空白样品,用甲醇定容于10 mL的容量瓶中,超声提取5 min,经0.22 μm有机微孔滤膜过滤后直接测定。
1.3.2 乳、凝胶、霜准确称取1 g不含二甘醇的乳状空白样品,加入10 mL甲醇,超声提取20 min后,低温高速(4 ℃,12 000 r/min)离心15 min,取上清液经0.22 μm有机微孔滤膜过滤后测定。
1.3.3 膏准确称取1 g不含二甘醇的膏状空白样品,加入1 g无水硫酸钠进行研磨后,加入10 mL甲醇,超声提取30 min后,低温高速(4 ℃,12 000 r/min)离心15 min,取上清液经0.22 μm有机微孔滤膜过滤后直接测定。
1.4 气相色谱条件色谱柱:Agilent DB-WAX(30 m × 0.32 mm × 0.25 um);柱温程序:起始温度为80 ℃,维持3 min,以10 ℃/min的速率升温至150 ℃,再以5 ℃/min的速率升温至200 ℃,维持10 min;进样口温度:230 ℃;检测器温度:250 ℃;载气:氮气流速:2.0 mL/min;氢气流量:40 mL/min;空气流量:400 mL/min;尾吹气氮气流量:30 mL/min;进样方式:分流进样,分流比:10:1;流速:1 mL/min;进样量:1.0 μL。
1.5 统计分析采用Origin 8进行线性拟合,以色谱峰面积(A)对标准工作溶液浓度(C)进行回归分析,计算线性回归方程,并以信噪比(S/N)为3计算方法的最低检出限(limit of determination,LOD),信噪比(S/N)为10计算方法的最低定量限(limit of quantitation,LOQ)。采用Excel2003进行样品浓度的相对标准偏差(relative standard deviation,RSD)计算。RSD = (标准偏差/平均值) × 100 %。
2 结 果 2.1 色谱条件优化(图1)二甘醇有很强的极性,故本研究选择填料为聚乙二醇的DB-WAX色谱柱,该色谱柱为强极性色谱柱,可获得很好的二甘醇峰形。化妆品基质复杂,要想将目标峰与杂质峰有效的分离,程序升温条件至关重要,特别是在乳液中,目标峰周围干扰物多,若程序升温初始温度偏高,升温速率过快,分离效果不佳,通过反复试验,最终确定色谱最优条件如1.4,在该条件下获得的标准品和加标样品色谱图如图1所示。

|
注:1 化妆水;2 乳、霜、凝胶;3 膏;4 二甘醇标准品。 图 1 二甘醇标准品和不同基质加标色谱图 |
2.2 提取溶液的确定(图2)
二甘醇为极性较强的化合物,根据其溶解性质,选择甲醇,乙酸乙酯、丙酮和氯仿4种溶剂研究其提取效率。分别向不含二甘醇的样品中加入等量已知的二甘醇标准品(5 mg),涡旋混合均匀,按1.3中相关步骤处理和测定不同基质的样品。经测定,4种提取液的提取效率如图2所示,其中,水、乳中甲醇的提取效率最高,膏体中乙酸乙酯提取效率略高于甲醇,但考虑到膏体中大量的酯类化合物也被提取影响二甘醇的定量,故3种基质均选择甲醇作为提取液,可获得很好的样品提取率。

|
注:1 膏;2 化妆水;3 乳、霜、凝胶。 图 2 不同提取剂对不同基质的提取效率 |
2.3 超声时间的确定(图3)
样品用甲醇提取,不同基质按3中的处理方法,分别超声0,5,10,15,20,30 min,测定结果如图3所示。通过比较,化妆水的最佳提取时间为5 min,乳液、凝胶、霜为20 min,膏为30 min。
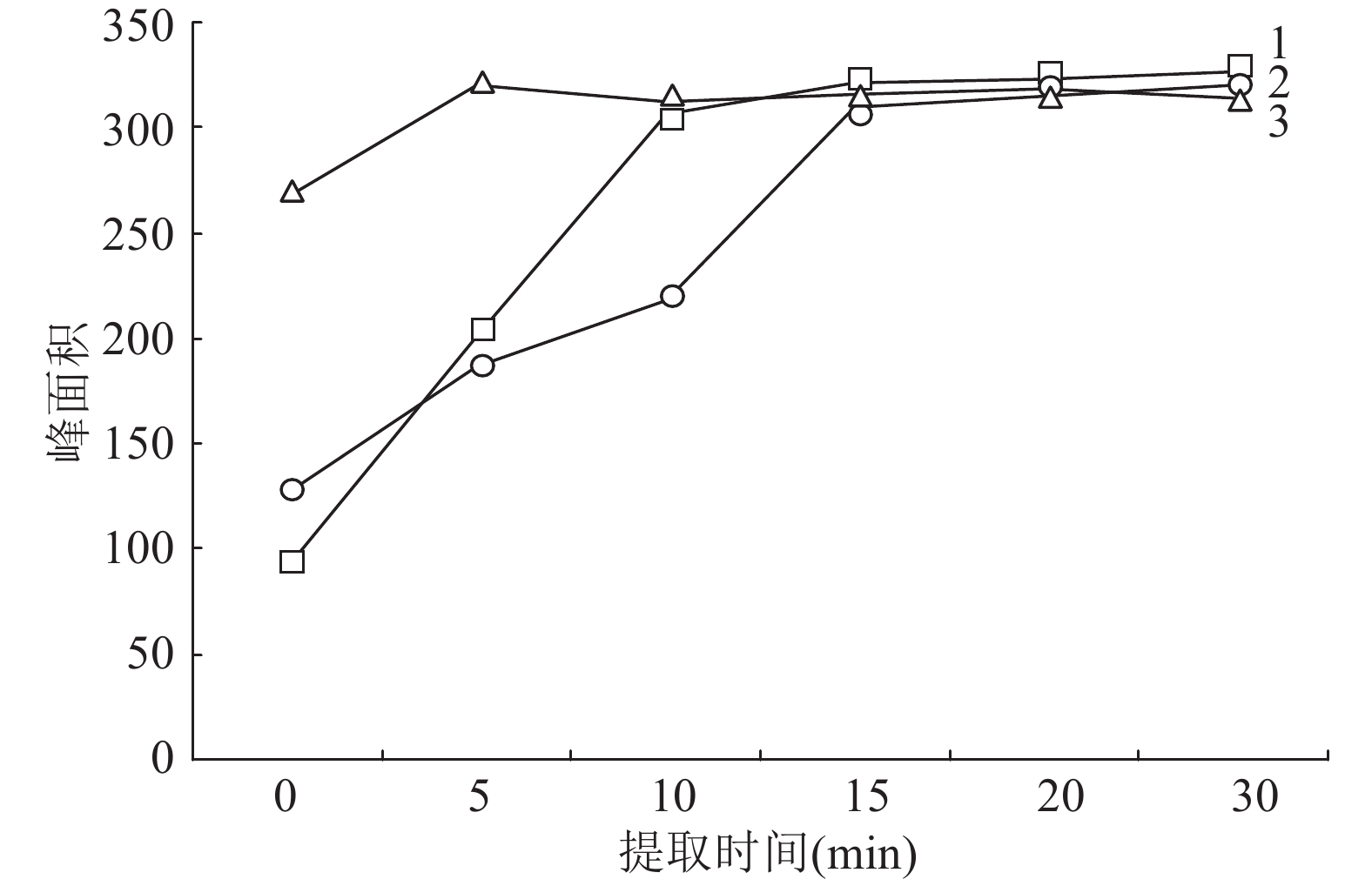
|
注:1 乳、霜、凝胶;2 膏;3 化妆水; 图 3 不同超声时间对不同基质的提取效率 |
2.4 标准曲线及检出限(表1)
取1.22的二甘醇标准工作溶液,按1.4确定的色谱条件进行分析。以标准工作溶液浓度(C)为横坐标,对应的色谱峰面积(A)为纵坐标,绘制线性关系曲线,并拟合线性回归方程如表1。本方法的线性范围很宽,在1~1 000 μg/mL的线性范围内,虽然线性关系很好,但导致低浓度的二甘醇定量准确度低,为了更好的定量分析低浓度的二甘醇,实验对浓度为1~100 μg/mL的二甘醇也进行了标准曲线的绘制。
| 表 1 二甘醇的线性方程及灵敏度 |
2.5 方法的回收率与精密度(表2)
于不含二甘醇的空白样品中分别按照10、100、800 μg/mL3个浓度梯度进行加标回收实验,每个浓度水平分析6次,连续测定5天,回收率及精密度见表2。
| 表 2 样品加标回收率和精密度 |
3 讨 论
二甘醇中毒不像乙二醇(或甲醇)中毒一样产生严重的代谢性酸中毒症状,其中毒表现为一种轻微的酸毒症和肾毒性迹象,因此容易在患者的鉴别诊断中被忽略[1]。人类历史上发生的二甘醇中毒事件也不胜枚数,从1937年美国发生的磺胺药事件再到2007年中国的“毒牙膏”事件,已造成超过600人死亡[5]。目前,对二甘醇毒性的研究主要集中在牙膏和药物中,而忽略了化妆品中二甘醇的危害。化妆品的原材料甘油、丙二醇、乙二醇、丙二醇乙氧基二甘醇、丁氧基双甘醇、聚乙二醇类及其衍生物、聚醚类及其衍生物、聚山梨醇酯类及其衍生物、聚酯–1、聚酯–5、二甘醇酯类、共聚物或交联聚合物等均作为可能带入二甘醇的风险物质。水乳类化妆品中的二甘醇可通过皮肤吸收,而唇膏类化妆品,更可直接经口吸收进入人体。
目前已报道的二甘醇的检测方法有气相色谱法[1, 6 – 8]、气质联用法[9]、高效液相色谱法[10 – 11]、红外光谱法[12],由于二甘醇易于气化且具有好的热稳定性,故最常用的检测方法为气相色谱法和气质联用法,而质谱检测仪器贵,检测成本高[13],使得气相色谱法成为检测二甘醇的主要分析方法。与文献报道的二甘醇的硅烷化[14]或酸酐[15]衍生方法相比,本方法简单快捷,适用价值高。
本实验对不同基质的化妆品进行了分类,按照稀稠度从稀到稠分为水、乳(霜、凝胶)和膏。稀稠度不同,具体的前处理方法不同,结果如上所述差异明显。其中,乳、霜和凝胶,虽然其组成成分有所差异,但因其稀稠度相似,前处理方法和实验结果一致,故可统分为一类。对于膏体类化妆品,市面上常见的是唇膏和口红,两者在颜色上有所区别,实验中对口红中提取色素是否对实验有所干扰进行了分析,发现分别用4种提取剂提取的颜色有所不同,甲醇提取液为红色,乙酸乙酯和丙醇提取液为淡黄色,氯仿提取液为橘色,但颜色对提取效率和二甘醇定量结果没有影响,故膏体颜色对实验没有干扰,不必另行分类讨论。在进行样品前处理时,发现对于乳膏类的样品,在低温时,提取液中有絮状沉淀生成,推测其部分基质成分在低温时溶解度低,进一步实验验证低温对二甘醇提取量没有影响。为了尽量少的提取基质,减少对二甘醇定量的干扰和保护色谱柱,离心时可选择低温离心,故本实验选择离心温度为4 ℃。
本实验就化妆品的不同基质进行研究,建立了不同基质的样品前处理方法,方法操作简单可行,弥补了《化妆品技术规范》的局限性,实用价值高,适用范围广,为化妆品中二甘醇的风险评估提供技术支持。
| [1] | Williams RH, Shah SM, Maggiore JA, et al. Simultaneous detection and quantitation of diethylene glycol, ethylene glycol, and the toxic alcohols in serum using capillary column gas chromatography[J]. Journal of Analytical Toxicology, 2000, 24(7): 621–626. DOI:10.1093/jat/24.7.621 |
| [2] | 王冉, 方舒正, 汪俊涵, 等. 化妆品中二甘醇的风险评估[J]. 中国工业医学杂志, 2011, 24(4): 279–281. |
| [3] | Maurer HH, Peters FT, Paul LD, et al. Validated gas chromatographic-mass spectrometric assay for determination of the antifreezes ethylene glycol and diethylene glycol in human plasma after microwave-assisted pivalylation[J]. Journal of Chroma-tography B: Biomedical Sciences and Applications, 2001, 754(2): 401–409. DOI:10.1016/S0378-4347(01)00022-6 |
| [4] | 余雯静, 郑晨, 赵玉兰, 等. 气相色谱/质谱联用检测唇用产品中二甘醇的残留[J]. 香料香精化妆品, 2011, 2: 35–37. |
| [5] | 余雯静, 郑晨, 赵玉兰. 气质联用法检测日用化学品中二甘醇[J]. 环境科技, 2010, 23(2): 71–73. DOI:10.3969/j.issn.1674-4829.2010.02.021 |
| [6] | Self RL. Direct analysis in real time-mass spectrometry (DART-MS) for rapid qualitative screening of toxic glycols in glycerin-containing products[J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 80: 155–158. DOI:10.1016/j.jpba.2013.02.037 |
| [7] | Rahim AA, Saad B, Osman H, et al. Simultaneous determination of diethylene glycol, diethylene glycol monoethyl ether, coumarin and caffeine in food items by gas chromatography[J]. Food Chemistry, 2011, 126(3): 1412–1416. DOI:10.1016/j.foodchem.2010.11.121 |
| [8] | Bahaa NEA, Dhifaf MSA. Detection of diethylene glycol in toothpaste[J]. Al-Mustansiriyah Journal for Pharmaceutical Sciences, 2011, 9(1): 43–51. |
| [9] | Barry S, Wolff JC. Investigation into the quantitative analysis of diethylene glycol in toothpaste by direct analysis in real time mass spectrometry[J]. Rapid Communications in Mass Spectrometry: RCM, 2016, 30(15): 1829–1834. DOI:10.1002/rcm.7659 |
| [10] | Wu JG, Yuan JB, Liu Q, et al. New derivatizing reagent for analysis of diethylene glycol by HPLC with fluorescence detection[J]. Journal of Separation Science, 2008, 31(22): 3857–3863. DOI:10.1002/jssc.v31:22 |
| [11] | Hernández F, Ibáñez M, Sancho JV. Fast determination of toxic diethylene glycol in toothpaste by ultra-performance liquid chromatography-time of flight mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2008, 391(3): 1021–1027. DOI:10.1007/s00216-008-2082-0 |
| [12] | Baffi P, Elneser S, Baffi M, et al. Quantitative determination of diethylene glycol contamination in pharmaceutical products[J]. Journal of AOAC International, 2000, 83(4): 793–801. |
| [13] | 范茂林, 杨旭东, 艾雨, 等. 尿液中尼古丁和可替宁QuEChERS预处理气相色谱测定法建立[J]. 中国公共卫生, 2017, 2: 333–337. DOI:10.11847/zgggws2017-33-02-43 |
| [14] | Zhu K, Gu B, Kerry M, et al. Elimination of N, O-bis (trimethylsilyl) trifluoroacetamide interference by base treatment in derivatization gas chromatography mass spectrometry determinationof parts per billion of alcohols in a food additive[J]. Journal of Chromatography A, 2017, 1490: 74–79. DOI:10.1016/j.chroma.2017.02.025 |
| [15] | Wurita A, Suzuki O, Hasegawa K, et al. Sensitive determination of ethylene glycol, propylene glycol and diethylene glycol in human whole blood by isotope dilution gas chromatography-mass spectrometry, and the presence of appreciable amounts of the glycols in blood of healthy subjects[J]. Forensic Toxicology, 2013, 31(2): 272–280. DOI:10.1007/s11419-013-0188-3 |
 2018, Vol. 34
2018, Vol. 34


