2. 北京出入境检验检疫局
汉坦病毒(Hantaan virus,HV)属于布尼亚病毒科汉坦病毒属,是有包膜、分节段的单股负链RNA病毒[1]。其自然宿主以小型啮齿动物为主,并经由啮齿类动物传染给人类,在临床上可引起人的肾综合征出血热[2]。每年亚洲和欧洲有近6~10万例汉坦病毒感染记录,其中大多来自中国。目前,关于汉坦病毒的检测方法主要有血清学检测方法和核酸检测方法[3]。环介导等温扩增(loop mediated isothermal amplification,LAMP)方法是一种新的核酸扩增方法,具有高灵敏度、高特异性、操作简便及反应快速的特点[4]。本研究针对汉坦病毒汉滩型S片段基因,建立LAMP检测方法,为汉坦病毒的流行病学调查及诊断提供新的方法。
1 材料与方法 1.1 材料汉坦病毒HTN型76–118株及SEO型80–39株为本实验室保存。汉坦病毒阳性血液组织5份采集自汉坦病毒阳性携带者,本实验室保存。乙肝病毒(hepatitis B virus,HBV)、丙肝病毒(hepatitis C virus,HCV)和(经ELISA法鉴定)艾滋病病毒(human immunodeficiency virus,HIV)标准品由中国人民解放军军事医学科学院提供。
1.2 主要仪器及试剂荧光等温扩增仪GENE II型(英国OptiGene公司),超微量分光光度计NanoDrop2000型(美国Thermo公司),Isothermal mix(2 ×)(英国OptiGene公司),EasyPure Blood RNA Kit试剂盒(北京全式金生物技术有限公司),pUC57-T载体(上海生工生物工程有限公司),EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒(北京全式金生物技术有限公司)。
1.3 方法 1.3.1 标准质粒构建根据GeneBank中汉坦病毒HTN型76–118株S片段全序列(Accession:KT885049.1)和SEO型80–39株S片段全序列(Accession:NC_005236.1)体外合成2个大小分别为1 696 bp和1 769 bp的基因片段。合成的2个基因片段分别连接到克隆载体pUC57载体上(上海生工生物工程有限公司合成),构建标准质粒pHTN-S和pSEO-S。
1.3.2 LAMP引物设计与合成针对汉坦病毒HTN型76–118株S片段全序列和SEO型80–39株S片段全序列,使用在线网站(http://primerexplorer.jp/e/)进行LAMP引物设计,序列如表1:
| 表 1 LAMP扩增引物 |
1.3.3 LAMP扩增体系
分别以合成的标准质粒pHTN-S和pSEO-S为模板,以设计合成的LAMP扩增引物进行LAMP扩增反应,建立总体积为25 μL的反应体系:Isothermal mix(2 ×)12.5 μL、F3(10 μmol)1 μL、B3(10 μmol)1 μL、FIP(40 μmol)1 μL、BIP(40 μmol)1 μL、标准质粒/cDNA 1 μL、去离子水7.5 μL。将反应溶液混匀,放入荧光等温扩增仪,设置反应温度63 ℃,反应时间50 min。
1.3.4 LAMP反应灵敏度检测将合成的标准质粒采用NanoDrop2000超微量分光光度计进行定量,定量后使用去离子水分别对标准质粒进行连续10倍梯度稀释,以1.3.3中建立的LAMP体系检测不同稀释度下的质粒,确定引物对不同标准质粒的检测限。
1.3.5 LAMP反应特异性检测分别以合成的2种标准质粒、HBV、HCV和HIV为模板,以1.3.3中建立的反应体系进行LAMP扩增,确定该反应体系的特异性。
1.3.6 血液样品中汉坦病毒检测血液组织RNA提取 方法参照EasyPure Blood RNA Kit试剂使用说明。取400 μL新鲜抗凝血液,加入1 mL细胞裂解液RCL2溶液,混匀后冰育10 min。4 ℃下5 000 × g离心10 min,弃上清。加入400 μL结合缓冲液BB7溶液,漩涡振荡后加入200 μL无水乙醇,采用离心株吸附总RNA,4 ℃下10 000 × g离心1 min。加入500 μL洗脱液WB7,4 ℃下10 000 × g离心1 min。向吸附柱中加入100 μL无RNA酶去离子水,室温静置1 min,室温下10 000 × g离心1 min,洗脱RNA,采用NanoDrop2000超微量分光光度计进行定量,– 80 ℃保存RNA。反转录合成cDNA方法参照试剂盒使用说明。建立如下反应体系:RNA 3 μg、Olig(dT)18 1 μL、2 × ES Reaction Mix 10 μL、EasyScript RT/RI Enzyme Mix 1 μL、gDNA Remover 1 μL、无RNA酶去离子水至20 μL。混匀反应体系,42 ℃孵育30 min。85 ℃加热5 s失活酶之后– 30 ℃保存样品。以反转录合成的cDNA为模板,采用方法1.3.3中的引物与体系进行样本LAMP检测。
2 结 果 2.1 标准质粒的LAMP扩增(图1)以合成的标准质粒为模板,进行LAMP扩增,标准质粒pHTN-S能够发生LAMP扩增,而以pSEO-S为模板,则不能发生LAMP扩增,证明该套引物只能检测汉坦病毒汉滩型S片段,而不能扩增汉坦病毒汉城型S片段,能够区分汉坦病毒汉滩型和汉城型,具有良好的特异性。
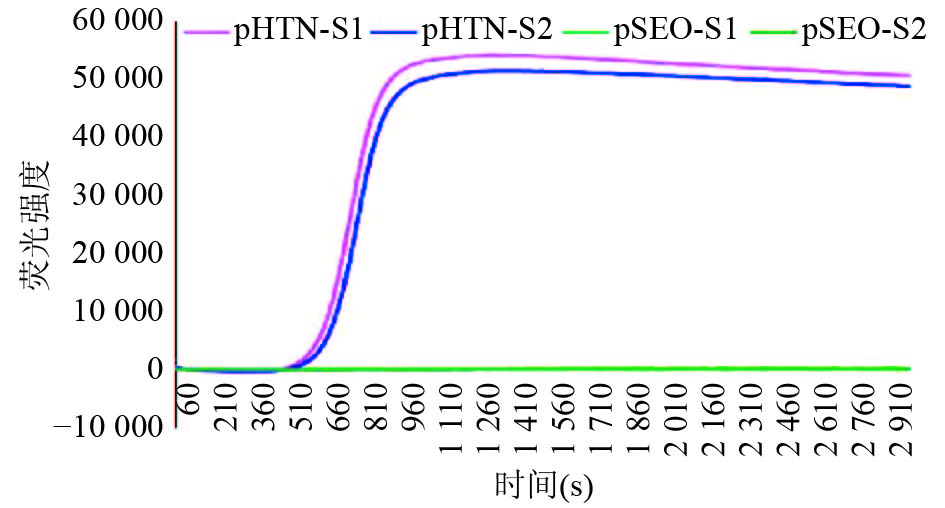
|
图 1 汉坦病毒S片段标准质粒LAMP扩增 |
2.2 标准质粒LAMP法检测限(图2)
将标准质粒pHTN-S进行10倍梯度稀释,分别104 copy/μL稀释到100 copy/μL,以方法1.3.3中的引物与体系进行LAMP检测。当模板质粒稀释到101 copy/μL时依然能够发生LAMP扩增,而当稀释到100 copy/μL时则不能发生LAMP扩增。表明该套引物对标准质粒pHTN-S的检测限为101 copy/反应,此时,LAMP反应中标准质粒pHTN-S的量为10 copy/反应。

|
图 2 标准质粒的LAMP检测限 |
2.3 LAMP反应特异性检测(图3)
分别以pHTN-S、pSEO-S、HBV、HCV和HIV为模板,以建立的LAMP体系方法进行LAMP扩增。只有以标准质粒pHTN-S为模板时能够发生LAMP扩增,而其他4种病毒模板均不能发生LAMP扩增。表明,该套体系和方法对汉坦病毒汉滩型具有良好的特异性。
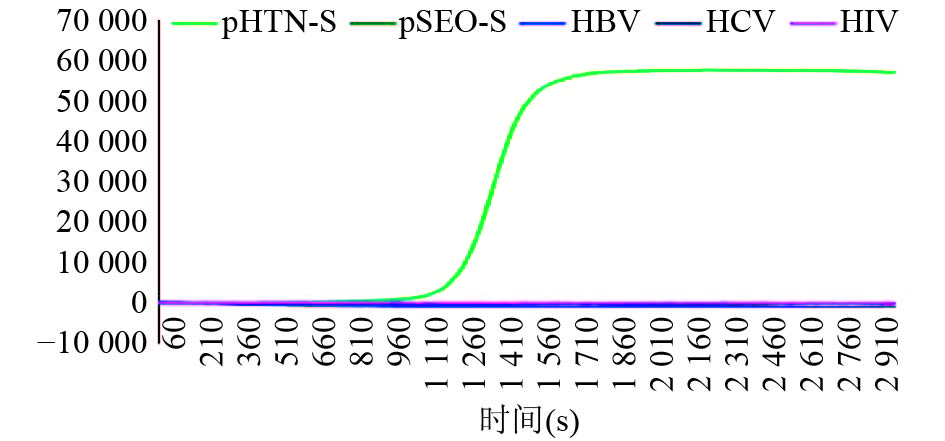
|
图 3 LAMP反应特异性检测 |
2.4 血液样品LAMP检测(图4)
以经过ELISA检测汉坦病毒阳性的血液样本提取并合成的cDNA和标准质粒pHTN-S为模板,以建立的LAMP扩增体系进行检测。提取合成的5个血液样品cDNA均能够发生LAMP扩增,证明该方法体系能够用于血液样品中汉坦病毒感染的检测。

|
图 4 血液样品中汉坦病毒的LAMP检测 |
3 讨 论
在临床中,针对汉坦病毒的检测方法主要采用血清学方法,包括酶联免疫测定法(ELISA)和免疫荧光法(immunofluorescence assay,IFA)。在分子生物学检测方法中,最常用的是荧光定量PCR法(real-time PCR)。而经典的病毒滴定法由于其耗时较长(5~7 d)在临床中则很少使用。基于SYBR-Green I的反转录real-time PCR法(real time quantitative PCR,RT-qPCR)被认为是目前操作简单,灵敏度最高的一种基因检测方法,但是该方法必须依赖于荧光定量PCR仪[3, 5 – 6]。LAMP法是近年来开发出的一种新型基因检测方法,该方法针对扩增的目的基因,设计4条特异性引物进行等温扩增[7]。LAMP法具有与real-time PCR法相近的检测灵敏度,并且操作方法简单,只需恒温水浴即可进行,不依赖于昂贵的实验仪器。并且该检测方法特异性较高,检测时间只需30~60 min,扩增结束后结果可以采用多种方法进行鉴定,与real-time PCR法相比具有显著的优点。目前,LAMP法已经广泛应用于各类生物学样品中特定基因的检测,尤其是针对病毒基因的检测。
在本研究中,针对汉坦病毒汉滩型S片段的保守区,设计4条特异性引物,建立一种针对汉滩型汉坦病毒的LAMP检测方法。本方法首先构建标准质粒,利用设计合成的4条特异性引物建立LAMP扩增体系。在对标准质粒的检测中,该方法能够检测汉坦病毒汉滩型S片段标准质粒,而对汉坦病毒汉城型S片段标准质粒则没有扩增,表明该方法中采用的引物对汉坦病毒汉滩型具有特异性,可以区分汉坦病毒的2种基因类型。进一步的检测限分析表明,建立的LAMP法对汉坦病毒汉滩型的检测限为10 copy/反应,具有与real-time PCR法相近的灵敏性[8 – 9]。特异性分析表明,建立的LAMP体系方法只能扩增汉坦病毒汉滩型标准质粒,而对汉坦病毒汉城型标准质粒、HBV、HCV和HIV病毒等均无特异性扩增,表明该方法具有良好的特异性。并且,采用该方法可以检测到血液样品中的汉坦病毒感染,证明建立的LAMP扩增方法可以用于检测生物学样本中的汉滩型汉坦病毒。为进一步将LAMP法应用于汉坦病毒基因检测奠定了研究基础。
| [1] | Hujakka H, Koistinen VI, Eerikainen P, et al. Diagnostic rapid tests for acute hantavirus infections: specific tests for Hantaan, Dobrava and Puumala viruses versus a hantavirus combination test[J]. J Virol Methods, 2003, 108(1): 117–122. DOI:10.1016/S0166-0934(02)00282-3 |
| [2] | Muyangwa M, Martynova EV, Khaiboullina SF, et al. Hantaviral proteins: structure, functions, and role in Hantavirus infection[J]. Front Microbiol, 2015, 27(6): 1326. |
| [3] | Nam JH, Yu CH, Hwang KA, et al. Real-time RT-PCR of Hantaan virus RNA used for the detection of virus response to antiviral drugs[J]. Acta Virol, 2008, 52(1): 67–70. |
| [4] | Parida M, Sannarangaiah S, Dash PK, et al. Loop mediated isothermal amplification (LAMP): a new generation of innovative gene amplification technique; perspectives in clinical diagnosis of infectious diseases[J]. Rev Med Virol, 2008, 18(6): 407–421. DOI:10.1002/rmv.v18:6 |
| [5] | Jiang W, Wang PZ, Yu HT, et al. Development of a SYBR Green I based one-step real-time PCR assay for the detection of Hantaan virus[J]. J Virol Methods, 2014, 196: 145–151. DOI:10.1016/j.jviromet.2013.11.004 |
| [6] | Chen L, Wei H, Guo Y, et al. Gold nanoparticle enhanced immuno-PCR for ultrasensitive detection of Hantaan virus nucleocapsid protein[J]. J Immunol Methods, 2009, 46(1-2): 64–70. |
| [7] | Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12): E63. DOI:10.1093/nar/28.12.e63 |
| [8] | Jiang W, Yu HT, Zhao K, et al. Quantification of Hantaan virus with a SYBR green I-based one-step qRT-PCR assay[J]. PLoS One, 2013, 8(11): e81525. DOI:10.1371/journal.pone.0081525 |
| [9] | Liu Z, Wang F, Yuan L, et al. Development of a SYBR-Green I quantitative PCR assay for the detection and genotyping of different hantaviruses[J]. Int J Mol Med, 2016, 38(3): 951–960. DOI:10.3892/ijmm.2016.2678 |
 2018, Vol. 34
2018, Vol. 34


