胃癌死亡率在所有恶性肿瘤中高居第二位[1]。对于少数可以接受手术治疗的患者,大部分也会发展为晚期胃癌。磷酯酰肌醇3–激酶(phosphalyl inositol3-kinase, PI3K)/蛋白激酶B(protein kinase B, AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)和丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)/细胞外信号调节激酶 (extracellular signal-regulated kinase, ERK)信号通路在肿瘤发生发展中起重要作用,其异常激活通常是肿瘤发生、发展、侵袭、转移及耐药的主要原因[2]。PI3K/Akt/mTOR和MAPK/ERK信号通路之间的相互关系十分复杂,目前仍有部分机制尚不能明确阐明[3 – 4]。在生理和病理条件下,这2条通路的激酶之间存在明显的“串话”现象[5],即:2条信号通路之间既可能相互激活,也可以相互抑制。一个级联的抑制激活另一种,反之亦然,从而确保细胞存活的信号以高保真度向下游传播[6 – 8]。PI3K/Akt/mTOR和MAPK/ERK信号通路间存在多个作用[9 – 11]。前期实验结果表明:PI3K/Akt/mTOR信号通路抑制剂雷帕霉素(rapamycin)与MAPK/ERK信号通路抑制剂PD98059均能对肿瘤细胞产生不同程度的抑制作用[12]。但目前国内外关于联合使用rapamycin和PD98059阻断PI3K/AKT/mTOR和MAPK/ERK信号转导通路对胃癌细胞生长影响的报道较少。本实验基于前期课题研究结果,设计单独作用及联合作用分组,分别对不同药物影响下胃癌SGC-7901细胞的转录水平、翻译水平、周期分布、凋亡变化等进行检测分析。
1 材料与方法 1.1 主要试剂与仪器人低分化胃癌细胞株SGC-7901(南京凯基生物公司),rapamycin、PD98059(美国Selleck公司),1640培养基、胎牛血清、胰蛋白酶(美国HyClone公司),Trizol(日本Takara公司),CCK8 (cholecystokinin-8)试剂盒(上海翊圣生物公司),细胞凋亡(annexin V-fluorescein isothiocyanate/propidium iodide FITC/PI)检测试剂盒、细胞周期检测试剂盒(美国BD公司),AKT、p-AKT、mTOR、p-mTOR、p44/42MAPK(ERK1/2)、p-p44/42MAPK(ERK1/2)、甲基乙基酮(methyl ethyl ketone, MEK1/2) 、磷酸化甲基乙基酮(phospho-methyl ethyl ketone, p-MEK1/2)、肌动蛋白(actin)、辣根过氧化物酶(horseradish peroxidase, HRP)标记山羊抗兔二抗、HRP标记山羊抗鼠二抗(美国CST公司),QuantStudio7实时荧光定量PCR仪器(美国ABI公司),sodium dodecyl sulphate-polyacrylamide gel electrophoresis (SDS-PAGE)电泳仪器及湿转仪器(美国Bio-Rad公司)等。
1.2 方法 1.2.1 培养SGC-7901细胞用含10 %胎牛血清的1640培养基进行培养,将细胞培养于37 ℃,5 % CO2条件的培养箱中,待生长融合度达80 %后,按1 : 2进行传代。取对数生长期的细胞进行后续实验。
1.2.2 CCK8检测细胞增殖情况取对数生长期胃癌细胞接种于96孔板,设置rapamycin组(12.5、25、50、100、150、200 nmol/L)、PD98056组(25、50、100、200、300、400 μmol/L)和联合组(取rapamycin、PD98056各组浓度分别对应混合,保证各浓度梯度体积相等)3组,同时设对照组(只加细胞和培养基,不加药物)和空白组(只加培养基不加细胞),每组设置6个复孔,分别加药。37 ℃、5 % CO2培养24 h后终止培养,各孔加入10 μL CCK8,37 ℃、5 % CO2培养2 h,酶标仪(波长490 nm)测定每孔A值,计算细胞增殖率。细胞增殖率( %) = [实验组A值 – 空白组 A值]/[对照组A值 – 空白组 A值] × 100 %。
1.2.3 分组处理根据CCK8结果确定单用及联合用药的浓度,分为对照组、rapamycin组(25 nmol/L)、PD98059组(50 μmol/L)及联合组(25 nmol/L rapamycin + 50 μmol/L PD98059)。饥饿处理后加药。
1.2.4 实时荧光定量PCR实验组和对照组加药处理24h后提取细胞总RNA,按照Takara试剂盒将提取的mRNA逆转录为cDNA,再以cDNA为模板进行实时荧光定量PCR。根据NCBI提供的人类基因mRNA序列,在IDT引物设计网站进行引物设计,包括人类PI3K、AKT、mTOR、P70S6K、4EBP、PTEN基因引物各两对。PI3K的上游引物:AAACAGAGCCAAAGGGAAGG,下游引物:ATACCAGCCACAAAGGCTTC;AKT的上游引物:ATCGCTTCTTTGCCGGTAT,下游引物:TCTTGGTCAGGTGGTGTGAT;m-TOR的上游引物:GCGACACCGAATCAATCAT,下游引物:TTTCTTCATGGGTCCTGTTT;MEK的上游引物:ACCAGGCAGAAATCAACGAC,下游引物:GATGAACGTCCCAAAGCACT;ERK的上游引物:TTACTGCGCTTCAGACATGAGA,下游引物:ATCTGTTTCCATGAGGTCCTGT;β-ACTIN的上游引物:TCACCCACACTGTGCCCATCTACGA,下游引物:CAGCGGAACCGCTCATTGCCAATGG。建立20.0 μL反应体系:2 × RealStar green fast mixture with ROX 10 μL、cDNA 0.4 μL、基因正反引物各0.4 μL、RNase-free H2O 8.8 μL。95 ℃,20s预变性,40个循环(95 ℃ 3s,60 ℃ 30s),4 ℃扩增。根据2–ΔΔCt方法分析各基因的相对表达量,即 ΔCt = Ct目的基因 – Ct Actin;ΔΔCt = ΔCt实验组 – ΔCt 对照组。
1.2.5 蛋白印迹法(Western blot,WB)检测相关分子的表达情况实验组和对照组加药处理后24 h收集细胞,提取总蛋白。配制10 % SDS-PAGE胶,蛋白样品变性,电泳、转膜, 5 %牛奶封闭2 h,一抗孵育 过夜。室温复温,TBST (Tris-buffered saline containing 0.1 % Tween-20)洗涤3遍,二抗室温孵育1 h 。TBST洗涤3遍,ECL (electroluminescence)显色,全自动图像分析仪捕捉并保存。
1.2.6 流式细胞术检测SGC-7901细胞周期取对数生长期细胞按1 × 105个/孔接种于6孔板。根据细胞周期检测试剂盒进行检测:实验组和对照组细胞加药培养24 h后离心收集细胞。2 000 r/min离心5 min,弃上清,加入70 %冷乙醇500 μL固定,4 ℃过夜。离心弃上清,PBS洗去固定液后,加入100 μL RNAse溶液吹打混匀,37 ℃水浴30 min,加入400 μL PI染色,混匀,避光反应30 min,200目筛网过滤,流式细胞仪检测。
1.2.7 流式细胞术检测SGC-7901细胞凋亡取对数生长期胃癌细胞接种于6孔板,实验组和对照组细胞加药24h后终止培养,收集细胞,按FITC细胞凋亡检测试剂盒说明,用FITC和PI (propidium iodide)染色,分别加入标记物,利用流式细胞仪检测细胞凋亡情况。
1.3 统计分析所有数据均采用SPSS 17.0和Excel 2007进行数据统计分析,检验水准为α = 0.05。
2 结 果 2.1 Rapamycin、PD98056单独及联合作用对SGC-7901细胞增殖活性的影响(图1)CCK8法检测各组细胞增殖情况,结果显示,不同浓度rapamycin组、PD98056组及联合作用组对SGC-7901细胞均有抑制作用,且随着各组浓度的增加,SGC-7901细胞增殖能力逐渐下降,且联合组对SGC-7901细胞增殖的抑制作用明显比单独作用组强(P < 0.05)。

|
注:与单独作用组相比,a P < 0.05。 图 1 单独及联合作用对SGC-7901细胞增殖活性的影响 |
2.2 信号通路关键基因的mRNA表达情况(表1、图2)
实时荧光定量PCR检测单独及联合作用SGC-7901细胞24 h后通路关键基因mRNA的表达水平。结果显示,rapamycin组和PD98059组的AKT、mTOR、MEK、ERK基因的mRNA表达量均低于对照组,差异具统计学意义(P < 0.05),联合组的AKT、mTOR、MEK、ERK基因的mRNA表达量均低于各单独用药组,差异具统计学意义( P < 0.05)。
| 表 1 单独及联合作用对胃癌SGC-7901细胞的mRNA表达影响 |

|
注:与对照组相比,a P < 0.05;与单独作用组相比,b P < 0.01。 图 2 单独及联合作用对胃癌SGC-7901细胞的mRNA表达影响 |
2.3 信号通路关键基因的蛋白表达情况(图3)
WB检测单独及联合作用SGC-7901细胞24 h后通路关键基因蛋白的表达水平。结果显示,各组总AKT、mTOR、MEK1/2、ERK1/2蛋白表达量与对照组相比无明显差异(P > 0.05)。Rapamycin组和PD98059组磷酸化蛋白p-AKT、p-mTOR、p-MEK1/2、p-ERK1/2表达量均低于对照组,差异具统计学意义( P < 0.05)。联合组磷酸化蛋白p-AKT、p-mTOR、p-MEK1/2、p-ERK1/2表达量均低于rapamycin组和PD98059组,差异具统计学意义( P < 0.05)。

|
注:A:对照组;B:Rapamycin组;C:PD98059组;D:联合组。 图 3 单独及联合作用对胃癌SGC-7901细胞的蛋白表达影响 |
2.4 Rapamycin、PD98056单独及联合作用对SGC-7901细胞周期分布的影响(表2、图4)
流式细胞术检测各组细胞周期分布结果显示,rapamycin组、PD98059组G0/G1期分别占78.77 %、78.40 %,高于对照组72.22 %,差异具统计学意义(P < 0.01);联合组G0/G1期细胞比例为82.86 %,高于rapamycin组和PD98059组( P < 0.01)。Rapamycin组和PD98059组S期细胞比例分别为13.78 %、13.12 %,均低于对照组18.99 %( P < 0.01);联合组S期细胞比例为8.87 %,低于rapamycin组和PD98059组( P < 0.01)。Rapamycin组G2/M期占7.44 %,低于对照组8.79 %( P < 0.01),而PD98059组G2/M期细胞比例与对照组相比无显著差异( P > 0.05),联合组G2/M期占8.26 %,低于对照组的8.79 %( P < 0.05)。表明联合组比单独作用组对SGC-7901细胞周期分布的影响更明显。
| 表 2 单独及联合作用对SGC-7901细胞周期分布的影响(%) |
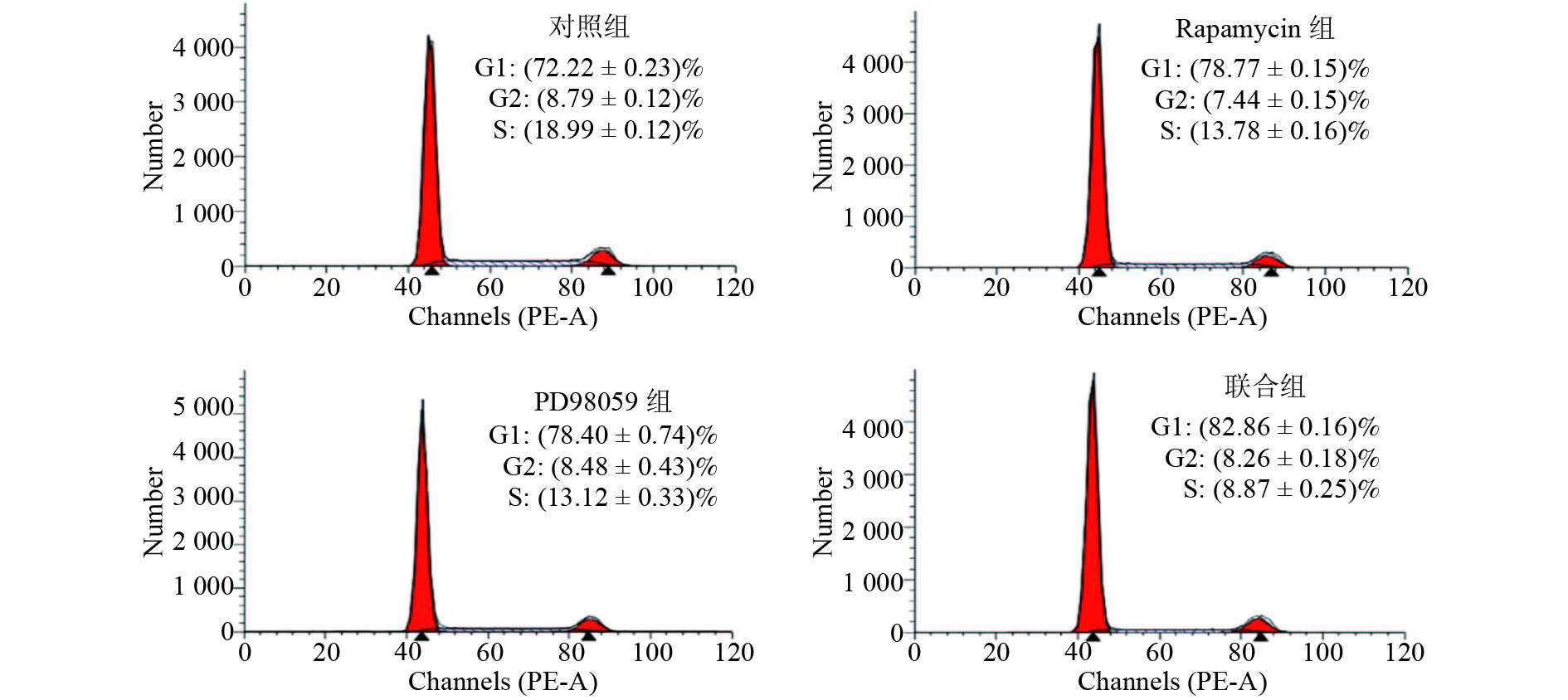
|
图 4 单独及联合作用对SGC-7901细胞周期分布的影响 |
2.5 Rapamycin、PD98056单独及联合作用后SGC-7901细胞凋亡率的变化(表3、图5)
流式细胞术检测各组细胞凋亡率变化,rapamycin组和PD98059组凋亡率分别为(19.23 ± 1.85) %、(23.07 ± 2.57) %,均高于对照组(7.77 ± 2.02) %,差异具统计学意义(P < 0.01)。联合组凋亡率为(29.77 ± 7.39) %,高于rapamycin组和PD98059组( P < 0.01)。表明联合作用比单独作用更能诱导细胞凋亡。
| 表 3 单独及联合作用后SGC-7901细胞凋亡率的变化 |

|
图 5 单独及联合作用后SGC-7901细胞凋亡率的变化 |
3 讨 论
PI3K/AKT/mTOR和MAPK/ERK信号通路的调控机制非常复杂。mTOR以mTORC1复合物和mTORC2复合物两种形式存在。研究发现mTORC1通过控制mRNA翻译,调节核糖体、自噬和脂质生物合成,从而调节细胞生长[13]。当mTOR活性受到抑制后,能通过S6K-PI3K-Ras反馈调节,激活MAPK信号通路[14]。应用抑制剂使MAPK通路中的MEK活性下降后,不仅降低了其下游ERK的磷酸化水平,同时也反馈调节AKT的磷酸化水平,使其显著升高[5, 15]。前期关于rapamycin抑制PI3K/AKT/mTOR信号通路对胃癌SGC-7901细胞影响的研究发现:mTOR抑制剂rapamycin对SGC-7901胃癌细胞可产生不同程度的抑制作用[16]。过去的研究中也有关于MEK抑制剂PD98059抑制肿瘤细胞的生长的情况[12],它们均有良好的临床预期。但实际上这两种药物与许多其它靶向肿瘤治疗药物具有共性,即一段时间的治疗后患者会发生明显的耐药现象,这对患者后期生存质量有很大影响。Zhang等[17]研究rapamycin和PD98059对结直肠癌细胞系的联合效应。他们发现PD98059和Rapamycin联合可抑制结直肠癌细胞的增殖,诱导凋亡并阻止细胞周期缩短,且这两种药物联合使用对抑制mTOR和MEK信号通路的磷酸化比单独使用这两种药物治疗效果更明显。此外,几种肿瘤类型的前期临床试验研究表明,PI3K和MEK/ERK通路与许多不同的小分子激酶抑制剂的双重抑制比单一途径具有更强的抑制作用[18–19]。
Rapamycin与PD98059联合作用后发现不同浓度rapamycin、PD98056及联合作用对SGC-7901细胞均有抑制作用,且随着各组浓度的增加,SGC-7901细胞增殖能力逐渐下降。SGC-7901细胞的AKT、mTOR、MEK、ERK基因的mRNA表达量均低于各单独作用组,联合作用相比单独作用对通路中关键基因转录水平表达的抑制作用更加明显。联合组磷酸化蛋白p-AKT、p-mTOR、p-MEK1/2、p-ERK1/2表达量均低于rapamycin组和PD98059组,联合组对各关键蛋白磷酸化的抑制作用强于单独作用。联合组通过抑制AKT、mTOR、MEK1/2、ERK1/2的磷酸化,从而抑制了PI3K/AKT/mTOR和MAPK/ERK信号通路的活化。转录水平与翻译水平实验结果一致,这从分子水平上证明了rapamycin和PD98059联合作用存在协同作用。联合组对SGC-7901细胞增殖的抑制作用明显比单独作用组强。联合作用结果发现阻滞于G0/G1期的细胞比例显著增多,处于S期(DNA合成期)及G2/M期(DNA合成后期)的细胞比例减少。同样采用流式细胞术检测各组细胞凋亡率变化,联合作用在促细胞凋亡方面存在协同作用,与相关研究报道一致[17]。说明rapamycin和PD98059联合使用能更好诱导细胞凋亡,为rapamycin和PD98059的临床联合作用提供了分子学基础。
综上,本研究通过联合应用rapamycin和PD98059作用于胃癌SGC-7901细胞,观察对其分子生物学指标的影响,结果提示联合运用mTOR抑制剂rapamycin和MEK抑制剂PD98059能显著抑制细胞关键基因的转录和翻译过程,并促进细胞凋亡及细胞周期阻滞,从而抑制细胞增殖。联合运用多靶点抑制剂可能成为耐药胃癌患者治疗的新方向,本实验也为临床研究新的靶向治疗药物及寻求新的联合治疗方案提供实验依据。
| [1] | Herrero R, Jin YP, Forman D. The fight against gastric cancer–the IARC Working Group report[J]. Best Practice and Research Clinical Gastroenterology, 2014, 28(6): 1107–1114. |
| [2] | Mccubrey JA, Steelman LS, Chappell WH, et al. Ras/Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR cascade inhibitors: how mutations can result in therapy resistance and how to overcome resistance[J]. Oncotarget, 2012, 3(10): 1068–1111. |
| [3] | Chang F, Lee JT, Navolanic PM, et al. Involvement of PI3K/Akt pathway in cell cycle progression, apoptosis, and neoplastic transformation: a target for cancer chemotherapy[J]. Leukemia, 2003, 17(3): 590–603. DOI:10.1038/sj.leu.2402824 |
| [4] | Carracedo A, Pandolfi PP. The PTEN-PI3K pathway: of feedbacks and cross-talks[J]. Oncogene, 2008, 27(41): 5527–5541. DOI:10.1038/onc.2008.247 |
| [5] | Aksamitiene E, Kiyatkin A, Kholodenko BN. Cross-talk between mitogenic Ras/MAPK and survival PI3K/Akt pathways: a fine balance[J]. Biochemical Society Transactions, 2012, 40(1): 139–46. DOI:10.1042/BST20110609 |
| [6] | Kathryn B, Simon DC, Gillings AS, et al. Intrinsic resistance to the MEK1/2 inhibitor AZD6244 (ARRY-142886) is associated with weak ERK1/2 signalling and/or strong PI3K signalling in colorectal cancer cell lines[J]. International Journal of Cancer Journal International Du Cancer, 2009, 125(10): 2332–2341. DOI:10.1002/ijc.v125:10 |
| [7] | Meng J, Peng H, Dai B, et al. High level of AKT activity is associated with resistance to MEK inhibitor AZD6244 (ARRY-142886)[J]. Cancer Biology and Therapy, 2009, 8(21): 2073. DOI:10.4161/cbt |
| [8] | Hausenloy DJ, Mocanu MM, Yellon DM. Cross-talk between the survival kinases during early reperfusion: its contribution to ischemic preconditioning[J]. Cardiovascular Research, 2004, 63(2): 305–312. DOI:10.1016/j.cardiores.2004.04.011 |
| [9] | Grant S. Cotargeting survival signaling pathways in cancer[J]. Journal of Clinical Investigation, 2008, 118(9): 3003–3006. |
| [10] | She QB, Solit DB, Ye Q, et al. The BAD protein integrates survival signaling by EGFR/MAPK and PI3K/Akt kinase pathways in PTEN-deficient tumor cells[J]. Cancer Cell, 2005, 8(4): 287–297. DOI:10.1016/j.ccr.2005.09.006 |
| [11] | Wang J, Yuan Y, Zhou Y, et al. Protein interaction data set highlighted with human Ras-MAPK/PI3K signaling pathways[J]. Journal of Proteome Research, 2008, 7(9): 3879. DOI:10.1021/pr8001645 |
| [12] | Guo RX, Zhang RF, Wang XY, et al. Effects of PD98059 and LY294002 on subcutaneous xenograft of human endometrial carcinoma in nude mice[J]. Zhonghua Fu Chan Ke Za Zhi, 2011, 46(6): 446–452. |
| [13] | Ma XM, Blenis J. Molecular mechanisms of mTOR-mediated translational control[J]. Nature Reviews Molecular Cell Biology, 2009, 10(5): 307–318. DOI:10.1038/nrm2672 |
| [14] | Carracedo A, Ma L, Teruyafeldstein J, et al. Inhibition of mTORC1 leads to MAPK pathway activation through a PI3K-dependent feedback loop in human cancer[J]. Journal of Clinical Investigation, 2008, 118(9): 3065. |
| [15] | Hoeflich KP, O'Brien C, Boyd Z, et al. In vivo antitumor activity of MEK and phosphatidylinositol 3-kinase inhibitors in basal-like breast cancer models[J]. Clinical Cancer Research An Official Journal of the American Association for Cancer Research, 2009, 15(14): 4649. DOI:10.1158/1078-0432.CCR-09-0317 |
| [16] | 陈晓伟, 徐余超, 孙海翔, 等. Rapamycin抑制PI3K/AKT/mTOR信号通路对胃癌MGC-803细胞影响[J]. 中国公共卫生, 2017, 33(4): 602–606. DOI:10.11847/zgggws2017-33-04-22 |
| [17] | Zhang YJ, Tian XQ, Sun DF, et al. Combined inhibition of MEK and mTOR signaling inhibits initiation and progression of colorectal cancer[J]. Cancer Investigation, 2009, 27(3): 273–285. DOI:10.1080/07357900802314893 |
| [18] | Patrick J, Roberts JE, Usary D. Combined PI3K/mTOR and MEK inhibition provides broad antitumor activity in faithful murine cancer models[J]. Clinical Cancer Research An Official Journal of the American Association for Cancer Research, 2012, 18(19): 5290–5303. DOI:10.1158/1078-0432.CCR-12-0563 |
| [19] | Zhong H, Sanchez C, Spitrzer D, et al. Synergistic effects of concurrent blockade of PI3K and MEK pathways in pancreatic cancer preclinical models[J]. PLoS One, 2013, 8(10): e77243. DOI:10.1371/journal.pone.0077243 |
 2018, Vol. 34
2018, Vol. 34


