邻苯二甲酸酯类(phthalate esters,PAEs)是典型内分泌干扰物,有急性毒性[1]、生殖发育毒性[2 – 3]、糖代谢紊乱疾病[4 – 5]等。其最常用于塑料产品的增塑剂,易于迁移,已经在粉尘、地表水和土壤等中检出。水中PAEs前处理技术包括固相萃取、微萃取、膜萃取,液相微萃取和搅拌棒吸附萃取等,检测技术主要有气相色谱法和液相色谱法,其中最普遍使用的是气相色谱–质谱联用仪(gas chromatography-mass spectrometer,GC-MS)[6]。本研究于2016年1 — 2月采集福建省福州某医院血液透析科、闽江、居民家中和某大型超市水样各1 L,参考邱歆磊[7]方法,建立水中16种PAEs稳定性同位素内标–自动固相萃取-GC-MS检测方法。
1 材料与方法 1.1 主要仪器和设备全自动固相萃取仪AUTO SPE-06D(厦门睿科Reeko公司),气相色谱–质谱联用仪(美国Agilent公司,6890/5973i GC-MSD);色谱柱HP-5MS(0.25 mm × 30 m × 0.25 μm,美国Agilent公司);氮吹浓缩仪N-EVAP-111(美国Organomation Associates公司);马弗炉(北京美诚公司)。
1.2 试剂与耗材正己烷(色谱纯,德国Merck公司),二氯甲烷(色谱纯,美国ACS恩科化学公司),甲醇(色谱纯,德国Merck公司)和丙酮(色谱纯,韩国Duksan公司);有机试剂均需重蒸处理。固相萃取柱Supelclean ENVI-18(6 mL/500 mg,美国Supelco公司),Welchrom C18E(6 mL/1 000 mg,上海Welch公司),HC-C18 glass(6 mL/1 000 mg,德国CNW公司),Florisil PR(6 mL/1 000 mg,美国Agilent公司),Sep-Pak C18(6 mL/500 mg,美国Waters公司),HLB(6 mL/500 mg,天津力瑞公司)。
1.3 外标储备液、中间液与使用液16种PAEs混合标准品(1.0 mg/mL,custom phthalates mix, 116767-01-1ML上海安谱公司)包括:邻苯二甲酸二甲酯(dimethyl phthalate,DMP)、邻苯二甲酸二乙酯(diethyl phthalate,DEP)、邻苯二甲酸二异丁酯(diisobutyl phthalate,DIBP)、邻苯二甲酸二丁酯(dibutyl phthalate,DBP)、邻苯二甲酸二(2–甲氧基)乙酯(di(2-methoxyethyl) phthalate,DMEP)、邻苯二甲酸二(4–甲基–2–戊基)乙酯(bis(4-methyl-2-pentyl)phthalate,BMPP)、邻苯二甲酸二(2–乙氧基)乙酯(Di(2-ethoxyethyl) phthalate,DEEP)、邻苯二甲酸二戊酯(dipentyl phthalate,DPP)、邻苯二甲酸二己酯(dihexyl phthalate,DHXP)、邻苯二甲酸丁基苄基酯(benzyl butyl phthalate,BBP)、邻苯二甲酸二(2–丁氧基)乙酯(2-butoxyethyl)phthalate,DBEP)、邻苯二甲酸二环己酯(dicyclohexyl phthalate,DCHP)、邻苯二甲酸二(2–乙基)己酯(2-ethylhexyl)phthalate,DEHP)、邻苯二甲酸二苯酯(diphenyl phthalate,DPnP)、邻苯二甲酸二正辛酯(di-n-octyl phthalate,DNOP)、邻苯二甲酸二壬酯(dinonyl phthalate,DNP);移取1.0 mL的外标储备液(1.0 mg/mL),用丙酮定容至50.0 mL,即为浓度为20.0 μg/mL的中间液。移取1.0 mL中间液,用丙酮定容至10.0 mL,即为浓度为2.0 μg/mL的使用液。
1.4 内标储备液、中间液与使用液分别称取D4–邻苯二甲酸二丁酯(D4-DBP,D4-DEHP,Dr.Ehrenstorfer GmbH,93 %)和D4–邻苯二甲酸二(2–乙基)己酯(D4-DEHP,Dr.Ehrenstorfer GmbH,93 %)标准11.31 mg,丙酮定容至10.0 mL,配制成内标储备液,浓度1.13 mg/mL。再用丙酮梯度稀释为11.3 μg/mL的内标使用液。
1.5 样品采集、处理与分析(表1)2016年1 — 2月于福州某医院血液透析科、闽江、居民家中和某大型超市分别采集透析水(reverse osmosis, RO反渗)、闽江水(地表水源水)、管网末梢水(生活饮用水)和瓶装饮用水(地下水)。参考GB/T 5750.8–2006《生活饮用水标准检验方法 有机物指标》附录B[8],采样容器为玻璃容器,采样量为1 L,4 ℃保存与运输,2周内测定。如果水样有杂质,要经过0.45 μm孔径的滤膜过滤,采集自来水样时加入约40~50 mg亚硫酸钠脱氯。在水样采集、运输、储存和处理过程中,尽量使用玻璃容器或器皿。普通玻璃器皿在350 ℃下烘烤6 h,而计量器皿使用时用丙酮清洗3次。GC-MS分析时源于样品基质中的共流离子可能会影响分析物的鉴定,采用质谱全扫描(50~350 m/z)的方式进行确证。确认全自动固相萃取仪的溶剂与气路连接正常,移取200.0 mL的水样,并加入4 μL C18同位素内标使用液(11.3 μg/mL),混匀后上样。GC-MS参数进样口温度:250 ℃;进样模式:不分流进样,恒流模式;载气:He;流量:1.0 mL/min;升温条件:60 ℃(1 min),以15 ℃/min升至220 ℃,再以5 ℃/min升至290 ℃(8 min)。离子源:EI;电子能量:70 eV;接口温度:280 ℃;离子源温度:150 ℃;四极杆温度:150 ℃;溶剂延迟:8.0 min;选择离子监测(selectedion monitoring, SIM)。
| 表 1 全自动固相萃取参数 |
1.6 统计分析
保留时间(RT)与质谱定性,内标法定量,计算方法检出限(method detection limit, MDL)、定量限(limit of quantitation, LOQ)。同时计算加标回收率(%)与相对标准偏差(Relative standard deviation, RSD)进行方法验证。水样中邻苯二甲酸酯各个含量按公式(1)计算,结果以μg/L表示。(前6个按内标1计算,后10个按内标2计算)
| $\rho = \frac{{{\rho _1} \times {V_1}}}{V}$ | (1) |
ρ为水样中各邻苯二甲酸酯化合物的质量浓度(μg/L);ρ1相当于标准曲线的质量浓度(μg/L);V1为样品定容体积(mL);V为水样体积(mL)。
2 结 果 2.1 定性分析与定量离子选择(图1、表2)PAEs内标和外标进行GC-MS分析,根据PAEs标准色谱图与质谱图确定各物质保留时间、定量离子和定性离子。
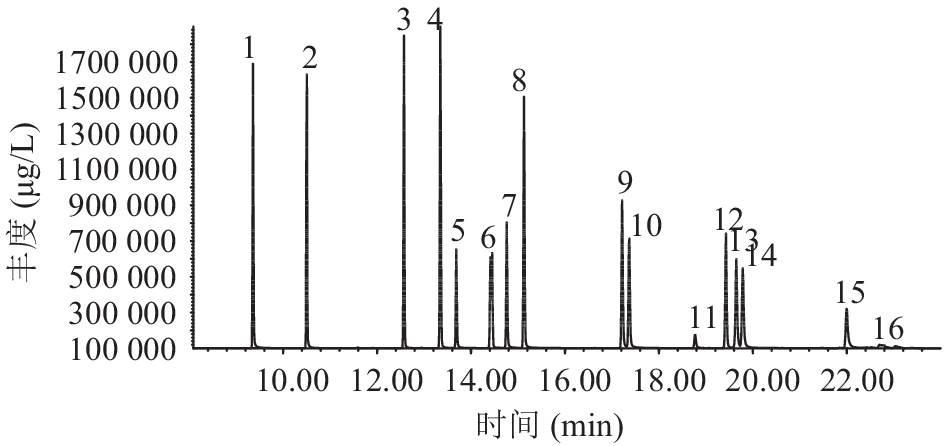
|
注:1. DMP,2. DEP,3. DIBP,4. DBP,5. DMEP,6. BMPP,7. DEEP,8. DPP,9. DHXP,10. BBP,11. DBEP,12. DCHP,13. DEHP,14. DPnP,15. DNOP,16. DNP。 图 1 PAEs混合标准溶液色谱图(2 000 μg/L) |
| 表 2 16种邻苯二甲酸酯类化合物保留时间与监测离子 |
2.2 固相萃取柱选择
对HC-C18 glass,Supelclean ENVI-18、Welchrom C18E、Sep-Pak C18、HLB和Florisil PR萃取柱进行选择,活化柱子后,直接加入内标使用液4 μL,外标使用液50 μL,用10 mL二氯甲烷以2.0 mL/min洗脱,浓缩定容至1.0 mL,上机测定,外标单点法计算同位素内标与混标的绝对回收率,内标单点法计算混标的相对回收率(n = 2)。柱子选择原则如下:(1)同位素内标绝对回收率好;(2)本底干扰小,外标相对回收率好;(3)重现性稳定。
自动固相萃取仪与玻璃固相萃取内径不配套、密封性差,剔除HC-C18 glass。各萃取柱中内标D4-DBP与D4-DEHP绝对回收率(n = 2),HLB为24.5 % ~29.8 %,Florisil PR 46.1 % ~60.5 %,且两者洗脱液均混浊,因此排除HLB和Florisil PR。Supelco ENVI-18、Sep-Pak C18 和Welchrom C18E为72.5 % ~134.3 %。Supelco ENVI-18、Sep-Pak C18 和Welchrom C18E外标相对回收率比较:Sep-Pak C18中DBP达到439.2 % ~806.1 %;Welchrom C18E中DNOP为132.3 %,DNP146.2 %;而Supelco ENVI-18,除DMEP70.7 %,DEEP60.4 %,其余在82.5 %~112.6 %,且洗脱液澄清无杂质。综合考虑内标绝对回收率与本底干扰,选择Supelco ENVI 18萃取柱。
2.3 二氯甲烷的洗脱体积与洗脱速度Supelco ENVI 18固相萃取柱活化、加标(2.2),二氯甲烷溶液以2.0 mL/min的速度洗脱,以2 mL为一段,分段收集洗脱液。以体积V为横坐标,各段洗脱液中待测物峰面积A为纵坐标绘制回收曲线。10 mL时,16种待测物均充分洗脱。故洗脱体积定为10 mL。二氯甲烷10 mL分别以2.0, 5.0和10.0 mL/min的洗脱速度,洗脱加标萃取柱(n = 2),收集洗脱液浓缩定容至1 mL。以洗脱速度为横坐标,各待测物峰面积为纵坐标,比较不同洗脱速度的洗脱效果。大部分物质,洗脱效果无明显差别,但DBP随着洗脱速度的增加,其峰面积明显下降。所以选择洗脱速度为2.0 mL/min。
2.4 萃取柱氮吹萃取柱活化、加标(2.2),N2压力25 psi,吹干10 min,然后10 mL二氯甲烷2.0 mL/min速度洗脱,氮吹浓缩至1.0 mL,单点内标法定量。BMPP由97.0 % 降至66.9 % (n = 3),其余变化不大。说明氮吹对样品中目标化合物测定影响较小。
2.5 样品瓶吸附作用对6份透析水水样加标,加标浓度0.500 μg/L, 按1.5步骤处理,3份有二氯甲烷荡洗样品瓶步骤,另外3份无此步骤,上样分析,内标法定量。结果表明二氯甲烷荡洗后,内标D4-DBP绝对回收率差别不大,在84.4 % ~99.4 %,而D4-DEHP内标从18.2 % ~48.9 % 升至84.7 % ~94.2 %。待测物中BMPP的绝对回收率从22.4 % ~33.0 % 升至74.0 % ~78.3 %,DHXP从30.3 % ~50.2 %升至87.5 %~112.0 %,DNOP从22.7 % ~39 % 升至74.5 % ~96.1 %。同时由于内标D4-DEHP绝对回收率提高,DEEP相对回收率由166.0 % ~193.3 % 降至88.1 % ~116.5 %,其余无明显变化。因此为了消除样品瓶对待测物的吸附作用,样品瓶用二氯甲烷荡洗。
2.6 各试剂材料本底检测重蒸前后试剂PAEs本底,发现重蒸试剂后本底干扰有较大改善。本研究的分析物为环境污染物,所使用的试剂材料均存在本底干扰。同时各类水体均含有DIBP、DBP、DEHP等PAEs,会对样品特别是低浓度水平的样品产生影响。因此需重蒸试剂,并采取试剂空白、分析过程空白、水样空白等措施进行本底消除,以使实验结果更加准确、可靠。
2.7 标准曲线与方法检出限(表3)移取2.0 μg/mL混合标准使用液10 、50 、100、250、500和1 000 μL,加入内标使用液20 μL,正己烷定容至1.0 mL,配制成20~2 000 μg/L浓度标准曲线。平行进样(n = 2),计算同位素内标与各待测物峰面积。以各待测物系列浓度为横坐标x(μg/L),各组分与相应内标响应值比值为纵坐标y(As/Ai)绘制各组分的标准曲线。根据文献[9],参考仪器检出限(instrument detection limit,IDL),以透析水为基质进行加标,浓度为0.020~0.030 μg/L,重复制备7个样品,计算多次测定结果的标准偏差s,代入公式MDL = st(n-1, 1-α)。其中:s为加标样品测试结果的标准偏差;t是自由度为n-1时的Student' s值,可查t值表得到,当n = 7时,在99 %置信区间(α = 0.01)下,t = 3.14;n = 加标样品数量,n ≥ 7。3倍MDL即为定量限(LOQ)。
| 表 3 PAEs线性范围、回归方程、相关系数(r)、方法检出限(MDL)和定量限(LOQ)(n = 7) |
2.8 实际水样测定、方法准确度与精密度(表4,图2)
各种水体本底不同,分别对透析水(RO反渗)、闽江水(地表水源水)、管网末梢水(生活饮用水)、瓶装饮用水(地下水)等进行PAEs本底调查(n = 6),并进行低、中、高3种浓度水平的加标实验(n = 6),计算回收率与相对标准偏差(relative standard deviation, RSD)。4类水体PAEs本底:透析水DIBP 0.089 μg/L、DBP 0.196 μg/L;闽江水含多种PAEs,以DEHP最高(0.246 μg/L),其余浓度0.025~0.201 μg/L;管网末梢水DIBP 0.112、DBP 0.843和DEHP 0.110 μg/L;瓶装饮用水DBP 0.151 μg/L和DEHP 0.115 μg/L。方法检出限为0.005~0.017 μg/L,方法定量限0.015~0.051 μg/L,回收率74.0 % ~118.4 %,RSD 1.1 % ~20.0 %,说明4类水体中PAEs的测定方法可靠,稳定。
| 表 4 4种水样加标回收率和RSD(n = 6,%) |
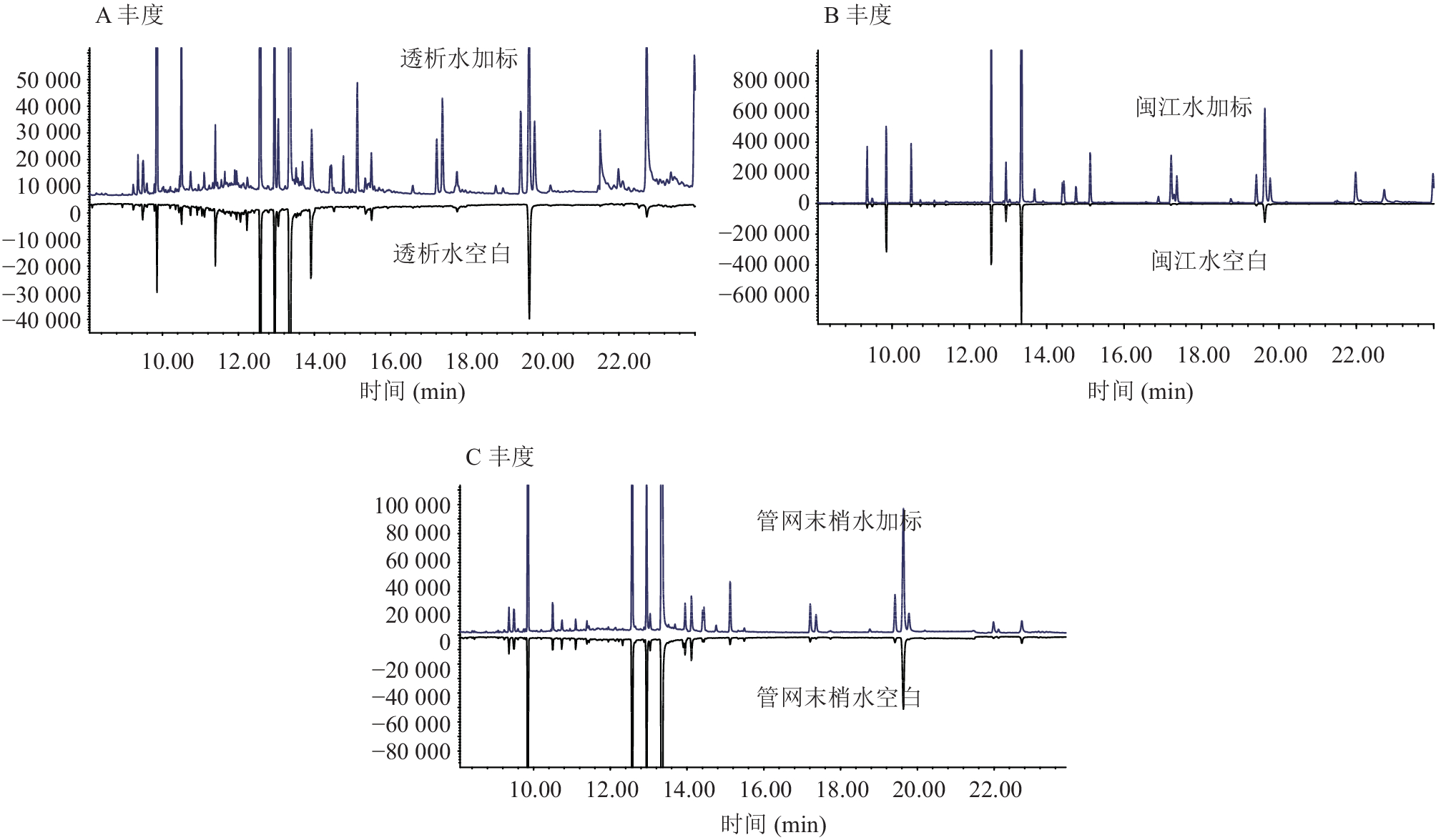
|
注:A透析水空白与加标;B闽江水空白与加标;C管网末梢水空白与加标。 图 2 各种水体的PAEs加标色谱图(加标浓度为0.500 μg/L) |
3 讨 论
世界卫生组织(World Health Organization, WHO)规定饮用水中DEHP的最大允许浓度为8 μg/L;美国环保局(United States Environment Protection Agency, USEPA)规定限值为6 μg/L;我国《生活饮用水卫生标准》(GB 5749-2006)DEHP、DEP和DBP的限值分别为8 μg/L、300 μg/L和3 μg/L。
国内外水体中PAEs以DBP、DEHP和DIBP为主。水源水国内[10](DBP 0.08~9.8 μg/L,DEHP 0.05~12.6 μg/L和DIBP 0.196 μg/L)低于印度[11]与尼日利亚[12](DBP 46.79~212.52 μg/L,DEHP 2.67~5.94 μg/L)。瓶装水国内[7](DBP 164.51 μg/L,DEHP 129.17 μg/L和DIBP 309.29 μg/L)高于国外[13 – 15](DBP 0.062~6.5 μg/L,DEHP 0.02~1.68 μg/L和DIBP 0.1~1.89 μg/L)。国内生活饮用水中[16 – 17]DBP(0.21~124.29 μg/L),DEHP(1.18~3.90 μg/L)和地下水[18 – 19]DBP(5.0~8.3 μg/L),DEHP(1.1~6.5 μg/L)。本研究4类水体PAEs也主要以DIBP、DBP和DEHP为主,且均处于较低水平(0.041~0.843 μg/L)。
PAEs检测方法目前有固相萃取–高效液相色谱法,MDL 0.18~1.86 μg/L[20],固相萃取–超高效液质联用法,LOQ 0.002 μg/L~0.632 μg/L[21],磁性多壁碳纳米管(MWCNTs)固相萃取–GC–MS法,MDL 0.04~0.47 μg/L[22 – 23],固相萃取–GC–MS/MS法,MDL 0.007~0.012 μg/L[7]。上述方法均为手动固相萃取,上样量大、操作不便、重现性差,而自动固相萃取法仅见C18膜的全自动固相萃取– GC–MS法[24],MDL 0.1~0.9 μg/L。本研究使用稳定性同位素内标–全自动固相萃取–GCMS法测定水中16种PAEs,MDL为0.005~0.017 μg/L,其准确度、精密度和自动化程度高,适用于水中PAEs的检测。
| [1] | 李欣洋, 王晔. 邻苯二甲酸二(2–乙基己)酯中毒机制研究进展[J]. 医学综述, 2015, 21(9): 1581–1584. |
| [2] | 刘殊, 戴红. 邻苯二甲酸二(2–乙基)己酯致雄性生殖毒性及其机制的研究进展[J]. 中外医疗, 2015, 34(24): 193–195. DOI:10.3969/j.issn.1674-0742.2015.24.086 |
| [3] | 刘瑾, 蔡军, 张晓霓, 等. 邻苯二甲酸二乙基已酯对未成年小鼠卵巢发育影响[J]. 中国公共卫生, 2013, 29(7): 1010–1011. DOI:10.11847/zgggws2013-29-07-22 |
| [4] | 王正, 何继瑞, 罗天雯. 邻苯二甲酸二丁酯(DBP)与2型糖尿病的研究进展[J]. 中外医疗, 2015, 34(17): 194–195. DOI:10.3969/j.issn.1674-0742.2015.17.094 |
| [5] | 孙霞, 林怡, 董四君. 邻苯二甲酸二(2-乙基)己酯暴露与糖代谢紊乱相关性的研究进展[J]. 生态毒理学报, 2014, 9(3): 413–419. |
| [6] | 刘铭雪, 丁爱中, 张波涛, 等. 水中邻苯二甲酸酯的分析检测[J]. 工业水处理, 2015, 35(10): 12–16. DOI:10.11894/1005-829x.2015.35(10).012 |
| [7] | 邱歆磊, 冯超, 汪国权. 气相色谱-质谱联用法测定瓶装水中邻苯二甲酸酯的含量[J]. 食品安全质量检测学报, 2013, 4(3): 689–698. |
| [8] | 中华人民共和国卫生部. GB/T 5750.8-2006《生活饮用水标准检验方法 有机物指标》[S]. 北京: 中国标准出版社, 2006. |
| [9] | United States Environmental Protection Agency. OPEN-FILE REPORT 99-193 NEW reporting procedures based on long-term method detection levels and some considerations for interpretations of water-quality data provided by the U. S. geological survey national water quality laboratory[R]. 1999. |
| [10] | 宋琳琳, 黄清辉, 仇雁翎, 等. 饮用水中邻苯二甲酸酯类物质的分析方法及赋存特征研究进展[J]. 清洗世界, 2016, 2: 27–34. |
| [11] | Selvaraj KK, Sundaramoorthy G, Ravichandran PK, et al. Phthalate esters in water and sediments of the Kaveri River, India: environmental levels and ecotoxicological evaluations[J]. Environmental Geochemistry and Health, 2015, 37(1): 83–96. DOI:10.1007/s10653-014-9632-5 |
| [12] | Adeogun AO, Ibor OR, Omiwole RA, et al. Occurrence, species, and organ differences in bioaccumulation patterns of phthalate esters in municipal domestic water supply lakes in Ibadan, Nigeria[J]. J Toxicol Environ Health A, 2015, 78(12): 761–777. DOI:10.1080/15287394.2015.1030487 |
| [13] | Amiridou D, Voutsa D. Alkylphenols and phthalates in bottled waters[J]. J Hazard Mater, 2011, 185(1): 281–286. DOI:10.1016/j.jhazmat.2010.09.031 |
| [14] | Otero P, Saha SK, Moane S, et al. Improved method for rapid detection of phthalates in bottled water by gas chromatography-mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2015, 997: 229–235. DOI:10.1016/j.jchromb.2015.05.036 |
| [15] | Santana J, Giraudi C, Marengo E, et al. Preliminary toxicological assessment of phthalate esters from drinking water consumed in Portugal[J]. Environ Sci Pollut Res Int, 2014, 21(2): 1380–1390. DOI:10.1007/s11356-013-2020-3 |
| [16] | 周自严, 黄仁德, 钟嶷, 等. 广州市饮用水中双酚A及邻苯二甲酸酯的调查[J]. 环境与健康杂志, 2015, 32(1): 43–45. |
| [17] | 单晓梅, 黄发源, 张兵, 等. 合肥市水源水与出厂水中增塑剂污染特征及其水环境健康风险评估[J]. 环境与职业医学, 2013, 30(10): 741–747. |
| [18] | 蒋丽佳, 许秋瑾, 梁存珍, 等. 江苏某县地下水邻苯二甲酸酯类的检测与风险评价[J]. 中国环境监测, 2013, 29(4): 5–10. |
| [19] | 王桂萍, 曹春艳, 梁存珍. 固相萃取与GC-MS联用测定地下水中的邻苯二甲酸酯[J]. 光谱实验室, 2013, 30(5): 2267–2270. |
| [20] | 何金兴, 张伟, 崔一笑, 等. 新型固相萃取 – 高效液相色谱检测饮用水中的邻苯二甲酸脂类物质[J]. 食品安全质量检测学报, 2015, 6(7): 2813–2821. |
| [21] | 张海婧, 胡小键, 林少彬. 固相萃取 – 超高效液相色谱串联质谱法测定饮用水中15种邻苯二甲酸酯[J]. 分析化学, 2014, 42(9): 1281–1287. DOI:10.11895/j.issn.0253-3820.140172 |
| [22] | 付善良, 丁利, 朱绍华, 等. 磁性多壁碳纳米管固相萃取-气相色谱-质谱法检测水样中的13种邻苯二甲酸酯类化合物[J]. 色谱, 2011, 29(8): 737–742. |
| [23] | 付善良, 丁利, 戴华, 等. 磁固相萃取/气相色谱一质谱法分析水样中的16种邻苯二甲酸酯类化合物[J]. 分析测试学报, 2011, 30(8): 847–852. |
| [24] | 马鲲鹏, 李琰, 王冬究, 等. 水中邻苯二甲酸酯类化合物的固相膜萃取-气相质谱测定法[J]. 职业与健康, 2015, 31(13): 1771–1773. |
 2018, Vol. 34
2018, Vol. 34


