2. 牡丹江医学院药学院药理教研室;
3. 黑龙江省中医药大学基础医学院生理教研室
心血管疾病已经成为影响人类健康的第1位疾病,据统计,在中国人群中心血管疾病的危险因素更为普遍,心血管疾病的发病率和死亡率在未来10年仍将呈上升趋势,占死亡人数的 > 40 % [1]。心血管疾病发病机制复杂,而心肌细胞凋亡导致的心肌细胞损伤是多种心血管疾病发生的共同病理生理机制[2]。因此,抑制心肌细胞凋亡对于改善心脏功能和减轻心脏损伤极其重要。柚皮苷(naringin)存在于成熟或近成熟的果实及果皮中,属于一种活性黄酮苷衍生物[3],是中草药骨碎补、枳壳的主要有效成分[4],具有多种药理活性,如降血脂[3]、抗炎[5]、抗氧化[6]、心脏保护[7 – 10]等。H2O2是活性氧当中的一种,被认为是经典心肌细胞损伤模型药物[11]。采用H2O2建立损伤模型探讨心血管疾病的研究较多[12],但柚皮苷对H2O2诱导的心脏损伤的保护作用研究较少。本研究拟探讨柚皮苷对H2O2诱导的H9c2心肌细胞损伤的保护作用及机制,旨在为柚皮苷临床治疗心血管疾病提供理论依据。
1 材料与方法 1.1 主要试剂与仪器H9c2细胞株来源于大鼠胚胎期心脏组织(赛百慷生物科技股份有限公司);柚皮苷(美国Sigma公司);30 % H2O2(天津市天力化学试剂有限公司);胎牛血清(德国PAN公司);DMEM-F12培养基(美国Hyclone公司);胰酶(美国Gibco公司);噻唑蓝[3-(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide, MTT]粉末(北京中生瑞泰科技有限公司);RNA提取试剂盒(美国Omega公司);逆转录试剂盒(美国Roche公司);B细胞淋巴瘤/白血病–2(B cell lymphoma 2, Bcl-2)、Bcl-2相关X蛋白(Bcl-2-associated X protein, Bax)、半胱氨酸天冬氨酸蛋白酶–3(caspase-3)、甘油醛–3–磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GADPH)兔多克隆抗体(美国Cell Signaling公司)。CO2细胞培养箱(上海力申科学仪器有限公司);生物显微镜(日本Olympus公司);酶标仪(美国Molecular Devices公司);NanoDrop 2000(美国Thermo公司);低温高速离心机(美国Sigma公司);凝胶成像系统(美国BioRad公司)。
1.2 H9c2心肌细胞培养与处理细胞常规培养于含有DMEM-F12、10 %胎牛血清(fetal bovine serum, FBS)及双抗的混合液体中,置于25 cm2的培养瓶中,在温度为37 ℃,含5 % CO2的细胞培养箱中进行培养,当细胞密度达80 %~90 %时,进行传代培养。选择生长状态良好的对数期细胞,以每孔8 × 103个细胞接种于96孔培养板中,贴壁12 h后,将H2O2依次稀释至终浓度为0、50、100、200、400、800 μmol/L后再作用12 h,加入终浓度为0.5 mg/mL MTT,37 ℃孵育4 h,加入150 μL二甲基亚砜,震荡10 min,用酶标仪570 nm处测各孔吸光度(A)值,检测各组细胞存活率。各组设置6个复孔。
1.3 指标与方法 1.3.1 H9c2心肌细胞存活率测定采用MTT法,将细胞接种于96孔培养板中,实验设对照组、模型组、柚皮苷低、中、高剂量组(10、20、40 μmol/L),用柚皮苷分别预处理2、4、8、12 h,再加入H2O2处理12 h;计算细胞存活率。
1.3.2 H9c2心肌细胞凋亡率测定采用原位末端标记法(terminal-deoxynucleotidyl transferase mediated nick end labeling,TUNEL),实验按照1.3.1分组与处理,处理后弃液,用磷酸盐缓冲溶液(phosphate buffered saline, PBS)洗涤1次,4 %多聚甲醛固定细胞30 min后,用PBS洗涤1次,加入含0.3 %TritonX-100的PBS,室温孵育5 min,再加入TUNEL检测液,37 ℃避光孵育60 min,再用PBS洗涤3次,用抗荧光淬灭封片液封片,每组选择4个视野(× 200)在荧光显微镜下计数凋亡细胞和总细胞数,细胞凋亡率 = 凋亡细胞总数/总细胞数 × 100 %。
1.3.3 H9c2心肌细胞中凋亡相关基因表达检测采用RT-PCR法,实验分组与处理同1.3.1,提取待测的细胞,并用PBS清洗,提取RNA,用NanoDrop 2000测RNA浓度,用逆转录试剂盒将其逆转录为cDNA,稀释10倍,PCR反应体系:2x SYBR green master mix 10 μL、上下游引物各1 μL、cDNA 2 μL、ddH2O 6 μL,总体积20 μL,反应条件为:95 ℃预变性30 s,95 ℃变性15 s,60 ℃退火1 min,72℃延伸45 s,共40个循环。引物序列如下:Bcl-2上游为5′-AGCGTCAACAGGGAGATGTC-3′,下游为5′-TATGCACCCAGAGTGATGCA-3′,扩增片段长度为224 bp;Bax上游为5′-AGACACC-TGAGCTGACCTTGGAG-3′,下游为5′-GTTGAAGTTGCCATCAGCAAACA-3′,扩增片段长度为196 bp;caspase–3上游为5′-GGAGCTTGGAACGCGAAGA-3′,下游为5′-ACACAAGCCCATTTCAGGGT-3′,扩增片段长度为169 bp;核糖体蛋白小亚基16(ribosomalprotein S16, RPS16)上游为5′-AAGTCTTCGGACGCAAGAAA-3′,下游为5′-TGCCCAGAAGCAGAACAG-3′,扩增片段长度为147 bp。
1.3.4 H9c2心肌细胞中凋亡相关蛋白表达检测采用Western blot法,实验分组与处理同1.3.1,提取待测细胞,用PBS清洗,用含有苯甲基磺酰氟细胞裂解液冰上裂解细胞30 min,4 ℃、12 000 r/min离心15 min后,吸取上清,二喹啉甲酸(bicinchoninic acid, BCA)蛋白定量试剂盒测定蛋白浓度。将提取的蛋白加入上样缓冲液,开水煮沸变性10 min,冰上冷却10 min,离心。上样量为60 μg,在十二烷基硫酸钠–聚丙烯酰胺凝胶(sodium dodecyl-polyacryl gradient gel electrophoresis, SDS-PAGE)中电泳(80 V),30 min后,电压转变为120 V。在150 mA电流下转膜,5 % 牛血清蛋白(bovine serum albumin, BSA)封闭1 h,Bcl-2、Bax、caspase-3(1 : 1 000稀释),4 ℃过夜,用含0.1 %吐温的Tris缓冲生理盐水(Tris buffered saline/0.05 % Tween-20, TBST)洗涤3次,每次10 min,二抗(1 : 10 000稀释)1 h后再用TBST洗膜,用显色剂显影后,照相并用Image J软件进行灰度值分析。
1.4 统计分析数据用
终浓度分别为0、50、100、200、400、800 μmol/L的H2O2处理H9c2细胞12 h时,细胞活力分别为100 %、(78.8 ± 8.6)%、(64.5 ± 6.9)%、(50 ± 5.8)%、(43.8 ± 3.0)%、(34.1 ± 7.2)%;不同浓度H2O2处理组之间细胞活力差异有统计学意义(P < 0.01)。当H 2O2浓度达到200 μmol/L时,细胞活力降至50 %左右,故本研究后续实验中选用200 μmol/L作为造模浓度。
2.2 柚皮苷对H2O2诱导的H9c2心肌细胞存活率影响(表1)用柚皮苷分别预处理2、4、8、12 h,再加入H2O2处理12 h后,结果显示,柚皮苷预处理4 h时,对H2O2所诱导的损伤有明显保护作用(P < 0.01);因此,最终采用柚皮苷处理4 h及H 2O2处理12 h进行后续实验。
|
表 1 柚皮苷对H2O2诱导的H9c2心肌细胞存活率影响(
|
2.3 柚皮苷对H2O2诱导的H9c2心肌细胞凋亡影响
结果显示,对照组、模型组、10、20、40 μmol/L柚皮苷组细胞凋亡率分别为(2.9 ± 0.3)%、(17.2 ± 2.1)%、(10.7 ± 1.9)%、(5.7 ± 1.2)%、(6.4 ± 1.5)%;与对照组比较,模型组细胞凋亡率明显升高,差异有统计学意义(P < 0.01);与模型组比较,各剂量柚皮苷组细胞凋亡率均下降,差异均有统计学意义(均 P < 0.05)。
2.4 柚皮苷对H2O2诱导的H9c2心肌细胞凋亡相关基因表达影响(表2)与对照组比较,模型组H9c2细胞中Bax、caspase-3 mRNA表达均升高(均P < 0.05),Bcl-2 mRNA表达明显下降( P < 0.01);与模型组比较,10、20、40 μmol/L柚皮苷组H9c2细胞中Bax mRNA表达均下降(均 P < 0.05),Bcl-2表达明显升高( P < 0.01);其中以20 μmol/L柚皮苷组效果最明显。
|
表 2 柚皮苷对H2O2诱导的H9c2心肌细胞凋亡相关基因表达影响(
|
2.5 柚皮苷对H2O2诱导的H9c2心肌细胞凋亡相关蛋白表达影响(图1、表3)
与对照组比较,模型组H9c2细胞中Bax、caspase-3蛋白表达均升高(均P < 0.01),Bcl-2蛋白表达明显下降( P < 0.01);与模型组比较,10、20、40 μmol/L柚皮苷组H9c2细胞中Bax、caspase-3蛋白表达均下降(均 P < 0.05),Bcl-2表达明显升高( P < 0.01)。
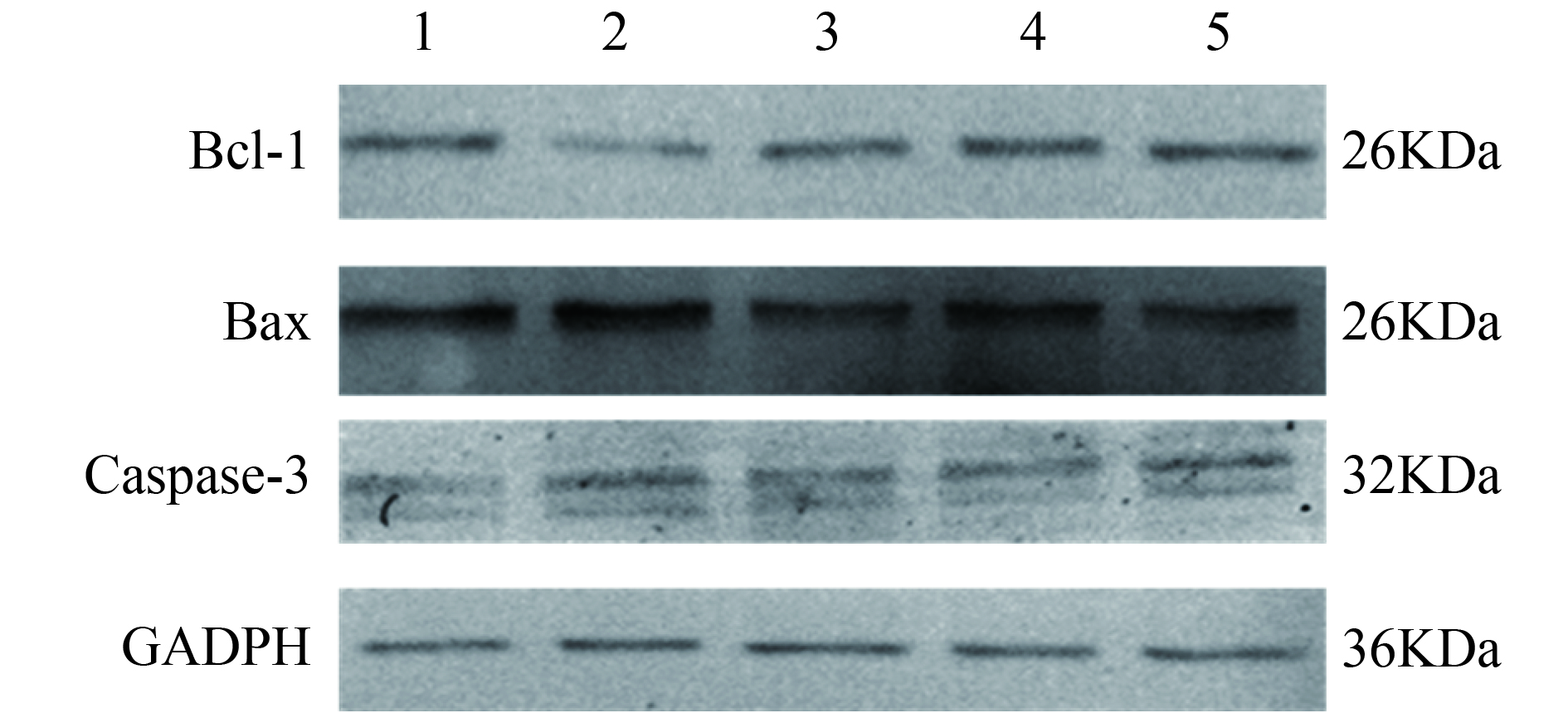
|
注:1:对照组;2:模型组;3~5:柚皮苷10、20、40 μmol/L组。 图 1 柚皮苷对H9c2心肌细胞凋亡相关蛋白表达影响 |
|
表 3 柚皮苷对H9c2心肌细胞凋亡相关蛋白表达影响(
|
3 讨 论
心血管疾病是全球发病和死亡的主要原因,且发生率和病死率逐渐增加,严重危害人类健康。心血管疾病发病机制非常复杂,细胞凋亡是其重要的促进因子,越来越多证据表明,细胞凋亡是心血管疾病心肌损伤发病机制中的主要危险因素。研究表明抗氧化剂能保护H9c2心肌细胞免受过氧化氢所导致的破坏[13]。中药有效成分柚皮苷是一种来源于芸香科柑橘属植物柚的成熟或者近成熟的干燥果皮中提取的淡黄色天然双氢黄酮类化合物[14],对糖脂代谢调节、抗炎、抗氧化应激等方面具有明显作用。
在正常情况下,活性氧(reactive oxygen species, ROS)是涉及多种细胞信号传导的重要信使,在各种ROS中,H2O2在心肌细胞中占有重要地位,其水平由抗氧化剂调控。H2O2在细胞内和细胞之间容易扩散,其大量的积累是引发凋亡的关键致病机制[15]。本研究结果显示,当H2O2浓度在200 μmol/L时,H9c2心肌细胞活力下降至50%左右,故选此浓度作为诱导损伤剂量;与模型组比较,柚皮苷组H9c2心肌细胞凋亡率下降。提示,柚皮苷可以减轻细胞的损伤,对H2O2所致细胞损伤具有一定保护作用。
细胞凋亡信号通路受Bcl-2蛋白家族调控,Bcl-2蛋白家族包括Bcl-2(Bcl-xL、Bcl-w等)抗凋亡家族、Bax(Bax、Bak等)和BH3(Bad、Bid等)促凋亡家族[16]。细胞凋亡的发生取决于这三者之间的平衡。在细胞受刺激时,BH3蛋白使Bcl-2蛋白失活,导致Bax样蛋白活化,而活化的Bax样蛋白透过外线粒体膜,引发细胞色素C释放从而激活细胞凋亡的内在途径[17]。此外,细胞凋亡调控还与Bcl-2与Bax比值密切相关,比值越小细胞凋亡越严重。Casepase-3为Bcl-2的下游调控蛋白,是引起凋亡的始发因子,Bcl-2低表达可有效激活caspase-3,导致细胞凋亡发生[18]。本研究结果显示,经H2O2诱导后,H9c2心肌细胞中促凋亡因子Bax、caspase-3 mRNA及蛋白表达明显升高,抑凋亡因子Bcl-2 mRNA及蛋白表达明显下降,Bcl-2/Bax的比值下降;而经柚皮苷干预后,与模型组比较,柚皮苷组促凋亡因子Bax、caspase-3基因及蛋白表达明显下降,抑制凋亡因子Bcl-2表达明显升高,Bcl-2/Bax比值明显升高。
综上所述,柚皮苷对H2O2诱导的H9c2心肌细胞损伤具有一定保护作用,其机制可能与柚皮苷调节心肌细胞凋亡相关基因及蛋白的表达有关。
| [1] | Chen WW, Gao RL, Liu LS, et al. Outline of the report on cardiovascular diseases in China, 2014[J]. Eur Heart J Suppl, 2016, 18(Suppl F): F2. DOI:10.1093/eurheartj/suw030 |
| [2] | Sun Y, Su Q, Li L, et al. MiR-486 regulates cardiomyocyte apoptosis by p53-mediated BCL-2 associated mitochondrial apoptotic pathway[J]. BMC Cardiovasc Disord, 2017, 17(1): 119. DOI:10.1186/s12872-017-0549-7 |
| [3] | Alam MA, Subhan N, Rahman MM, et al. Effect of citrus flavonoids, naringin and naringenin, on metabolic syndrome and their mechanisms of action[J]. Adv Nutr, 2014, 5(4): 404–417. DOI:10.3945/an.113.005603 |
| [4] | 孟娜娜, 白里雪, 李鑫鑫, 等. 柚皮苷对糖尿病及其并发症作用机制的研究进展[J]. 药物评价研究, 2017, 40(4): 560–565. |
| [5] | Gopinath K, Sudhandiran G. Naringin modulates oxidative stress and inflammation in 3-nitropropionic acid-induced neurodegeneration through the activation of nuclear factor-erythroid 2-related factor-2 signalling pathway[J]. Neuroscience, 2012, 227(1): 134–143. |
| [6] | Chen J, Guo R, Yan H, et al. Naringin inhibits ROS-activated MAPK pathway in high glucose-induced injuries in H9c2 cardiac cells[J]. Basic Clin Pharmacol Toxicol, 2014, 114(4): 293–304. DOI:10.1111/bcpt.2014.114.issue-4 |
| [7] | Rajadurai M, Prince PSM. Naringin ameliorates mitochondrial lipid peroxides, antioxidants and lipids in isoproterenol-induced myocardial infarction in Wistar rats[J]. Phytotherapy Research Ptr, 2009, 23(3): 358–362. DOI:10.1002/ptr.v23:3 |
| [8] | Neha R, Saurabh B, Mansi M, et al. Regulation of heat shock proteins 27 and 70, p-Akt/p-eNOS and MAPKs by naringin dampens myocardial injury and dysfunction in vivo after ischemia/reperfusion [J]. PLoS One, 2013, 8(12): e82577. DOI:10.1371/journal.pone.0082577 |
| [9] | You Q, Wu Z, Wu B, et al. Naringin protects cardiomyocytes against hyperglycemia-induced injuries in vitro and in vivo [J]. J Endocrinol, 2016, 230(2): 197–214. DOI:10.1530/JOE-16-0004 |
| [10] | Rajadurai M, Prince PS. Preventive effect of naringin on isoproterenol-induced cardiotoxicity in Wistar rats: an in vivo and in vivo study [J]. Toxicology, 2007, 232(3): 216–225. DOI:10.1016/j.tox.2007.01.006 |
| [11] | Wang W, Wang L, Yang H, et al. Protective effects of yindanxinnaotong capsule in a rat model of myocardial ischemia /reperfusion injury[J]. J Tradit Chin Med, 2014, 34(6): 699–709. DOI:10.1016/S0254-6272(15)30085-6 |
| [12] | Soner BC, Şahin AS. Cardiovascular effects of resveratrol and atorvastatin treatments in an H2O2-induced stress model [J]. Exp Ther Med, 2014, 8(5): 1660–1664. DOI:10.3892/etm.2014.1956 |
| [13] | Park C, So HS, Shin CH, et al. Quercetin protects the hydrogen peroxide-induced apoptosis via inhibition of mitochondrial dysfunction in H9c2 cardiomyoblast cells[J]. Biochem Pharmacol, 2003, 66(7): 1287–1295. DOI:10.1016/S0006-2952(03)00478-7 |
| [14] | 李积东, 黄起壬. 柚皮苷的分离提取及药理作用研究进展[J]. 北方药学, 2014, 11(7): 67. |
| [15] | Bae S, Park M, Kang C, et al. Hydrogen peroxide-responsive nanoparticle reduces myocardial ischemia/reperfusion injury[J]. J Am Heart Assoc, 2016, 5(11): e003697. DOI:10.1161/JAHA.116.003697 |
| [16] | 李波, 杨萌, 刘景伟, 等. HRS调控凋亡相关蛋白Bcl-xL、Bad、Bcl-2、Bax对大鼠心肌缺血再灌注损伤影响[J]. 中国公共卫生, 2015, 31(7): 889–892. DOI:10.11847/zgggws2015-31-07-09 |
| [17] | Dinh TN, Onea AS, Jazirehi AR, et al. Combination of celecoxib (Celebrex®) and CD19 CAR-redirected CTL immunotherapy for the treatment of B-cell non-Hodgkin's lymphomas[J]. Am J Clin Exp Immunol, 2017, 6(3): 27–42. |
| [18] | 孟剑锋. 地黄多糖对H2O2诱导乳鼠心肌细胞损伤的保护作用及其机制研究 [J]. 中药药理与临床, 2016(1): 90–95. |
 2018, Vol. 34
2018, Vol. 34


