β-谷甾醇是甾醇类成分之一,广泛存在于各种植物油、坚果及植物种子中,具有许多重要的生理功能[1]。研究表明,β-谷甾醇具有多种药理作用,如降血脂、抗炎、细胞毒作用[2]。在抗肿瘤研究方面,以往的研究主要集中在β-谷甾醇对乳腺癌、结肠癌、前列腺癌等细胞株的细胞毒作用方面[3],但对体内移植肝癌的抗肿瘤作用研究较少。本研究以H22荷瘤小鼠为动物模型,探讨β-谷甾醇体内抗肿瘤作用及机制。结果报告如下。
1 材料与方法 1.1 主要试剂与仪器β-谷甾醇(上海晶纯生化科技股份有限公司);H22肝癌细胞株(中国科学院上海细胞所);注射用环磷酰胺(上海活乐生物科技有限公司);小鼠γ-干扰素(interferon-γ, IFN-γ)、白细胞介素-6(interleukin-6, IL-6)、血管内皮生长因子(vascular endothelial growth factor, VEGF)酶联免疫(ELISA)试剂盒(美国R & D公司)。电子分析天平(常熟市百灵天平仪器有限公司),酶标仪(美国Bio-Tek公司)。
1.2 实验动物4~6周龄SPF(specific pathogen free)级雄性ICR小鼠50只,体重18~22 g,购于长春市亿斯实验动物技术有限责任公司,许可证号码:SCXK(吉)2011-0004,饲养环境温度为18~22 ℃,湿度50%~60%,饲喂普通小鼠饲料。
1.3 动物模型建立与分组处理常规方法复苏H22小鼠肝癌细胞,取0.2 mL细胞悬液注射到小鼠腹腔内,5~7 d后,在无菌条件下从小鼠腹腔中抽取乳白色腹水,并按一定比例稀释后,连续传2代;随机取40只小鼠于右上肢腋部皮下处接种腹水瘤细胞悬液0.2 mL。接种24 h后,将小鼠随机分成4组,每组10只,分别为模型组、环磷酰胺组(腹腔注射30 mg/kg)、β-谷甾醇高、低剂量组(腹腔注射50、10 mg/kg),连续给药14 d,每天观察肿瘤的形成及生长情况;未接种肿瘤的小鼠10只作为对照组,腹腔注射生理盐水。
1.4 指标与方法 1.4.1 抑瘤率检测末次给药后禁食24 h,称体重,摘眼球取血,颈椎脱臼处死,剥离瘤块并称重,计算抑瘤率。抑瘤率=(对照组平均瘤重-给药组平均瘤重)/对照组平均瘤重×100%
1.4.2 脏器指数测定将小鼠解剖,称取脾脏及胸腺质量,分别计算小鼠的脏器指数,脾脏、胸腺指数(mg/g)=脾脏、胸腺质量(mg)/体重(g)。
1.4.3 血清指标测定取全血,在37 ℃静置片刻,离心,取血清,采用ELISA法测定IL-6、IFN-γ和VEGF含量,具体操作步骤按试剂盒说明书进行。
1.4.4 组织病理学观察H22荷瘤小鼠皮下移植瘤组织与脾脏组织经10%甲醛溶液固定24 h,常规脱水、包埋、切片(5 μm)、脱蜡处理后,进行苏木素-伊红(hematoxylin-eosin, HE)染色,于光学显微镜下(×400)进行病理形态学观察。
1.5 统计分析数据以x±s表示,采用SPSS 17.0软件进行统计分析,组间比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 β-谷甾醇对荷瘤小鼠抑瘤作用模型组、环磷酰胺组、β-谷甾醇低、高剂量组小鼠瘤重分别为(1.80±0.09)、(0.79±0.14)、(1.05±0.08)、(0.85±0.05)g;与模型组比较,环磷酰胺组和β-谷甾醇高、低剂量组小鼠瘤重明显减轻(P < 0.01);环磷酰胺组、β-谷甾醇低、高剂量组小鼠抑瘤率分别为56.1%、41.4%、53.0%。
2.2 β-谷甾醇对荷瘤小鼠脏器指数影响(表 1)| 表 1 β-谷甾醇对H22荷瘤小鼠免疫器官影响(x±s,n=10) |
各组小鼠体重无明显差异。与模型组比较,环磷酰胺组小鼠脾脏重量减小,脾指数明显降低;β-谷甾醇高、低剂量组小鼠脾指数明显高于模型组;与模型组比较,环磷酰胺组、高剂量β-谷甾醇组小鼠胸腺指数均明显升高(P < 0.01)。
2.3 β-谷甾醇对荷瘤小鼠血清学指标影响(表 2)| 表 2 β-谷甾醇对H22荷瘤小鼠血清学指标影响(x±s,n=10) |
与对照组比较,模型组小鼠血清中IL-6、VEGF水平明显升高;与模型组比较,高剂量β-谷甾醇组小鼠血清中IL-6水平明显降低,高、低剂量β-谷甾醇组小鼠血清中IFN-γ水平明显升高,环磷酰胺组、高、低剂量β-谷甾醇组小鼠血清中VEGF水平明显降低,差异均有统计学意义(P < 0.01)。
2.4 β-谷甾醇对荷瘤小鼠组织结构影响 2.4.1 β-谷甾醇对荷瘤小鼠肿瘤组织结构影响(图 1)
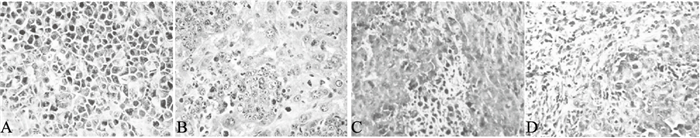
|
注:A:模型组;B:环磷酰胺组;C、D:低、高剂量β-谷甾醇组。 图 1 β-谷甾醇对荷瘤小鼠肿瘤组织结构影响(HE,×400) |
模型组小鼠肿瘤组织内部细胞排列整齐,生长旺盛,细胞核清晰可见(图 1A);环磷酰胺组小鼠肿瘤组织中可见大面积的坏死区域,肿瘤组织疏松,且细胞排列不规则(图 1B);β-谷甾醇组小鼠肿瘤组织细胞也呈现一定的坏死区域,肿瘤组织细胞凋亡明显(图 1C、D)。
2.4.2 β-谷甾醇对荷瘤小鼠脾脏组织结构影响(图 2)
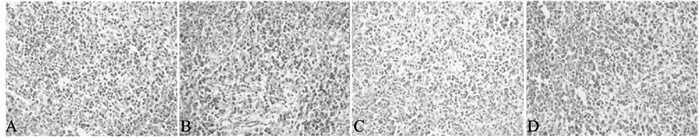
|
注:A:对照组;B:模型组;C:环磷酰胺组;D:高剂量β-谷甾醇组。 图 2 β-谷甾醇对荷瘤小鼠脾脏组织结构影响(HE,×400) |
对照组小鼠脾脏白髓(深染)和红髓(浅染)区域明显,边界分明,边缘区清晰(图 2A);模型组小鼠脾脏组织质地疏松,白髓比例明显增大,未见明显的边缘区(图 2B);环磷酰胺组小鼠脾脏组织白髓与红髓有可见边缘区,白髓比例增加不明显(图 2C);β-谷甾醇高剂量组小鼠脾脏白髓与红髓界限明显,边缘清晰可见(图 2D)。
3 讨论研究表明,β-谷甾醇在肿瘤的预防与治疗中均有重要作用,能够抑制肿瘤细胞的增殖与发生,抑制肿瘤细胞的分化与增生,同时能够诱发肿瘤细胞凋亡[4-5]。本研究结果表明,β-谷甾醇能够明显抑制肝癌H22移植肿瘤的生长,抑瘤率可达53%(β-谷甾醇50 mg/kg组),与广谱抗癌药环磷酰胺[6](阳性对照组)接近。胸腺的主要功能是产生T淋巴细胞和分泌胸腺素,主要参与细胞免疫[7];脾脏中有丰富的淋巴细胞和巨噬细胞参与肿瘤免疫,如T细胞、B细胞、K细胞、巨噬单核细胞、自然杀伤细胞、杀伤细胞、淋巴因子活化杀伤细胞(lymphokine-activated killer, LAK细胞)、树突状细胞[8-9],而B淋巴细胞比例较大,主要与体液免疫关系密切[10],故脏器指数可在一定程度上反映机体免疫功能的强弱[11]。本研究结果显示,与对照组比较,β-谷甾醇50 mg/kg组荷瘤小鼠的胸腺指数和脾指数明显增加。提示β-谷甾醇对小鼠细胞免疫和体液免疫均有增强作用。这与作为免疫抑制剂的环磷酰胺不同[12-13],环磷酰胺组荷瘤小鼠脾指数明显低于模型组,抑制了体液免疫[14]。
IFN-γ是一种具有抗病毒、抗肿瘤和免疫调节作用的细胞因子,主要由活化的T细胞和自然杀伤细胞(natural killer cell,NK)产生;IFN-γ可通过延长细胞周期以延缓肿瘤细胞的生长和繁殖,通过抑制癌基因的表达阻止或减慢肿瘤细胞的转化过程,激活巨噬细胞、NK细胞等直接杀伤癌细胞或间接抑制癌基因;还可通过诱导肿瘤坏死因子、促进癌细胞肿瘤坏死因子(tumor necrosis factor,TNF)受体、主要组织相容性复合体(major histocompatibility complex Ⅱ,MHCⅡ)类抗原表达,使其易被杀伤性T淋巴细胞识别而被杀伤[15]。IFN-γ高表达可一定程度下调VEGF,从而间接影响肿瘤新生血管的形成[16]。IL-6是一种由多种细胞产生的多功能细胞因子, 在免疫应答、急性期反应、造血调节中起重要作用,尤其是与肿瘤的发生发展、预后及治疗密切相关[17]。研究表明,降低IL-6及其受体的异常表达或干扰、阻断IL-6信号传导途径可抑制肿瘤的发生和发展[18-19]。本研究结果显示,与模型组比较,β-谷甾醇组荷瘤小鼠血清中IFN-γ水平升高,IL-6表达水平下降。提示β-谷甾醇对小鼠H22肝癌移植瘤的抑制作用可能与其促进IFN-γ表达、抑制IL-6表达有关。
研究表明,几乎所有的肿瘤组织均能产生VEGF,在肿瘤患者血清及瘤体内均能检测到异常升高的VEGF,VEGF通过旁分泌途径刺激肿瘤血管内皮增生、迁移,诱导血管形成,促进肿瘤生长[20-21]。VEGF通过刺激血管新生促进肿瘤细胞的生长和转移,是肿瘤血管生成过程中的重要调节因子[22]。VEGF的肿瘤免疫抑制作用包括影响树突状细胞(DC)的分化与成熟、阻碍DC的抗原递呈功能、影响细胞毒性T细胞的免疫杀伤功能、促进肿瘤组织新生血管的形成和抑制肿瘤细胞凋亡[23]。本研究结果显示,与模型组比较,高、低剂量β-谷甾醇组荷瘤小鼠血清中VEGF水平均明显降低。提示,VEGF可能是β-谷甾醇抗肿瘤的作用靶点。
| [1] | 张忠泉, 邢煜君, 胡国强, 等. β-谷甾醇诱导人肝癌HepG2细胞凋亡机制研究[J]. 中国中药杂志, 2011, 36(15): 2145–2148. |
| [2] | 袁金伟, 王帆, 买文鹏, 等. β-谷甾醇的结构修饰研究进展[J]. 河南工业大学学报:自然科学版, 2015, 36(2): 107–112. |
| [3] | 肖志彬, 贾韩学, 刘小雷. β-谷甾醇药理活性的研究现状[J]. 世界最新医学信息文摘, 2015, 15(8): 66–68. |
| [4] | 程静, 刘军权, 陈复兴, 等. β-谷甾醇对人自然杀伤细胞杀伤胰腺癌SW-1990细胞的影响[J]. 检验医学与临床, 2012, 9(24): 3078–3082. DOI:10.3969/j.issn.1672-9455.2012.24.020 |
| [5] | 汤钊猷. 现代肿瘤学[M]. 上海: 复旦大学出版社, 2011: 278-279. |
| [6] | 郭玮, 罗琼, 刘帅, 等. 麦角甾醇对S180荷瘤小鼠抑瘤作用及机制[J]. 中国公共卫生, 2015, 31(12): 1606–1608. DOI:10.11847/zgggws2015-31-12-24 |
| [7] | Zhu QW, Chen JH, Li Q, et al. Antitumor activity of polysaccharide from Laminaria japonica on mice bearing H22 liver cancer[J]. International Journal of Biological Macromolecules, 2016, 92: 156–158. DOI:10.1016/j.ijbiomac.2016.06.090 |
| [8] | 姜从桥. 如何看待脾脏的抗肿瘤功能[J]. 中华普通外科学文献:电子版, 2008, 2(6): 444–445. |
| [9] | Chadburn A. The spleen:anatomy and anatomical function[J]. Semin Hematol, 2000, 37(Suppl 1): 13–21. |
| [10] | Choi JN, Choi YH, Lee JM, et al. Anti-inflammatory effects of β-sitosterol-β-D-glucoside from Trachelospermum jasminoides(Apocynaceae) in lipopolysaccharid e-stimulated RAW 264.7 murine macrophages[J]. Natural Product Research, 2012, 26(24): 2340–2343. DOI:10.1080/14786419.2012.654608 |
| [11] | 黄挺章, 李远辉, 郭圣奇, 等. 薏苡茎醇提取物对荷H22小鼠体内抗肿瘤作用[J]. 天津医药, 2015, 43(11): 1278–1281. DOI:10.11958/j.issn.0253-9896.2015.11.015 |
| [12] | Yan D, Bao HY, Bau T, et al. Antitumor components from Naematoloma fasciculare[J]. Microbiol Biotechnol, 2009, 19(10): 1135–1138. |
| [13] | Liz R, Zanatta L, dos Reis GO, et al. Acute effect of β-sitosterol on calcium uptake mediates anti-inflammatory effect in murine activated neutrophils[J]. Journal of Pharmacy and Pharmacology, 2013, 65(1): 115–122. DOI:10.1111/j.2042-7158.2012.01568.x |
| [14] | 王梓. 热裂解人参皂苷的分析、制备工艺及抗肿瘤活性研究[D]. 长春: 吉林农业大学博士学位论文, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10193-1016704251.htm |
| [15] | 杨生海, 殷宏, 刘永生, 等. 干扰素-γ研究进展[J]. 生物技术通报, 2010(8): 29–34. |
| [16] | Folkman J. Anti-angiogenesis:new concept for therapy of therapy of solid tumors[J]. Ann Surg, 1972, 175(3): 409–416. DOI:10.1097/00000658-197203000-00014 |
| [17] | Hsu CP, Chung YC. Influence of interleukin-6 on the invasiveness of human colorectal carcinoma[J]. Anticancer Res, 2006, 26(6B): 4607–4614. |
| [18] | Yuan H, Liddle FJ, Mahajan S, et al. IL-6-induced survival of colorectal carcinoma cells is inhibited by butyrate through down-regulation of the IL-6 receptor[J]. Carcinogenesis, 2004, 25(11): 2247–2255. DOI:10.1093/carcin/bgh246 |
| [19] | Feng J, Yang Z, Li Y, et al. The rational designed antagonist derived from the complex structure of interleukin-6 and its receptor affectively blocking interleukin-6 might be a promising treatment in multiple myeloma[J]. Biochimie, 2006, 88(9): 1265–1273. DOI:10.1016/j.biochi.2006.03.003 |
| [20] | Choudhari SR, Khan MA, Harris G, et al. Deactivation of Akt and STAT3 signaling promotes apoptosis, inhibits proliferation, and enhances the sensitivity of hepatocellular carcinoma cells to an anticancer agent, Atiprimod[J]. Mol Cancer Ther, 2007, 6(1): 112–121. DOI:10.1158/1535-7163.MCT-06-0561 |
| [21] | Folkman J. Seminars in medicine of the Beth Israel Hospital, Boston:clinical applications of research on angiogenesis[J]. N Engl J Med, 1995, 333(26): 1757–1763. DOI:10.1056/NEJM199512283332608 |
| [22] | 韩螟, 许而艳, 李恩民. 恶性肿瘤中MMP-9表达调控机制研究进展[J]. 国外医学:分子生物学分册, 2003, 25(1): 24–26. |
| [23] | 崔澄, 胡建军, 杨彦忠. VEGF在肿瘤免疫抑制中的作用及其临床应用前景[J]. 白求恩军医学院学报, 2005, 3(1): 44–47. |
 2017, Vol. 33
2017, Vol. 33


