胃癌是常见的恶性肿瘤,虽然近年来中国胃癌的发病率和死亡率都有下降趋势,但其仍位于癌症死亡原因前列[1]。肿瘤的发生是多种因素共同作用的结果,细胞生长失调是其中的一个重要因素,而信号转导紊乱又是细胞生长失调的重要特征。PI3K/AKT/mTOR信号通路参与调控正常细胞的生命活动,已有研究表明,该通路失调与癌症的发生发展密切相关。因此,本研究对人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphatase and tensin homologue deleted on chromosome 10 p,PTEN)、磷酸化蛋白激酶B(phosphorylated protein kinase B,p-AKT)和磷酸化哺乳动物雷帕霉素靶蛋白(phosphorylated mammalian target of rapamycin,p-mTOR)在胃癌组织、癌旁组织和正常人胃黏膜组织中的表达情况进行检测,探讨上述蛋白与临床病理特征的关系,结果报告如下。
1 材料与方法 1.1 一般资料本实验所有样本均来自于江苏省中医院2015—2016年胃癌手术及胃镜检查,样本离体后立即中性10%福尔马林固定,常规石蜡包埋。所有胃癌病人手术前未经过放化疗,临床病理资料完整,且术前组织病理学检查确诊为胃癌。本次共收集66例胃癌患者,分别取其胃癌组织及癌旁组织(距离肿瘤边缘≥5 cm),正常胃黏膜组织取自39名胃镜检查正常者。病理资料分布如下:66例肿瘤患者中男性42例,女性24例;年龄38~87岁,平均年龄约为65岁;肿瘤直径≥5 cm的患者28例,肿瘤直径 < 5 cm的患者38例;分化程度:低分化胃癌患者24例,中高分化胃癌患者42例;肿瘤浸润深度:未达浆膜层的17例,达浆膜层49例;未出现淋巴结转移17例,出现淋巴结转移49例;66例中只有4例发现有远处转移。根据美国癌症联合协会(American Joint Committee On Cancer,AJCC)和国际抗癌联盟(International Union for Cancer Control,UICC)第7版胃癌TNM(tumor-node-metastasis)分期标准[2]:Ⅰ期8例,Ⅱ期22例,Ⅲ期32例,Ⅳ期4例。
1.2 方法与试剂用免疫组化(streptavidin-perosidase,SP)法,即链霉菌抗生物素蛋白-过氧化物酶连结法检测PTEN、p-AKT和p-mTOR蛋白在胃癌、癌旁和正常胃黏膜组织中的表达情况。鼠抗人PTEN、p-AKT和p-mTOR单克隆抗体购自美国Santa Cruz公司,免疫组化SP试剂盒购自福州迈新生物科技公司,DAB显色液购自丹麦Dako公司。
1.3 结果判断由2位资深病理医生分别对免疫组化结果进行判读。p-mTOR的阳性着色主要表现为在细胞核出现棕黄色颗粒,p-AKT和PTEN阳性着色主要表现在细胞核和细胞质中出现棕黄色颗粒。随机选取10个高倍镜(×400) 视野,按染色强度将着色结果分为4个等级:0分(无着色),1分(浅黄色)、2分(棕黄色)、3分(黄褐色);根据视野内阳性细胞所占比例,将着色结果分为0分(0%~10%)、1分(11%~25%)、2分(26%~50%)、3分(51%~100%),最终得分=强度得分×百分比得分,取2位医生判读结果最终得分的平均值,最终得分≥3分为阳性,最终得分 < 3分为阴性。
1.4 统计分析应用SPSS 18.0软件对数据进行分析,采用χ2检验比较PTEN、p-AKT、p-mTOR蛋白在胃癌、癌旁和正常胃黏膜组织中的表达情况以及不同临床特点的胃癌组织之间是否存在差异,用Pearson相关分析PTEN、p-AKT、p-mTOR 3种蛋白阳性表达之间的相关性,以P < 0.05为差异有统计学意义。
2 结果 2.1 PTEN、p-AKT、p-mTOR在胃癌、癌旁和正常胃黏膜组织中的表达(图 1、表 1)
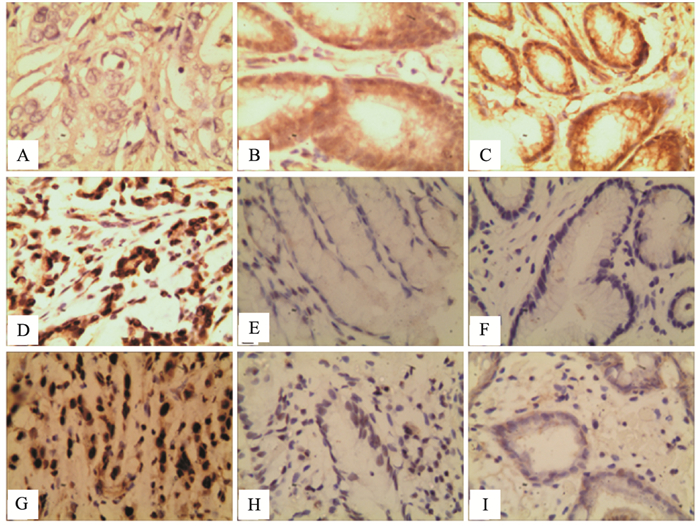
|
注:A:PTEN在胃癌中呈阴性表达;B:PTEN在癌旁呈阳性表达;C:PTEN在正常胃黏膜呈阳性表达;D:p-AKT在胃癌中呈阳性表达;E:p-AKT在癌旁呈阴性表达;F:p-AKT在正常胃黏膜呈阴性表达;G:p-mTOR在胃癌中呈阳性表达;H:p-mTOR在癌旁呈阴性表达;I:p-mTOR在正常胃黏膜呈阴性表达。 图 1 PTEN、p-AKT、p-mTOR在胃癌、癌旁和正常胃黏膜中的表达(×400) |
| 表 1 PTEN、p-AKT、p-mTOR在胃癌、癌旁和正常胃黏膜组织中的表达 |
免疫组化结果显示,PTEN和p-AKT阳性着色主要表现在细胞核和细胞质中出现棕黄色颗粒,p-mTOR的阳性着色主要表现为在细胞核出现棕黄色颗粒(见图 1)。PTEN在胃癌、癌旁和正常胃黏膜组织的阳性表达率分别为53.03%(35/66)、84.85%(56/66) 和74.36%(29/39)。p-AKT在胃癌、癌旁和正常胃黏膜组织的阳性表达率分别为56.06%(37/66)、16.67%(11/66) 和2.56%(1/39)。p-mTOR在胃癌、癌旁和正常胃黏膜组织的阳性表达率分别为90.91%(60/66)、71.21%(47/66) 和5.13%(2/39)。PTEN、p-AKT和p-mTOR蛋白在胃癌组织、癌旁组织及正常胃黏膜组织中的表达阳性率差异均具有统计学意义(P < 0.001)。
2.2 PTEN、p-AKT和p-mTOR在胃癌组织中的表达与临床病理参数的关系(表 2)| 表 2 PTEN、p-AKT、P-mTOR在胃癌组织中的表达与临床病理参数的关系 |
PTEN在胃癌中的表达与患者年龄、性别、肿瘤的直径、分化程度、浸润深度、淋巴结转移以及TNM分期均无关(P > 0.05)。p-AKT在胃癌中的表达与患者年龄、性别和肿瘤直径无关(P > 0.05),与肿瘤分化程度、浸润深度、淋巴结转移和TNM分期有关(P < 0.05)。p-mTOR在胃癌中的表达仅与肿瘤浸润深度有关(P < 0.05),与患者年龄、性别、肿瘤的直径、分化程度、淋巴结转移以及TNM分期均无关(P > 0.05)。
2.3 胃癌中PTEN、p-AKT、p-mTOR蛋白表达之间的相关性分析利用Pearson相关分析胃癌中的PTEN、p-AKT、p-mTOR 3种蛋白阳性表达率之间是否存在相关性。66例胃癌患者中,PTEN和p-AKT同为阳性者为15例,同为阴性者为9例,PTEN和p-mTOR同为阳性者为34例,同为阴性者为3例,p-AKT和p-mTOR同为阳性者为33例,同为阴性者为4例。经分析发现,PTEN蛋白与p-AKT蛋白阳性表达率之间存在负相关关系且具有统计学意义(r=-0.283,P=0.022);PTEN蛋白和p-mTOR蛋白阳性表达率之间无明显相关(r=0.039,P=0.758);p-AKT蛋白与p-mTOR蛋白阳性表达率之间无明显相关(r=0.113,P=0.318)。
3 讨论PI3K/AKT/mTOR信号通路已被发现在多种肿瘤细胞中异常激活,与癌症的发生发展密切相关。PTEN是PI3K/AKT通路的负性调控因子,拥有双重特异性磷酸酶活性的抑癌基因[3],具有抑制细胞增殖、迁移和血管生成以及诱导细胞凋亡等生物学作用。已有研究表明,PTEN表达异常与乳腺癌、肝癌、结肠癌和前列腺癌等多种肿瘤有关[4-7]。本研究发现,PTEN在胃癌组织中表达低于癌旁和正常胃黏膜组织,且差异有统计学意义(P < 0.05)。说明PTEN的低表达或不表达使得其在正常细胞中所具有的抑制增殖、迁移和诱导凋亡的能力降低,从而使细胞发生癌变的可能性增加。本研究发现,PTEN蛋白在胃癌组织中的表达在不同年龄、不同性别、不同直径大小、不同分化程度、不同浸润深度、有无淋巴结转移以及不同TNM分期的肿瘤之间没有发现统计学差异,提示PTEN可能与胃癌的病情严重程度、转移及预后等因素无关。
AKT为PTEN/PI3K的下游效应因子,PTEN的失活将导致AKT的异常活化。p-AKT是AKT的活化形式,其在细胞的增殖、分化和存活中扮演着重要的角色。有研究发现,其在肺癌、乳腺癌、结直肠癌等多种肿瘤中异常活化[8-10]。本研究发现,p-AKT在胃癌组织中的表达高于癌旁和正常胃黏膜组织,且差异有统计学意义(P<0.05)。同时发现P-AKT蛋白的表达与性别、年龄和肿瘤大小无关(P > 0.05),而与分化程度、浸润深度、淋巴结转移和TNM分期相关(P < 0.05),这与XU等[11]的研究结果相似。对结果进行分析可发现,与p-AKT表达水平相关的几项临床特征指标分别为分化程度、浸润深度、有无淋巴结转移、TNM分期,且各项指标都呈现出恶性程度越高阳性表达水平越强的趋势。因此,p-AKT可作为判断胃组织是否发生癌变、胃癌的恶性程度的重要指标,在临床可能有助于胃癌的诊断,在胃癌的治疗中也可作为一个靶点。
mTOR位于PI3K/AKT/mTOR信号通路的下游,活化后通过介导下游重要信号分子而影响细胞增殖、抑制细胞凋亡,在多种恶性肿瘤中发现mTOR高表达。本研究发现,p-mTOR在胃癌组织中的表达高于癌旁和正常胃黏膜组织,且差异有统计学意义(P < 0.05)。p-mTOR在胃癌中的表达与患者年龄、性别、肿瘤的直径、分化程度、淋巴结转移以及TNM分期均无关(P > 0.05),仅与肿瘤浸润深度有关(P < 0.05)。提示p-mTOR蛋白阳性表达可能与胃癌的浸润深度有关,并呈现出浸润深度越深,p-mTOR蛋白阳性表达越强的趋势。
该实验发现,胃癌中PTEN表达降低,而p-AKT表达升高,两者存在负相关关系,提示抑癌基因PTEN的突变或缺失使其抑制AKT的能力下降,导致AKT活化,p-AKT蛋白表达升高,引起该通路活化。但p-mTOR表达升高与PTEN表达降低和p-AKT表达升高无明显相关关系,可能因为PTEN并不是直接作用于m-TOR,PTEN只是mTOR的上游调节因子之一,而且PI3K/AKT/mTOR信号通路自身存在多个反馈回路,如mTORC1或AKT被抑制后,均会导致上游多种受体酪氨酸激酶表达増加,进一步导致PI3K信号通路的重新活化[12-14]。
综上所述,PTEN在胃癌组织中低表达,p-AKT和p-mTOR在胃癌组织中高表达,PI3K/AKT/mTOR信号转导通路可能参与了胃癌的发生与发展。
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [2] | Washington K. 7th edition of the AJCC cancer staging manual:stomach[J]. Ann Surg Oncol, 2010, 17(12): 3077–3079. DOI:10.1245/s10434-010-1362-z |
| [3] | Steck PA, Pershouse MA, Jasser SA, et al. Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers[J]. Nature Genetics, 1997, 15(4): 356–362. DOI:10.1038/ng0497-356 |
| [4] | Esteva FJ, Guo H, Zhang SY, et al. PTEN, PIK3CA, p-AKT, and p-p70S6K status:association with trastuzumab response and survival in patients with HER2-positive metastatic breast cancer[J]. American Journal of Pathology, 2010, 177(4): 1647–1656. DOI:10.2353/ajpath.2010.090885 |
| [5] | Song MS, Carracedo A, Salmena L, et al. Nuclear PTEN regulates the APC-CDH1 tumor-suppressive complex in a phosphatase-independent manner[J]. Cell, 2011, 144(2): 187–199. DOI:10.1016/j.cell.2010.12.020 |
| [6] | O'Brien CA, Pollett A, Gallinger S, et al. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice[J]. Nature, 2007, 445(7123): 106–110. DOI:10.1038/nature05372 |
| [7] | Gabriel K, Ingram A, Austin R, et al. Regulation of the tumor suppressor PTEN through exosomes:a diagnostic potential for prostate cancer[J]. PLoS One, 2013, 8(7): e70047. DOI:10.1371/journal.pone.0070047 |
| [8] | Massion PP, Taflan PM, Shyr Y, et al. Early involvement of the phosphatidylinositol 3-kinase/Akt pathway in lung cancer progression[J]. Am J Respir Crit Care Med, 2004, 170(10): 1088–1094. DOI:10.1164/rccm.200404-487OC |
| [9] | Levine DA, Bogomolniy F, Yee CJ, et al. Frequent mutation of the PIK3CA gene in ovarian and breast cancers[J]. Clinical Cancer Research, 2005, 11(8): 2875–2878. DOI:10.1158/1078-0432.CCR-04-2142 |
| [10] | Itoh N, Semba S, Ito M, et al. Phosphorylation of Akt/PKB is required for suppression of cancer cell apoptosis and tumor progression in human colorectal carcinoma[J]. Cancer, 2002, 94(12): 3127–3134. DOI:10.1002/(ISSN)1097-0142 |
| [11] | Xu R, Qiu M, Han B. The prognostic impact of hypoxia-inducible factor-1 alpha and p-Akt expressions in gastric adenocarcinoma[J]. Journal of Clinical Oncology, 2008, 26(15). |
| [12] | Will M, Qin ACR, Toy W, et al. Rapid induction of apoptosis by PI3K inhibitors is dependent upon their transient inhibition of RAS-ERK signaling[J]. Cancer Discovery, 2014, 4(3): 334–347. DOI:10.1158/2159-8290.CD-13-0611 |
| [13] | Chandarlapaty S, Sawai A, Scaltriti M, et al. AKT inhibition relieves feedback suppression of receptor tyrosine kinase expression and activity[J]. Cancer Cell, 2011, 19(1): 58–71. DOI:10.1016/j.ccr.2010.10.031 |
| [14] | Rodrik-Outmezguine VS, Chandarlapaty S, Pagano NC, et al. mTOR kinase inhibition causes feedback-dependent biphasic regulation of AKT signaling[J]. Cancer Discovery, 2011, 1(3): 248–259. DOI:10.1158/2159-8290.CD-11-0085 |
 2017, Vol. 33
2017, Vol. 33


