溃疡性结肠炎(ulcerative colitis,UC)属于炎症性肠病(inflammatory bowel disease,IBD),是由遗传、免疫、环境和饮食等多方面作用而引起的慢性疾病。其发病机制主要是遗传易感个体肠道共生菌群的宿主免疫应答失调[1]。近年来,UC的发病率逐年上升,严重影响人们的健康。研究表明UC会增加结肠癌的发病风险[2]。流行病学数据显示遗传变异不能完全解释疾病的发病率,表明饮食因素和环境因素等对UC、结肠癌具有重要作用。在IBD成年患者中,近50%患者存在维生素D(vitamin D,VD)缺乏,约11%的患者有严重VD缺乏[5]。研究表明每天多摄入100 IU VD,患UC的风险会下降10%[6]。近年来研究发现VD缺乏与各种自身免疫性疾病的发生、发展有关[7]。VD3代谢途径涉及多种酶反应,大多数VD3由VD结合蛋白或脂蛋白携带到肝脏,在肝脏中经肝细胞25-羟化酶作用生成25-(OH)D3,经肾脏线粒体内1-α羟化酶的作用生成VD的活性形式1, 25-(OH)2D3,发挥生理功能[8]。抗坏血酸(ascorbic acid,AA)是羟化酶的辅助因子,VD3发挥生理功能需要经2次羟化后转化为1, 25-(OH)2D3,羟化酶的激活又需要羟化酶辅助因子AA参与,Cantatore等[9]研究发现,55~71岁女性每日补充150 mg AA,连续补充10 d,血清1, 25-(OH)2D3升高,表明AA在VD3转化为其活性形式的过程中起着重要作用。本文旨在探讨联合应用AA和VD3对豚鼠体内1, 25-(OH)2D3水平和UC的影响。结果报告如下。
1 材料与方法 1.1 主要试剂与仪器维生素D3、抗坏血酸(北京索莱宝公司);抗坏血酸标准品(美国Sigma公司);葡聚糖硫酸钠(dextran sulfate sodium,DSS)(美国MP Biomedicals公司);25-羟基维生素D3[25-(OH)D3]、1, 25-二羟基维生素D3[25-(OH)2D3]、细胞色素2R1(CYP2R1)、细胞色素27B1(CYP27B1)、白细胞介素-6(interleukin-6, IL-6) 和肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)试剂盒(上海BIO SWAMP公司)。酶标仪(美国Bio-Rad公司);高效液相色谱仪(美国Agilent公司);高速台式离心机(德国Eppendorf公司)。
1.2 实验动物与分组32只健康雄性Dunkin-Hartley豚鼠,体重(350 ± 20) g,由北京海淀兴旺实验动物养殖场提供,生产许可证号:SCKY(京)2011-0010。适应性喂养2 W后,随机分为4组,即对照组(120 mg AA+2.8 μg VD3/kg)、模型组(120 mg AA+2.8 μg VD3/kg)、高剂量AA组(240 mg AA+2.8 μg VD3/kg)和低剂量AA组(8 mg AA+2.8 μgVD3/kg),每组8只。将1 mg VD3溶于1 mL无水乙醇中作为母液,采用磷酸盐缓冲液(phosphate buffered solution,PBS)逐级梯度稀释,AA用蒸馏水稀释。采用改良的豚鼠灌胃方法[10]分别灌胃给予AA和VD3溶液,连续7W;除对照组豚鼠饮用蒸馏水外,模型组、高、低剂量AA组豚鼠均自由饮用含3%DSS蒸馏水,造模期间AA和VD3的灌胃剂量不变,连续3 d。采用3%戊巴比妥钠麻醉豚鼠,剖开胸腔,心脏采血3~5 mL,3 000 r/min离心10 min,分离血清;分离结肠、肝脏、肾脏,-80 ℃冻存待测。
1.3 指标与方法 1.3.1 结肠病变评分将结肠沿肠系膜纵轴剪开,用生理盐水清洗内容物后,进行肉眼大体形态评分;根据体重下降率、大便性状和肉眼血便进行疾病活动指数评分(disease activity index,DAI);取病变部位结肠组织,用10%中性福尔马林溶液固定,常规石蜡包埋,苏木素-伊红染色(hematoxylin eosin,HE),显微镜下观察,进行组织病理学评分[11]。
1.3.2 血清中抗坏血酸含量检测采用高效液相色谱-紫外检测法,流动相为30 mmol/L磷酸二氢钾溶液-甲醇(体积比88:12),pH 3.0,流速0.8 mL/min,检测波长243 nm,柱温35 ℃,手动进样,进样量20 μL;血清样品的前处理参考文献[12]方法,准确称取10 mg AA,将其溶于10 mL纯水中,逐级梯度稀释,标准品浓度依次为0.312 5、0.625 0、1.250 0、2.500 0、5.000 0和10.000 0 μg/mL。
1.3.3 血清中25-(OH)D3、1, 25-(OH)2D3含量检测采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA),样品加入量10 μL,酶标仪比色波长450 nm,按照试剂盒说明书操作。
1.3.4 血清中IL-6、TNF-α水平检测采用ELISA法,样品加入量10 μL,酶标仪比色波长450 nm,按照试剂盒说明书操作。
1.3.5 肝脏CYP2R1和肾脏CYP27B1表达水平检测肝脏和肾脏组织各取1~2 g,加入组织重量9倍的PBS,匀浆后3 000 r/min离心10 min,取上清,检测肝脏CYP2R1和肾脏CYP27B1表达量,按照试剂盒说明书操作。
1.4 统计分析数据用表示,采用SPSS 17.0软件进行统计分析,组间比较采用单因素方差分析,检验水准为α=0.05。
2 结果 2.1 豚鼠UC模型建立造模第2天,模型组豚鼠进食量明显减少,体重下降,精神萎靡,目光呆滞,被毛杂乱,部分豚鼠出现弓背、腹泻、粘液便、血便等现象;造模第3天,豚鼠普遍出现粘液便、血便,提示,豚鼠UC模型造模成功。
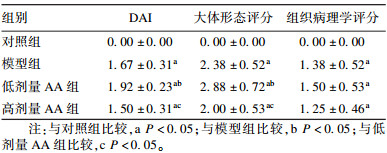
2.2 AA联合VD3对豚鼠UC严重程度影响(表 1、图 1)| 表 1 AA联合VD3对豚鼠UC严重程度影响(分,x±s,n=8) |
|
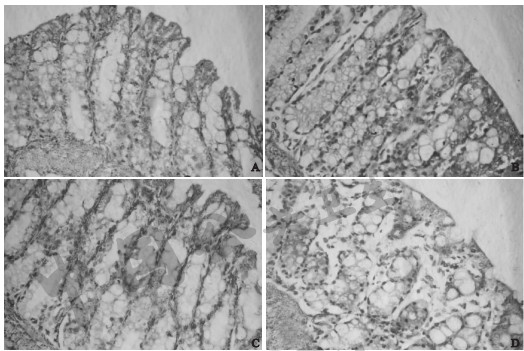
注:A:对照组;B:模型组;C:高剂量AA组;D:低剂量AA组。 图 1 VD3联合AA对豚鼠UC严重程度影响(HE,×400) |
与对照组比较,模型组结肠DAI评分、大体形态评分和组织病理学评分升高;与模型组比较,低剂量AA组豚鼠结肠DAI评分和大体形态评分升高;与低剂量AA组比较,高剂量AA组豚鼠结肠DAI评分和大体形态评分下降,差异均有统计学意义(P < 0.05)。
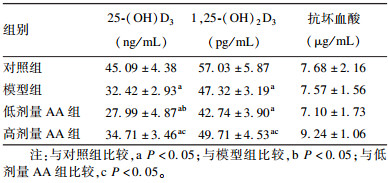
2.3 AA联合VD3对豚鼠血清中25-(OH)D3及1, 25-(OH)2D3水平影响(表 2)与对照组比较,模型组豚鼠血清中25-(OH)D3、1, 25-(OH)2D3水平降低;与模型组比较,低剂量AA组团血清中25-(OH)D3水平降低;与低剂量AA组比较,高剂量AA组豚鼠血清中25-(OH)D3、1, 25-(OH)2D3水平升高,差异均有统计学意义(P < 0.05)。各组豚鼠血清中AA含量无明显差异。
| 表 2 AA联合VD3对豚鼠血清中25-(OH)D3、1, 25-(OH)2D3和AA水平影响( , n=8) |
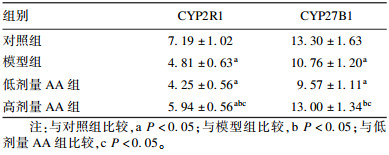
2.4 AA联合VD3对豚鼠肝脏CYP2R1和肾脏CYP27B1表达影响(表 3)
| 表 3 AA联合VD3对豚鼠肝脏中CYP2R1和肾脏中CYP27B1表达影响(ng/mL,x±s,n=8) |
与对照组比较,模型组豚鼠肝脏CYP2R1和肾脏CYP27B1表达降低(P < 0.05);与低剂量AA组比较,高剂量AA组肝脏CYP2R1和肾脏CYP27B1表达升高(P < 0.05)。
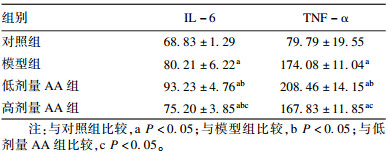
2.5 AA联合VD3对豚鼠血清IL-6和TNF-α水平影响(表 4)| 表 4 AA联合VD3对豚鼠血清中IL-6和TNF-α水平影响(ng/mL,x±s,n=8) |
与对照组比较,模型组豚鼠血清中IL-6和TNF-α水平升高;与模型组比较,低剂量AA组豚鼠血清中IL-6和TNF-α水平升高;与低剂量AA组比较,高剂量AA组豚鼠血清中IL-6和TNF-α水平降低,差异均有统计学意义(P < 0.05)。
3 讨论1, 25-(OH)2D3是VD发挥生理功能的活性形式,在固有免疫应答和适应性免疫应答过程中发挥重要作用。VD活化为1, 25-(OH)2D3需要经过2次羟化,其中CYP2R1、CYP27A1、CYP3A4和CYP2J3是VD-25-羟化酶,参与VD的第一步羟化;CYP27B1和CYP24A1是25-(OH)D-1α-羟化酶,参与VD的第二步羟化,CYP27B1负责完成激素形式1, 25-(OH)2D3的激活,CYP24A1负责1, 25-(OH)2D3的分解[13]。研究表明CYP27B1活性升高,CYP24A1活性降低,能使组织中1, 25-(OH)2D3水平升高[14]。主要的VD-25-羟化酶可能是CYP2R1和CYP27A1,CYP2R1具有VD高亲和力[15]。CYP27B1是线粒体细胞色素P450催化VD激活的最后一步[16],25-(OH)D3活化为1, 25-(OH)2D3的过程中必须有CYP27B1参与[8]。AA是羟化酶的辅助因子,VD在活化为1, 25-(OH)2D3的过程中需要羟化酶参与,羟化酶激活又需要羟化酶辅助因子AA参与。本研究结果显示,低剂量AA组豚鼠肝脏CYP2R1和肾脏CYP27B1水平低于模型组,高剂量AA组高于低剂量AA组比较。提示,AA参与了肝脏CYP2R1和肾脏CYP27B1的激活和VD的活化。
IL-6在实验性结肠炎、结肠癌和肿瘤发生中具有重要作用[17]。TNF-α是一种促炎性细胞因子,对多种细胞类型具有生物学效应,在多种慢性炎症性疾病的发病机制中起着决定性作用[18]。研究表明1, 25-(OH)2D3能够抑制人类单核细胞产生炎性细胞因子IL-6和TNF-α[19],1, 25-(OH)2D3能够改善DSS诱导的动物实验性UC。本研究结果表明在适宜范围内AA水平越高,豚鼠血清中1, 25-(OH)2D3含量越高,结肠DAI评分、大体形态评分、组织病理学评分、血清IL-6和TNF-α的水平越低。提示,AA可能参与VD3活化,AA与VD3联合应用能够缓解豚鼠UC炎症程度。
本研究采用豚鼠UC模型主要是考虑到豚鼠与人体自身均不能合成AA,依赖于食物的摄入[21],采用豚鼠作为动物模型能够更加真实地模拟人体状态。本研究对UC模型豚鼠进行AA和VD3的联合干预,克服了单一营养素的不足和目前临床药物干预的缺陷;本研究采用改良的豚鼠灌胃方法进行干预,既避免了对豚鼠食道的损伤,又克服了因进食饲料量不同而导致摄入的干预物剂量不准确的缺点,能够更加真实地反应AA和VD3联合应用对豚鼠UC的影响。但AA在多大程度上参与了VD3的活化,1, 25-(OH)2D3在多大程度上影响到UC的发生发展,尚需进一步研究证实。
| [1] | Khor B, Gardet A, Xavier RJ. Genetics and pathogenesis of inflammatory bowel disease[J]. Nature, 1989, 27(10): 614–618. |
| [2] | Kojecky V, Adamikova A, Klimek P. Vitamin D supplementation in inflammatory bowel disease:the role of dosage and patient compliance[J]. Bratislavske Lekarske Listy, 2016, 117(3): 148–151. |
| [3] | Ananthakrishnan AN. Environmental triggers for inflammatory bowel disease[J]. Curr Gastroenterol Rep, 2013, 15(1): 302. DOI:10.1007/s11894-012-0302-4 |
| [4] | 袁平, 林修全, 陈铁晖, 等. 福建省结直肠癌高、低发地区甘薯摄入水平及影响因素分析[J]. 中国公共卫生, 2016, 32(11): 1501–1505. DOI:10.11847/zgggws2016-32-11-14 |
| [5] | Ulitsky A, Ananthakrishnan AN, Naik A, et al. Vitamin D deficiency in patients with inflammatory bowel disease:association with disease activity and quality of life[J]. J Parenter Enteral Nutr, 2011, 35(3): 308–316. DOI:10.1177/0148607110381267 |
| [6] | Ananthakrishnan AN, Khalili H, Higuchi LM, et al. Higher predicted vitamin D status is associated with reduced risk of Crohn's disease[J]. Gastroenteroloy, 2012, 142(3): 482–489. DOI:10.1053/j.gastro.2011.11.040 |
| [7] | Greiller CL, MartineauAR. Modulation of the immune response torespiratory viruses by vitamin D[J]. Nutrients, 2015, 7(6): 4240–4270. DOI:10.3390/nu7064240 |
| [8] | Sheng L, Xue Y, He X, et al. Effects of repeated administration of rifampicin and isoniazid on vitamin D metabolism in mice[J]. Steroids, 2015, 104: 203–207. DOI:10.1016/j.steroids.2015.10.004 |
| [9] | Cantatore FP, Loperfido MC, Magli DM, et al. The importance of vitamin C for hydroxylation of vitamin D3 to 1, 25(OH)2D3 in man[J]. Clinical Rheumatology, 1991, 10(2): 162–167. DOI:10.1007/BF02207657 |
| [10] | 丛宁, 韩朝, 迟放鲁, 等. 改良的豚鼠灌胃给药方法[J]. 复旦学报, 2010, 37(2): 232–235. |
| [11] | 张小艳, 杨雯, 张英, 等. 1, 25-(OH)2D3和全反式视黄酸联合应用对溃疡性结肠炎小鼠TREG细胞Foxp3表达的影响[J]. 营养学报, 2016, 38(2): 157–161. |
| [12] | 刁娟娟, 田兰, 孙炜, 等. 高效液相色谱法测定人血清中维生素A、E、C的含量[J]. 化学通报, 2010, 9: 826–831. |
| [13] | Prosser DE, Jones G. Enzymes involved in the activation andinactivation of vitamin D[J]. Trends Biochem Sci, 2004, 29(12): 664–673. DOI:10.1016/j.tibs.2004.10.005 |
| [14] | Hiblerka EA, Klimentidis YC, Jurutka PW, et al. CYP24A1 and CYP27B1 polymorphisms, concentrations of vitamin D metabolites, and odds of colorectal adenomarecurrence[J]. Nutr Cancer, 2015, 67(7): 1131–1141. DOI:10.1080/01635581.2015.1068818 |
| [15] | Slominski AT, Kim TK, Shehabi HZ, et al. In vivo production of novel vitamin D2 hydroxy-derivatives by human placentas, epidermal keratinocytes, Caco-2 colon cells and the adrenal gland[J]. Mol Cell Endocrinol, 2014, 383(1-2): 181–192. DOI:10.1016/j.mce.2013.12.012 |
| [16] | Tang EK, Chen J, Janjetovic Z, et al. Hydroxylation of CYP11A1-derived products of vitamin D3 metabolism by human and mouse CYP27B1[J]. Drug Metab Dispos, 2013, 41(5): 1112–1124. DOI:10.1124/dmd.113.050955 |
| [17] | Brighenti E, Calabrese C, Liguori G, et al. Interleukin 6 downregulates p53 expression and activity bystimulating ribosome biogenesis:a new pathway connecting inflammation to cancer[J]. Oncogene, 2014, 33(35): 4396–4406. DOI:10.1038/onc.2014.1 |
| [18] | Szondy Z, Pallai A. Transmembrane TNF-alpha reverse signaling leading to TGF-beta production is selectively activated by TNF targeting molecules:therapeutic implications[J]. Pharmacological Research, 2017, 115: 124–132. DOI:10.1016/j.phrs.2016.11.025 |
| [19] | Zhang Y, Leung DY, Richers BN, et al. Vitamin D inhibits monocyte/macrophage proinflammatory cytokine production by targeting MAPK phosphatase-1[J]. J Immunol, 2012, 188(5): 2127–2135. DOI:10.4049/jimmunol.1102412 |
| [20] | 李春艳, 王蕾, 张英, 等. 维生素D缺乏加剧细菌诱导的小鼠结肠炎的研究[J]. 营养学报, 2014, 36(2): 141–144. |
| [21] | Lachapelle MY, Drouin G.. Inactivation dates of the human and guinea pig vitamin C genes[J]. Genetica, 2011, 139(2): 199–207. DOI:10.1007/s10709-010-9537-x |
 2017, Vol. 33
2017, Vol. 33