2. 黑龙江中医药大学药学院
蓬子菜 (Galium verum L.) 是茜草科(Rubiaceae)拉拉藤属 (Galium),药用植物蓬子菜为干燥全草,其主要成分为黄酮类、蒽醌类、环烯醚萜类,有机酸及其他成分[1]。研究表明,黄酮类化合物具有抑制肿瘤细胞的转移、扩散、增殖并诱导其凋亡的作用[2-4]。本研究拟观察蓬子菜总黄酮 (flavone from Galium verum L,FGVL) 对人急性早幼粒细胞白血病细胞株 (NB4) 凋亡诱导作用,旨在为临床寻找抗白血病的新药提供依据,结果报告如下。
1 材料与方法 1.1 主要试剂与仪器FGVL纯度为75%,由黑龙江省中医药大学馈赠;NB4细胞 (黑龙江省血液研究所);胎牛血清 (美国Hyclone公司);1640培养基 (美国Gibco公司);Hoechst33258、核糖核酸酶A (江苏碧云天生物技术研究所);碘化丙啶PI (北京索莱宝科技有限公司);细胞凋亡试剂盒 (美国BD公司);反转录及PCR试剂盒 (日本TakaRa公司)。
CKX41倒置显微镜、BX43荧光显微镜 (日本Olympus公司);PCR System 9700仪 (美国ABI公司);Nano Drop 2000c微量紫外分光光度计 (美国Thermo Scientific公司);5415R低温高速离心机 (德国Eppendorf公司);EC3凝胶成像系统 (美国UVP公司);LSRFortessa流式细胞仪 (美国BD公司)。
1.2 细胞培养与分组NB4细胞在含有10%胎牛血清的1640培养基中,于37 ℃、5%CO2培养箱中培养,2~3 d换液、传代,取对数生长期细胞用于实验。NB4细胞置于6孔板,每孔2×106个细胞,分别加入0(对照)、50、100、200 μg/mL FGVL,每孔2 mL,培养24、48 h,收集细胞用于各指标检测;每组设3个复孔。
1.3 指标与方法 1.3.1 细胞形态学观察采用Hoechst 33258染色法,收集细胞,于离心管中静置30 min,待细胞沉淀在离心管底部,吸取20 μL细胞于载玻片上,取20 μL Hoechst 33258染色液与细胞混匀,荧光显微镜下观察、拍照。在不同视野下计数200个细胞,计数凋亡细胞数。
1.3.2 细胞周期检测采用流式细胞术,收集细胞,500 g离心10 min,磷酸盐缓冲液 (phosphate buffered saline,PBS) 洗涤1次;用300 μL PBS重悬细胞,加700 μL冷无水乙醇,-20 ℃固定24 h。收集细胞,PBS洗涤1次。450 μL PBS重悬细胞,加50 μL核糖核酸酶A (2.5 mg/mL),4 ℃孵育30 min。取50 μL propidium iodide (PI) 加入细胞悬液,4 ℃避光孵育30 min,流式细胞仪检测细胞周期。
1.3.3 细胞凋亡检测采用流式细胞术,收集细胞,500 g离心10 min,用冷PBS洗涤2次;用1×binding buffer调整细胞密度为1×106个/mL;取100 μL细胞悬液置于5 mL离心管,分别加入5 μL fluorescein isothiocyanate (FITC)/PI;避光置15 min (25 ℃);加入400 μL 1×binding buffer,流式细胞仪计数细胞凋亡率。
1.3.4 凋亡相关基因表达检测采用逆转录聚合酶链式反应 (reverse transcriptase-PCR, RT-PCR),收集细胞,按照试剂盒提取总RNA,逆转录合成cDNA,进行PCR实验:β-actin (256 bp):上游引物:5′-CTCGCTGTCCACCTTCCA-3′,下游引物:5′-GCT-GTCACCTTCACCGTT-3′,反应条件:94 ℃预变性2 min,94 ℃变性45 s,55 ℃退火1 min,72 ℃延伸1 min,共35个循环,最后72 ℃延伸10 min;Mel-18(281 bp):上游引物:5′-AGAAGGGGGCTCTGAGTGAT-3′,下游引物:5′-GATGTAGGCGATGTCCATGA-3′;Bmi-1(359 bp):上游引物:5′-AATCTAAGGAGGAGGTGA-3′,下游引物:5′-CAAACAAGAAGAGGTGGA-3′;Sall4(260 bp):上游引物:5′-ATCGAGAACACCATGGCTCTG-3′,下游引物:5′-GACTGGGAGCCATCCATCTTG-3′;反应条件:94 ℃预变性5 min;94 ℃变性1 min,57 ℃退火30 s,72℃延伸30 s,共35个循环;最后72 ℃延伸10 min。1.5%琼脂糖凝胶电泳,采用凝胶成像系统记录样品条带,以Image J进行产物灰度扫描,计算各基因相对表达量。
1.4 统计分析计量数据用表示,采用SAS 9.13软件进行统计分析,组间比较采用方差分析,组间两两比较采用Dunnett-t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 FGVL对NB4细胞形态学影响 (图 1)

|
注:A.对照;B、C、D:50、100、200 μmol/L FGVL组。 图 1 FGVL对NB4细胞形态学影响 (作用48 h) |
处理24 h时,对照组和50 μg/mL FGVL组NB4细胞呈均匀蓝色荧光,细胞呈圆形,大小一致,凋亡细胞少见;100、200 μg/mL FGVL组大部分NB4细胞处于凋亡早、中期,细胞染色质高度凝聚,呈波纹状或折缝样,内部密度不均、细胞染色质高度凝聚、边缘化,只有少部分细胞可见细胞核裂解为碎块及凋亡小体。处理48 h后,各剂量FGVL组NB4细胞均出现明显凋亡现象。
2.2 FGVL对NB4细胞周期影响对照组、50、100、200 μg/mL FGVL组NB4细胞G0/G1期细胞比例分别为49.97%、43.92%、37.26%、29.15%,S期细胞比例分别为47.07%、54.16%、62.23%、70.46%;与对照组比较,FGVL各剂量组NB4细胞G0/G1期细胞比例减少,S期细胞比例增多。提示FGVL改变了NB4细胞周期,使NB4细胞阻滞于S期。
2.3 FGVL对NB4细胞凋亡影响对照组、50、100、200 μg/mL FGVL组NB4细胞凋亡率分别为2.3%、9.3%、13%、20.4%;与对照组比较,FGVL组NB4细胞凋亡率明显升高 (P < 0.05),呈剂量效应关系。
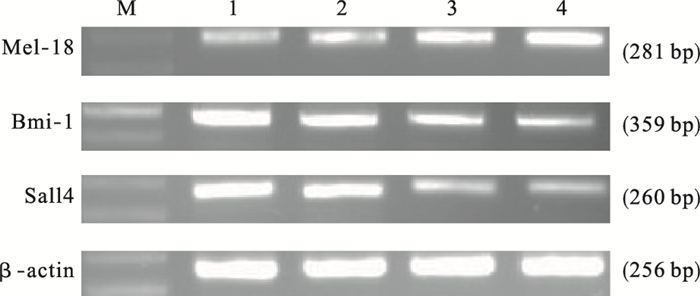
2.4 FGVL对NB4细胞凋亡相关基因表达影响 (图 2、表 1)
|
注:M.Marker;1:对照;2~4:50、100、200 μg/mL FGVL组。 图 2 FGVL对NB4细胞凋亡相关基因表达影响 |
| 表 1 FGVL对NB4细胞凋亡相关基因表达影响 (x±s,n=3) |
与对照组比较,100、200 μg/mL FGVL组NB4细胞Mel-18 mRNA表达明显升高 (P < 0.05),各剂量FGVL组NB4细胞Sall4、Bmi-1 mRNA表达明显下降 (P < 0.05),并呈剂量效应关系。
3 讨论细胞增殖、分化、凋亡失控是肿瘤细胞最显著的特征,诱导细胞凋亡在肿瘤治疗中具有重要作用。研究显示,黄酮类化合物能够抑制肿瘤细胞的增殖,诱导细胞凋亡,实现抗肿瘤作用[5-6]。细胞周期是指正常连续分裂的细胞从前一次有丝分裂结束到下一次有丝分裂完成所经历的连续动态过程,可分为G0期 (静息期)、G1期 (DNA合成前期)、S期 (DNA合成期)、G2期 (DNA合成后期)、M期 (有丝分裂期),存在2个主要限制点,即G1/S和G2/M限制点。细胞周期阻滞与细胞凋亡密切相关,许多中药或其有效成分可阻滞肿瘤细胞周期于G1期、S期或G2/M期,抑制癌细胞增殖,并诱导凋亡,从而发挥抗肿瘤作用[7-8]。本研究结果显示,NB4细胞经过FGVL处理24 h后,即出现凋亡现象,细胞凋亡率明显高于对照组;G0/G1期细胞数量减少,S期细胞数量明显增多。提示,FGVL可阻滞NB4细胞于S期,影响DNA合成与复制,从而阻止细胞向G2/M期过渡[9]。
细胞凋亡是受多种基因控制的细胞自主性死亡方式,是一种主动、程序性的细胞固有生物学过程,涉及一系列基因的激活、表达以及调控等作用[10]。Bmi-1是多梳基因 (polycomb group genes, PcG) 家族的转录抑制因子,通过多种途径参与细胞调控[11]。Bmi-1高表达时可以减弱细胞周期素依赖性激酶 (CDK4) 的抑制蛋白基因INK4a的可变阅读框基因 (P14ARF) 对鼠双微粒体基因2(mdm2) 的抑制作用,从而对其介导的泛素依赖的P53降解增多,阻止细胞周期停滞和细胞凋亡[12]。有研究表明,Mel-18和Bmi-1基因结构高度同源,在转录水平上通过抑制c-myc癌基因的表达下调Bmi-1基因,进而达到抑制肿瘤细胞增殖的目的[13];同源异型基因Sall4在急性白血病细胞中异常表达,发挥癌基因作用。Sall4基因通过参与Wnt信号、细胞凋亡、第10染色体同源丢失性磷酸酶-张力蛋白基因 (phosphatase and tensin homologue deleted on chromosome 10, PTEN)、核因子-κB (nuclear factor κ, NF-κB) 和P53等重要信号传导途径,调控细胞凋亡[14];Bmi-1是Sall4的直接靶基因,Sall4能与Bmi-1基因的启动子相结合,启动转录并且上调内源性Bmi-1基因的表达水平,阻碍细胞凋亡[15]。本研究结果显示,FGVL可上调Mel-18基因表达而降低Bmi-1与Sall4表达。提示,调节凋亡相关基因Mel-18、Bmi-1与Sall4表达可能是FGVL诱导NB4细胞凋亡的重要机制之一。
| [1] | 于晓敏, 卢卫红, 史国玉, 等. 蓬子菜化学成分及其药理活性研究进展[J]. 中医药信息, 2004, 21(3) : 21–22. |
| [2] | Yao N, Chen CY, Wu CY, et al. Novel flavonoids with antiproliferative activities against breast cancer cells[J]. Journal of Medicinal Chemistry, 2011, 54(13) : 4339–4349. DOI:10.1021/jm101440r |
| [3] | Hsieh MJ, Lin CW, Yang SF, et al. Glabridin inhibits migration and invasion by transcriptional inhibition of matrix metalloproteinase 9 through modulation of NF-κB and AP-1 activity in human liver cancer cells[J]. British Journal of Pharmacology, 2014, 171(12) : 3037–3050. DOI:10.1111/bph.2014.171.issue-12 |
| [4] | 董晶, 马英丽, 李海霞, 等. 蓬子菜总黄酮诱导NB4细胞株凋亡作用[J]. 中国公共卫生, 2014, 30(7) : 906–909. |
| [5] | Kanadaswami C, Lee LT, Lee PPH, et al. The antitumor activities of flavonoids[J]. In Vivo, 2005, 19(5) : 895–909. |
| [6] | 李海霞, 马英丽, 史灵恩, 等. 蓬子菜黄酮类化合物对人肝癌HepG2细胞增殖及凋亡的机制研究[J]. 中草药, 2013, 44(10) : 1290–1294. |
| [7] | 庞月华, 张新平, 冯义伯, 等. 细胞周期及其调控研究进展[J]. 新疆医科大学学报, 2005, 28(6) : 596–598. |
| [8] | 周曼, 周春祥. 中药对肿瘤细胞周期影响的研究进展[J]. 环球中医药, 2014, 7(10) : 813–816. |
| [9] | Shimada M, Nakanishi M. DNA damage checkpoints and cancer[J]. Journal of Molecular Histology, 2006, 37(5-7) : 253–260. DOI:10.1007/s10735-006-9039-4 |
| [10] | 李文艺. 细胞凋亡研究进展[J]. 畜牧与饲料科学, 2011, 31(11) : 17–19. |
| [11] | 苏进, 许新华. Bmi-基因在恶性肿瘤中的研究进展[J]. 广东医学, 2010, 31(18) : 2454–2455. |
| [12] | Spike BT, Macleod KF. The Rb tumor suppressor in stress responses and hematopoietic homeostasis[J]. Cell Cycle, 2005, 4(1) : 42–45. DOI:10.4161/cc.4.1.1337 |
| [13] | Guo WJ, Datta S, Band V, et al. Mel-18, a polycomb group protein, regulates cell proliferation and senescence via transcriptional repression of Bmi-1 and c-Myc oncoproteins[J]. Molecular Biology of the Cell, 2007, 18(2) : 536–546. |
| [14] | Yang J, Chai L, Gao C, et al. SALL4 is a key regulator of survival and apoptosis in human leukemic cells[J]. Blood, 2008, 112(3) : 805–813. DOI:10.1182/blood-2007-11-126326 |
| [15] | Yang J, Chai L, Liu F, et al. Bmi-1 is a target gene for SALL4 in hematopoietic and leukemic cells[J]. Proceedings of the National Academy of Sciences, 2007, 104(25) : 10494–10499. DOI:10.1073/pnas.0704001104 |
 2017, Vol. 33
2017, Vol. 33


