2. 中国医科大学公共卫生学院地球化学性疾病研究室;
3. 中国医科大学公共卫生学院环境与慢性病研究中心
饮水砷污染是地方性饮水型砷中毒的主要原因,目前是世界范围内严重的公共卫生问题。砷是国际肿瘤研究机构 (International Agency for Research on Cancer, IARC) 确定的人类致癌物,流行病调查研究表明慢性砷暴露可引起膀胱、皮肤和肺等多器官肿瘤[1]。研究表明氧化应激是砷的致癌机制之一,砷及其甲基化产物可诱导细胞内活性氧自由基 (reactive oxygen species,ROS) 生成增多,ROS攻击生物大分子,导致DNA损伤、miRNA修饰改变、蛋白分子结构改变以及脂质过氧化等与癌症发生密切相关的损伤机制[2]。砷可以通过诱导SV-HUC-1细胞内ROS产生,造成人膀胱细胞的损伤[3]。核因子相关因子2(nuclear factor-erythroid 2-related factor 2, NRF2) 是一种核转录因子,其调控的下游基因主要包括抗氧化酶类和II相解毒酶,NRF2介导的抗氧化反应是正常细胞抵御外源性和内源性氧化应激的重要系统,在维持细胞氧化还原稳态、抑制氧化损伤、调节细胞增殖和分化等方面起关键作用[4]。NRF2正常状态下与伴侣蛋白 (Kelch-like epichlorohydrin-associated protein 1, KEAP1) 偶联被锚定在胞浆内,导致其泛素化进而被蛋白酶降解。当细胞受到氧化物或亲电子物质刺激后,NRF2与KEAP1解离而被活化,继而入核识别并结合于下游靶基因启动区的抗氧化反应元件 (antioxidant response element, ARE),启动其表达。大量抗氧化酶,如血红素加氧酶 (heme oxygenase-1, HO1)、超氧化物歧化酶 (superoxide dismutase, SOD) 及II相解毒酶,如醌氧化还原酶[NAD (P) H-quinone oxidoreductase 1, NQO1]、谷胱甘肽硫转移酶 (glutathione S-transferase, GSTs) 均受NRF2调控[5]。因此,NRF2-ARE信号传导通路是细胞对抗氧化损伤和药物毒性的重要防御机制。本研究以亚砷酸钠 (sodium arsenite,NaAsO2) 处理人膀胱上皮永生化细胞系SV-HUC-1细胞,通过观察细胞内NRF2通路相关蛋白表达水平变化,探讨SV-HUC-1细胞对抗氧化损伤作用机制。结果报告如下。
1 材料与方法 1.1 主要仪器与试剂超净工作台 (江苏苏净集团公司);二氧化碳细胞培养箱 (荷兰Heraeus公司);酶标仪 (芬兰Labsystems公司);超速低温离心机 (美国Sigma公司)。NaAsO2(分析纯)、F12K培养基、蛋白酶抑制剂、磷酸酶抑制剂 (美国Sigma公司);胎牛血清 (德国Biochrom公司);胰蛋白酶 (美国Hyclone公司);NRF2、NQO1、HO1、GAPDH和actin抗体 (美国Santa Cruz公司)。
1.2 细胞培养与处理SV-HUC-1细胞[美国典型菌种保藏中心 (American Type Culture Center, ATCC)],常规培养于F12K完全培养基 (10%胎牛血清,100 U/mL青霉素,100 μg/mL链霉素)。细胞以5×105个/mL密度接种至培养板或培养皿,16 h后待细胞贴壁并生长至80%融合后,进行细胞染毒和相关实验。(1) 时间效应实验:以4 μmol/L NaAsO2分别处理SV-HUC-1细胞0(对照组)、4、8、16、24 h后,收集细胞进行实验;(2) 剂量效应实验:分别设对照组和NaAsO2处理组 (1、2、4、8、10 μmol/L),染毒处理16 h后,收集细胞进行各项指标检测,实验重复3次。
1.3 NRF2通路蛋白表达检测采用Western blot免疫印迹法,砷染毒结束后,弃培养液,预冷的磷酸盐缓冲液 (phosphate buffered saline, PBS) 洗2次,加入细胞裂解液,用细胞刮刮取细胞,4 ℃超声裂解细胞,4 ℃、12 000 g离心5 min,收集上清液用于细胞蛋白检测。所有蛋白样品储存在-80 ℃直至使用。蛋白浓度测定应用Bradford法;蛋白质样品通过聚丙烯酰胺凝胶电泳 (sodium dodecyl-polyacryl gradient gel electrophoresis, SDS-PAGE) 分离 (100 V)1.5 h,从正极到负极按照海绵-厚滤纸-硝酸纤维素膜-凝胶-厚滤纸-海绵的顺序制备三明治,在转移电泳槽中将分离胶中的蛋白湿转印至硝酸纤维素膜上 (100 V,1 h);将转印后的硝酸纤维素膜封闭1 h后,加入相应一抗NRF2、NQO1、HO1、甘油醛-3-磷酸脱氢酶 (glyceraldehyde 3-phosphate dehydrogenase, GAPDH) 和actin (1:1 000)4 ℃孵育过夜;第2 d,用辣根过氧化物酶偶联抗鼠、抗兔或抗羊的二抗室温孵育1 h后,用PBST洗3次;加入底物,应用成像系统扫描发光条带,并应用Image J软件分析条带灰度值,以内参 (GAPDH或actin) 为参比蛋白,测定目的蛋白相对表达量。
1.4 统计分析采用SPSS 13.0软件进行统计分析,实验数据以均数x±s表示,组间比较采用单因素方差分析,组间两两比较采用最小显著性差异法t检验,以P < 0.05为差异有统计学意义。
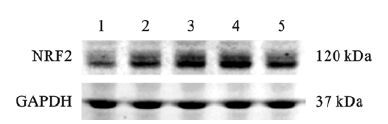
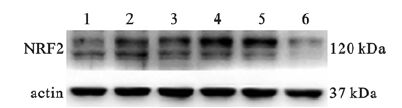
2 结果 2.1 亚砷酸钠对SV-HUC-1细胞转录因子NRF2影响(图 1、2)4 μmol/L NaAsO2处理0(对照组)、4、8、16、24 h时,SV-HUC-1细胞内NRF2蛋白表达分别为 (0.68±0.03)、(0.93±0.01)、(1.06±0.08)、(1.17±0.10)、(0.95±0.06);与对照组比较,处理4 h时,染砷组SV-HUC-1细胞内NRF2蛋白表达已呈升高趋势;在处理16 h时,SV-HUC-1细胞内NRF2蛋白表达水平最高,差异有统计学意义 (P < 0.05)。对照组、1、2、4、8、10 μmol/L NaAsO2处理组SV-HUC-1细胞内NRF2蛋白表达分别为 (0.86±0.05)(1.03±0.05)、(0.95±0.06)、(1.12±0.01)、(1.16±0.11)、(0.61±0.06);与对照组比较,4、8 μmol/L NaAsO2处理组SV-HUC-1细胞内NRF2蛋白表达升高,10 μmol/L NaAsO2处理组SV-HUC-1细胞内NRF2蛋白表达降低,差异均有统计学意义 (均P < 0.05)。
|
注:1:对照组;2~5:NaAsO2处理4、8、16、24 h组。 图 1 亚砷酸钠对SV-HUC-1细胞内NRF2蛋白表达影响 (时间效应) |
|
注:1:对照组;2~6:1、2、4、8、10 μmol/L NaAsO2处理组。 图 2 亚砷酸钠对SV-HUC-1细胞内NRF2蛋白表达影响 (剂量效应) |
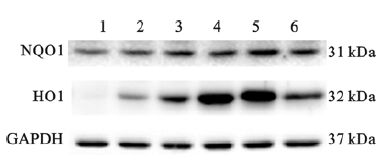
2.2 亚砷酸钠对SV-HUC-1细胞内NQO1和HO1蛋白表达影响(图 3,表 1)
与对照组比较,随着染砷剂量增加,SV-HUC-1细胞内NQO1和HO1蛋白表达水平升高,差异均有统计学意义 (均P < 0.05)。
|
注:1:对照组;2~6:1、2、4、8、10 μmol/L NaAsO2处理组。 图 3 亚砷酸钠对SV-HUC-1细胞内NQO1和HO1蛋白表达影响 |
| 表 1 亚砷酸钠对SV-HUC-1细胞内NQO1和HO1蛋白表达影响 (x±s,n=3) |
3 讨论
研究表明,摄入高砷水导致膀胱癌危险性明显升高[6-9]。SV-HUC-1细胞是由猿猴空泡病毒40转染至1名11岁男孩的泌尿道上皮细胞而建立起来的永生化细胞系,其分化特性与正常细胞相似,培养简单,可无限传代,却不属于肿瘤细胞。该细胞是研究砷致膀胱损伤或肿瘤机制的理想模型[10]。
活性氧可直接或间接地改变生物大分子 (DNA、蛋白质和脂质等) 生理功能,导致细胞发生氧化损伤,同时激活细胞氧化应激敏感的信号途径。前期研究结果显示,NaAsO2染毒能够诱导SV-HUC-1细胞内ROS产生,提示砷可引起细胞氧化应激[3, 11]。砷可引起细胞氧化应激,同时氧化应激能够诱导细胞内抗氧化系统表达增强,而核转录因子NRF2对结构型和诱导型抗氧化反应相关基因的表达起到中枢调控作用。砷暴露直接导致KEAP1的空间构象改变,进而NRF2和KEAP1分离,NRF2转移入核,启动下游靶基因,如:NQO1、HO1[12-13]。研究表明,砷暴露能够诱导机体和细胞处于氧化应激状态,同时活化NRF2及诱导其下游抗氧化酶和II相解毒酶的表达,维持细胞内氧化还原状态,保护细胞免受氧化损伤[14]。NQO1是体内一种重要的Ⅱ相解毒酶,NQO1以NAD (P) H为受体,可将NADH或NADPH的电子传递给醌类及其衍生物,发生电子还原反应,生成低毒的氢醌类化合物,此反应无半醌及自由基等氧化产物形成,避免了对细胞的氧化损伤。HO1蛋白是热休克蛋白中的一种,在正常组织中表达甚微,只有在氧化应激刺激情况下大量产生,增加机体抗氧化能力,维持机体生存;HO1可以降低组织对氧化应激的敏感性,减少细胞损伤和凋亡,同时还可以增强机体的免疫能力。本研究结果也显示,砷暴露可诱导SV-HUC-1细胞蛋白中NRF2含量升高,同时也发现NRF2下游靶蛋白NQO1和HO1表达升高,与已有研究结果一致[15]。提示砷染毒可致SV-HUC-1细胞氧化应激损伤,同时诱导细胞中NRF2通路活化。
| [1] | International Agency for Research on Cancer.Some drinking-water disinfectants and contaminants, including arsenic.IARC monographs on the evaluation of carcinogenic risks to humans[R].Geneva:International Agency for Research on Cancer, 2004, 84:1-477. |
| [2] | Shi H, Shi X, Liu KJ. Oxidative mechanism of arsenic toxicity and carcinogenesis[J]. Molecular and Cellular Biochemistry, 2004, 255 : 67–78. DOI:10.1023/B:MCBI.0000007262.26044.e8 |
| [3] | Wang H, Xi S, Xu Y, et al. Sodium arsenite induces cyclooxygenase-2 expression in human uroepithelial cells through MAPK pathway activation and reactive oxygen species induction[J]. Toxicology in vitro:An International Journal Published in Association with BIBRA, 2013, 27 : 1043–1048. DOI:10.1016/j.tiv.2013.01.012 |
| [4] | Pi J, Zhang Q, Fu J, et al. ROS signaling, oxidative stress and Nrf2 in pancreatic beta-cell function[J]. Toxicol Appl Pharmacol, 2010, 244 : 77–83. DOI:10.1016/j.taap.2009.05.025 |
| [5] | 朱佳玉, 邓宇, 徐斌, 等. 锰对小鼠黑质内活性氧及Nrf2信号通路影响[J]. 中国公共卫生, 2014, 30(4) : 460–462. |
| [6] | Steinmaus C, Bates MN, Yuan Y, et al. Arsenic methylation and bladder cancer risk in case-control studies in Argentina and the United States[J]. J Occup Environ Med, 2006, 48 : 478–488. DOI:10.1097/01.jom.0000200982.28276.70 |
| [7] | Smith AH, Goycolea M, Haque R, et al. Marked increase in bladder and lung cancer mortality in a region of Northern Chile due to arsenic in drinking water[J]. Am J Epidemiol, 1998, 147 : 660–669. DOI:10.1093/oxfordjournals.aje.a009507 |
| [8] | Hopenhayn-Rich C, Biggs ML, Fuchs A, et al. Bladder cancer mortality associated with arsenic in drinking water in Argentina[J]. Epi-demiology, 1996, 7 : 117–124. |
| [9] | Chiou HY, Hsueh YM, Liaw KF, et al. Incidence of internal cancers and ingested inorganic arsenic:a seven-year follow-up study in Taiwan[J]. Cancer Res, 1995, 55 : 1296–1300. |
| [10] | Chai CY, Huang YC, Hung WC, et al. Arsenic salt-induced DNA damage and expression of mutant p53 and COX-2 proteins in SV-40 immortalized human uroepithelial cells[J]. Mutagenesis, 2007, 22 : 403–408. DOI:10.1093/mutage/gem035 |
| [11] | 薛鹏, 席淑华, 张新玉. 亚砷酸钠致SV-HUC-1细胞氧化应激作用的研究[J]. 环境与健康杂志, 2009, 26(12) : 1053–1055. |
| [12] | Fu J, Woods CG, Yehuda-Shnaidman E, et al. Low-level arsenic impairs glucose-stimulated insulin secretion in pancreatic Beta cells:involvement of cellular adaptive response to oxidative stress[J]. Environ Health Perspect, 118 : 864–870. DOI:10.1289/ehp.0901608 |
| [13] | Zhang DD, Lo SC, Cross JV, et al. Keap1 is a redox-regulated substrate adaptor protein for a Cul3-dependent ubiquitin ligase complex[J]. Molecular and Cellular Biology, 2004, 24 : 10941–10953. DOI:10.1128/MCB.24.24.10941-10953.2004 |
| [14] | 刘丹, 李冰, 董丹丹, 等. 无机砷对肝细胞转录因子Nrf2及其调控蛋白表达影响[J]. 中国公共卫生, 2012, 28(9) : 1188–1190. |
| [15] | Li B, Li X, Zhu B, et al. Sodium arsenite induced reactive oxygen species generation, nuclear factor (erythroid-2 related) factor 2 activation, heme oxygenase-1 expression, and glutathione elevation in Chang human hepatocytes[J]. Environmental Toxicology, 2013, 28 : 401–410. DOI:10.1002/tox.20731 |
 2017, Vol. 33
2017, Vol. 33


