胰岛素抵抗是肥胖的一个重要特征,肥胖相关的胰岛素抵抗是2型糖尿病等多种疾病起始进程的早期事件。研究表明,肥胖和2型糖尿病患者呈现系统低度炎症,而低度炎症状态可能是导致胰岛素抵抗的一个重要原因[1]。Toll样受体(Toll-like receptors,TLRs)属于天然免疫中的模式识别受体,能够识别微生物进化过程中的保守结构即病原相关分子模式。TLR4为TLRs家族的成员之一,可表达于多种细胞中,包括免疫细胞和内皮细胞、上皮细胞等。脂多糖是其最主要的配体之一,在细胞外,相应配体与TLR4结合,依次活化髓样分化因子88(myeloid differentiation factor88,MyD88)、白介素-1(interleukin-1,IL-1)受体相关激酶(IL-1 receptor-associated kinase,IRAK)、肿瘤坏死因子受体相关因子6(tumor necrosis factor-receptor association factor 6,TRAF6),TRAF6再活化核因子-κB(nuclear factor,NF-κB)抑制物激酶(inhibitor of NF-κB kinases,IKKs),进而激活NF-κB和丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)信号转导通路,诱导产生炎性细胞因子,启动对病原生物的应答[2]。研究发现,TLR4信号不仅在应答病原生物入侵的天然免疫中发挥作用,还参与许多无菌的慢性炎症性疾病[3-4]。近期有研究发现,来源于营养和代谢的饱和非酯化脂肪酸(non esterified fatty acid,NEFA)可能也参与了TLR4的活化[5]。流行病学研究发现,肥胖相关的胰岛素抵抗在心血管疾病中的发生率不断攀升[6],胰岛素抵抗增加了冠状动脉粥样硬化性心脏病的风险,可能与胰岛素抵抗导致内皮细胞功能异常有关[7-8]。本研究通过建立高脂饮食诱导的胰岛素抵抗小鼠模型,给予胰岛素抵抗小鼠TLR4抑制剂TAK-242进行干预,观察小鼠主动脉组织TLR4表达及下游细胞因子肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和IL-6表达变化,旨在探讨TLR4、动脉血管炎症与胰岛素抵抗的相关性。
1 材料与方法 1.1 实验动物Specific pathogen free(SPF)级、雄性C57BL/6小鼠45只,出生21 d(3周龄),刚断乳,体重(12.4±0.6)g,购自北京大学医学部实验动物科学部,许可证号SCXK(京)2012-0004。饲养条件:温度 20~24 ℃、相对湿度50%~60%、光照节律为明/暗12 h交替、自由摄食、饮水。
1.2 主要仪器与试剂倍易型血糖仪(美国强生公司);Fresco 21型低温高速离心机、NanoDrop 2000分光光度计(美国Thermo公司);荧光定量PCR仪(德国QIAGEN公司);75S/00771型凝胶成像系统(美国Bio-RaTd公司);7600-110全自动生化分析仪(日本日立公司)。TAK-242(上海皓元生物科技有限公司);胰岛素(江苏万邦生化医药有限公司);强生血糖试纸(上海强生医疗器械有限公司);生化指标检测试剂盒(日本第一化学药品株式会社);实时荧光定量PCR试剂(北京天根生化科技有限公司)。采用Primer 5.0软件设计引物,由Invitrogen公司合成。内参基因三磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)(扩增片段长度107 bp):上游引物5′-TGTTTCCTCG TCCCGTAG-3′,下游引物5′-CAATCTCCACTTTGCCACT-3′;TLR-4基因(扩增片段长度172 bp):上游引物5′-TTTATTCAGAGCCGTTGG-3′,下游引物5′-TCCCATTCCAGGTAGGTG-3′;IL-6基因(扩增片段长度179 bp):上游引物5′-TGCCTTCTTGGGACTGAT-3′,下游引物5′-CCATTGCACAACTCTTTTC-3′;TNF-α基因(扩增片段长度159 bp):上游引物5′-CCACCATCAAGGACTCAAAT-3′;下游引物5′-GGGAAGAAT CTGGAAAGGTC-3′。
1.3 分组与处理45只小鼠用基础饲料适应性饲养3 d后,于第4天(出生25 d),随机分为3组,每组15只。对照组:予以普通基础饲料喂养;高脂对照组与TAK-242组给予高脂饲料喂养。基础饲料和高脂饲料由河北北方学院动物室提供[9]。小鼠胰岛素抵抗模型建立后,对照组小鼠继续以基础饲料喂养;高脂对照组小鼠继续以高脂饲料喂养,TAK-242组小鼠给予高脂饲料同时腹腔注射TLR4抑制剂TAK-242(0.5 mg/kg)。对照组和高脂对照组小鼠腹腔注射等体积生理盐水,2次/周,连续5个月。
1.4 指标与方法 1.4.1 葡萄糖耐量实验(glucose tolerance test,GTT)小鼠禁食不禁水12 h后,称重,尾静脉采血,测空腹血糖值;然后按照每kg体重2 g葡萄糖剂量腹腔注射50%葡萄糖注射液,应用血糖仪分别测量30、60、90、120 min血糖值。
1.4.2 胰岛素耐量实验(insulin tolerance test,ITT)小鼠行GTT后,间隔1周,进行ITT实验;小鼠禁食不禁水12 h,测定小鼠体重,尾静脉取血,测量空腹血糖值,然后按体重腹腔注射葡萄糖(2 g/kg),随后按0.75 U/kg剂量腹腔注射胰岛素,应用血糖仪分别测量15、30、60、90和120 min血糖值。
1.4.3 生化指标检测禁食不禁水12 h,称重,乙醚麻醉小鼠,眼眶后静脉丛采集血液置于ethylenediaminetetraacetic acid (EDTA)-K2抗凝试管中;颈椎脱臼处死小鼠,测量身长;分离血清,采用全自动生化分析仪测定甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)含量。
1.4.4 主动脉组织中TLR4、TNF-α和IL-6 mRNA 表达检测:(1) 主动脉组织采集:小鼠处死后,75%酒精消毒小鼠,置于冰上;打开胸腔及腹腔,充分暴露心脏,用生理盐水灌注;剥离心脏和主动脉,分离主动脉(明显看到主动脉弓上的3个分支)直至骸主动脉分支处,取出动脉,立即放入冻存管中,于液氮中保存。(2) 总RNA提取及鉴定:采用Trizol法提取小鼠主动脉组织中总RNA,进行1.5%琼脂糖凝胶电泳,计算RNA纯度。(3) 逆转录cDNA合成:采用Fast Quant RT cDNA第一链合成试剂盒进行总RNA逆转录。去除基因组DNA(gDNA)反应体系为10 μL:5×g DNA Buffer 2 μL、总RNA样本1 μL(含RNA 500 ng)、RNase-free-ddH2O 7 μL,42 ℃孵育3 min后,置于冰上。逆转录反应体系为10 μL:10×Fast RT buffer 2 μL、RT Enzyme Mix 1 μL、FQ-RT Primer Mix 2 μL、RNase-free ddH2O 5 μL。将2体系混合,42 ℃孵育15 min;95 ℃孵育3 min后放于冰上,得到的cDNA产物稀释15倍用于实时荧光定量PCR实验。(4) 荧光定量PCR实验:采用 SuperReal PreMix Plus 预混试剂盒推荐的 20 μL 反应体系:2×SuperReal PreMix Plus 10 μL、forward primer(10 μmol/L)1.0 μL、reverse primer(10 μmol/L)1.0 μL、cDNA模板1 μL、RNase-free ddH2O 7.0 μL;反应条件:95 ℃ 预变性15 min;95 ℃变性10 s,60 ℃ 退火20 s,72 ℃延伸31 s,共40个循环。GAPDH为内参基因,同时设无模板的 PCR反应体系作为阴性对照。同一标本设 3 个复管。(5) 数据处理:采用2-△△CT法进行分析,△Ct=Ct(目的基因)-Ct(内参基因),△△cycle threshold(Ct)=△Ct(实验组)-△Ct(对照组),目的基因相对表达量=2-△△CT。
1.5 统计分析计量资料以x±s表示,采用SPSS 19.0软件进行统计分析,2组数据比较采用独立样本t检验,多组数据比较釆用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果 2.1 高脂饮食诱导胰岛素抵抗小鼠模型建立各组小鼠生长良好,进食量无明显差异;高脂饲料喂养7个月时,高脂组小鼠体重[(35.09±1.02)g]明显高于对照组[(31.47±1.36)g],差异有统计学意义(P<0.05)。 GTT结果显示,给药前对照组与高脂组小鼠空腹血糖无明显差异;与对照组比较,高脂组小鼠腹腔注射葡萄糖后30、60 min血糖明显升高(P<0.01),90、120 min时血糖仍高于对照组(P<0.05)。提示高脂饮食持续喂养,可致小鼠糖调节能力受损。ITT结果显示,高脂组小鼠血糖水平在注射葡萄糖后15 min时维持在较高水平,明显高于对照组,差异有统计学意义(P<0.01)。提示高脂组小鼠胰岛素敏感性明显低于对照组。
2.2 TAK-242对胰岛素抵抗小鼠葡萄糖耐量及胰岛素耐量影响 2.2.1 TAK-242对胰岛素抵抗小鼠葡萄糖耐量影响(图 1)GTT结果显示,3组小鼠空腹血糖值无明显差异;给予葡萄糖后30、60 min 时,高脂对照组与TAK-242组小鼠血糖值均明显高于对照组,差异有统计学意义(P<0.01或P<0.05);与高脂对照组比较,TAK-242组小鼠在葡萄糖负荷后30、60 min的血糖值均降低,差异有统计学意义(P<0.01或P<0.05)。提示,TAK-242能改善小鼠葡萄糖调节能力。
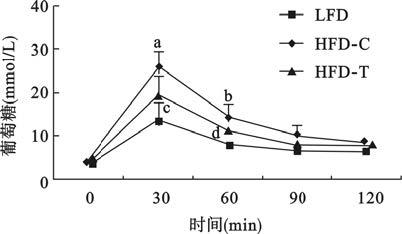
|
注:n=15;与对照组比较,a P<0.01,b P<0.05;与高脂对照组比较,c P<0.01,d P<0.05。 图 1 TAK-242对胰岛素抵抗小鼠葡萄糖耐量影响 |
2.2.2 TAK-242对胰岛素抵抗小鼠胰岛素耐量影响(图 2)
ITT结果显示,3组小鼠血糖值无明显差异(P>0.05);注射胰岛素后,在15 min监测点,高脂对照组小鼠血糖值明显高于对照组小鼠(P<0.01);TAK-242组小鼠血糖值低于高脂对照组,但差异无统计学意义(P>0.05)。提示TAK-242组小鼠胰岛素敏感性有所改善。
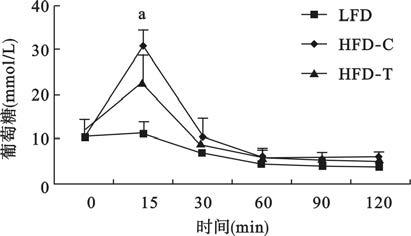
|
注:n=15;与对照组比较,a P<0.01。 图 2 TAK-242对胰岛素抵抗小鼠胰岛素耐量影响 |
2.3 TAK-242对胰岛素抵抗小鼠生化指标影响(表 1)
与对照组比较,高脂对照组和TAK-242组小鼠血清TC、LDL-C和HDL-C水平均明显升高(P<0.01),高脂对照组小鼠TG水平明显升高(P<0.01);高脂组与TAK-242组之间小鼠血清中各生化指标无明显差异。
2.4 TAK-242对胰岛素抵抗小鼠主动脉组织中TLR4、TNF-α和IL-6 mRNA表达影响(表 2)结果显示,高脂对照组小鼠主动脉组织中TLR4、TNF-α和IL-6 mRNA表达均高于对照组(P<0.01)。提示高脂饮食喂养可促进动脉组织中TLR4及下游炎症因子的表达。TAK-242组小鼠主动脉组织中TLR4、TNF-α及IL-6 mRNA表达明显低于高脂对照组(P<0.05或0.01)。提示TAK-242可通过下调TLR4 mRNA表达,降低胰岛素抵抗小鼠主动脉炎性细胞因子TNF-α和IL-6 mRNA表达。
| 表 1 TAK-242对胰岛素抵抗小鼠生化指标影响(mmol/L,x±s=15) |
| 表 2 TAK-242对胰岛素抵抗小鼠主动脉中TLR4等因子表达影响(x±s=15) |
3 讨 论
肥胖现已成为全球性公共卫生问题[10],肥胖相关的胰岛素抵抗是导致多种代谢异常的关键环节,与2型糖尿病、动脉粥样硬化等疾病的发生、发展密切相关。但肥胖诱导胰岛素抵抗的分子机制尚不明确,可能与天然免疫信号转导通路活化致炎症反应增强有关[11-12]。本研究结果显示,高脂饲料喂养7个月后,小鼠糖耐量、胰岛素耐量均低于正常饲料组。与已有研究结果[13-14]相似。提示成功建立胰岛素抵抗模型。
TLR4/NF-κB和TLR4/MAPK信号通路在多级水平上可与胰岛素信号通路交联。有研究证实,TLR4在许多胰岛素作用的靶细胞有表达[15],包括肝脏、脂肪组织、肌肉组织、胰岛β细胞和脑组织[16-18]等。游离脂肪酸(free fatty acid,FFA)和脂多糖均是TLR4有效的配体。FFA是TLR4最主要的内源性配体,肥胖可使游离脂肪酸含量升高,激活TLR4[5];脂多糖是革兰氏阴性细菌的外膜成分,在高脂饮食时肠道微生物群和肠壁的通透性发生改变,肠道细菌产生脂多糖增多,移位至体循环,也可活化TLR4[19]。TLR4的活化,可引起下游信号MAPK和NF-κB激活,产生炎性细胞因子TNF-α和IL-6[20]等,后者可通过抑制胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)丝氨酸磷酸化和促进IRS-1酪氨酸磷酸化双重机制引起IRS-1失活抑制胰岛素信号通路[21-22]。
TAK-242为环乙烯的衍生物,是一种小分子TLR4特异性抑制剂[23]。本研究结果表明,持续应用小剂量TAK-242,可明显改善高脂饲料诱导的胰岛素抵抗小鼠的糖耐量和胰岛素抵抗状态;与对照组比较,高脂饮食诱导的胰岛素抵抗小鼠血清TG水平明显升高。提示TLR4可能参与了高脂饲料诱导的小鼠胰岛素抵抗过程,推测TLR4的活化可能与高脂饮食状态下FFA的积累和脂多糖移位体循环有关[5, 19]。动脉粥样硬化呈现低度炎症反应,而胰岛素抵抗又可增加冠状动脉粥样硬化性心脏病风险。Zhang等[24]在Long Evans大鼠皮下埋植缓慢释放TAK-242胶囊,发现持续给予TAK-242能改善高脂饮食大鼠外周组织的胰岛素抵抗状态,但并不能改善肝脏组织的胰岛素抵抗。另有研究表明,脂多糖能够诱导主动脉平滑肌细胞表达TLR4,维生素D可通过下调心肌组织TLR4的表达及相关的MyD88和NF-κB信号通路对大鼠的心血管产生保护作用[25]。本研究结果显示,高脂饮食诱导的胰岛素抵抗小鼠主动脉组织中TLR4及TLR4信号转导通路下游的炎性细胞因子TNF-α和IL-6 mRNA表达明显高于对照组;TAK-242干预后,小鼠主动脉组织中TLR4及TNF-α和IL-6 mRNA表达均下调。提示胰岛素抵抗状态下,主动脉组织中TLR4被活化,上调炎症因子TNF-α和IL-6表达,可能与动脉炎症的发生有关。有研究显示,胰岛素能够通过抑制炎症,增加动脉粥样斑块的稳定性,应用小剂量胰岛素可减少脂质沉积、降低血清中TNF-α和IL-6水平、减少泡沫细胞形成,其机制与TLR4-MyD88-NF-κB 信号转导通路相关[24]。
| [1] | Könner AC, Brüning JC. Toll-like receptors:linking inflammation to metabolism[J]. Trends Endocrinol Metab, 2011, 22(1) : 16–23. DOI:10.1016/j.tem.2010.08.007 |
| [2] | 常晓彤, 辇晓峰, 王振辉. Toll样受体信号转导途径研究进展[J]. 生理科学进展, 2011, 42(5) : 340–346. |
| [3] | Gárate I, García-Bueno B, Madrigal JL, et al. Toll-like 4 receptor inhibitor TAK-242 decreases neuroinflammation in rat brain frontal cortex after stress[J]. J Neuroinflammation, 2014, 11(8) : 1–14. |
| [4] | Tian L, Wen Q, Dang X, et al. Immune response associated with Toll-like receptor 4 signaling pathway leads to steroid-induced femoral head osteonecrosis[J]. BMC Musculoskeletal Disorders, 2014, 15(18) : 1–12. |
| [5] | Hussey SE, Liang H, Costford SR, et al. TAK-242,a small-molecule inhibitor of Toll-like receptor 4 signalling,unveils similarities and differences in lipopolysaccharide- and lipid-induced inflammation and insulin resistance in muscle cells[J]. Biosci Rep, 2012, 33(1) : 37–47. |
| [6] | Poirier P, Giles TD, Bray GA, et al. Obesity and cardiovascular disease:pathophysiology,evaluation,and effect of weight loss:an update of the 1997 American Heart Association Scientific Statement on Obesity and Heart Disease from the Obesity Committee of the Council on Nutrition,Physical Activity,and Metabolism[J]. Circulation, 2006, 113(6) : 898–918. DOI:10.1161/CIRCULATIONAHA.106.171016 |
| [7] | Verhagen SN, Wassink AM, van der Graaf Y, et al. Insulin resistance increases the occurrence of new cardiovascular events in patients with manifest arterial disease without known diabetes.The SMART study[J]. Cardiovasc Diabetol, 2011, 10(100) : 1–9. |
| [8] | Muniyappa R, Sowers JR. Role of insulin resistance in endothelial dysfunction[J]. Rev Endocr Metab Disord, 2013, 14(1) : 5–12. DOI:10.1007/s11154-012-9229-1 |
| [9] | 徐云鹏, 王文栋, 郝敏, 等. 高脂饮食对幼年大鼠小肠组织FABP2mRNA表达的影响[J]. 卫生研究, 2014, 43(5) : 749–753. |
| [10] | Heiker JT. Vaspin(serpin A12)in obesity,insulin resistance,and inflammation[J]. J Pept Sci, 2014, 20(5) : 299–306. DOI:10.1002/psc.v20.5 |
| [11] | Ceppo F, Jager J, Berthou F, et al. Implication of MAP kinases in obesity-induced inflammation and insulin resistance[J]. Biol Aujourdhui, 2014, 208(2) : 97–107. DOI:10.1051/jbio/2014014 |
| [12] | Bunner AE, Chandraseker PC, Barnard ND. Knockout mouse models of insulin signaling:relevance past and future[J]. World J Diabetes, 2014, 5(2) : 146–159. |
| [13] | 刘金凤, 董焕生, 潘庆杰, 等. 食源性肥胖小鼠胰岛素抵抗模型的建立[J]. 青岛农业大学学报:自然科学版, 2014, 31(2) : 91–94. |
| [14] | Rancoule C, Attané C, Grès S, et al. Lysophosphatidic acid impairs glucose homeostasis and inhibits insulin secretion in high-fat diet obese mice[J]. Diabetologia, 2013, 56(6) : 1394–1402. DOI:10.1007/s00125-013-2891-3 |
| [15] | Kim JJ, Sears DD. TLR4 and insulin resistance[J]. Gastroenterol Res Pract, 2010, 2010(212563) : 1–11. |
| [16] | Reyna SM, Ghosh S, Tantiwong P, et al. Elevated toll-like receptor 4 expression and signaling in muscle from insulin-resistant subjects[J]. Diabetes, 2008, 57(10) : 2595–2602. DOI:10.2337/db08-0038 |
| [17] | Shi H, Kokoeva MV, Inouye K, et al. TLR4 links innate immunity and fatty acid induced insulin resistance[J]. The Journal of Clinical Investigation, 2006, 116(11) : 3015–3025. DOI:10.1172/JCI28898 |
| [18] | Tsukumo DM, Carvalho-Filho MA, Carvalheira JB, et al. Loss-of function mutation in Toll-like receptor 4 prevents diet-induced obesity and insulin resistance[J]. Diabetes, 2007, 56(8) : 1986–1998. DOI:10.2337/db06-1595 |
| [19] | Liang H, Hussey SE, Sanchez-Avila A, et al. Effect of lipopolysaccharide on inflammation and insulin action in human muscle[J]. PLoS One, 2013, 8(5) : 1–8. |
| [20] | Ii M, Matsunaga N, Hazeki K, et al. A novel cyclohexene derivative,ethyl(6R)-6-[N-(2-Chloro-4-fluorophenyl)sulfamoyl]cyclohex-1-ene-1-carboxylate(TAK-242),selectively inhibits toll-like receptor 4-mediated cytokine production through suppression of intracellular signaling[[J]. Mol Pharmacol, 2006, 69(4) : 1288–1295. DOI:10.1124/mol.105.019695 |
| [21] | Patel P, Abate N. Body fat distribution and insulin resistance[J]. Nutrients, 2013, 5(6) : 2019–2027. DOI:10.3390/nu5062019 |
| [22] | Capurso C, Capurso A. The role of free fatty acids from excess adiposity to insulin resistance[J]. Vascul Pharmacol, 2012, 57(2-4) : 91–97. DOI:10.1016/j.vph.2012.05.003 |
| [23] | Leon CG, Tory R, Jia J, et al. Discovery and development of toll-like receptor 4(TLR4)antagonists:a new paradigm for treating sepsis and other diseases[J]. Pharm Res, 2008, 25(8) : 1751–1761. DOI:10.1007/s11095-008-9571-x |
| [24] | Zhang N, Liang H, Farese RV, et al. Pharmacological TLR4 inhibition protects against acute and chronic fat-induced insulin resistance in rats[J]. PLoS One, 2015, 10(7) : 1–14. |
| [25] | 刘志远, 李玉东, 张金盈. 维生素D对大鼠心血管保护作用及机制[J]. 中国公共卫生, 2014, 30(8) : 1099–1121. |
 2016, Vol. 32
2016, Vol. 32


