毒死蜱(chlorpyrifos,CPF)又名氯蜱硫磷,是全世界目前使用最广泛的有机磷酸酯杀虫剂之一。中国现有生产CPF的企业20余家,年产量在10万吨左右,占全球产能的40%[1]。CPF被广泛用于蔬菜、谷物等农业防虫以及建筑材料、蚊蚁防治等非农业领域。近年来研究发现CPF对人类的健康造成了极大的威胁,本研究通过对CPF的理化性质、代谢以及对人类各类疾病的影响等进行综述,旨在引起大众对CPF的毒性作用的重视。
1 毒死蜱的理化性质及其代谢降解(图 1)CPF的化学名为O,O-二乙基-O-(3,5,6-三氯-2-吡啶基),分子式为C9H11Cl3NO3PS,分子量为350.6。为白色结晶固体,溶点42.5~43.0℃,不溶于水,易溶于苯、乙醚等有机溶剂。25 ℃时水中的溶解度为2 mg/L,在丙酮中的溶解度为650 g/L,苯中190 g/L,二甲苯中为400 mg/L,甲醇中为45 g/L。CPF可经呼吸道、消化道、皮肤吸收,还可通过母婴垂直传播。CPF进入人体后主要分布于肝脏、肾脏、脾脏等血流量较高的器官。首先通过细胞色素酶P450氧化脱硫,生成氧化的中间产物,后者一方面可通过生物活化作用生成具有神经毒性的氧化毒死蜱,氧化毒死蜱进一步经对氧磷酶(paraoxonase 1,PON-1)的水解作用最终生成3,5,6-三氯-2-吡啶酚(3,5,6-trichloro-2-pyridinol,TCPy)与二乙基磷酸酯(diethylphosphate,DEP);另一方面也可以直接被解毒生成TCPy 与二乙基硫羟磷酸酯(diethylthiophosphate,DETP)。这些终末代谢产物大多数以原形或代谢物形式经尿排出,少量通过粪便排泄出[2]。
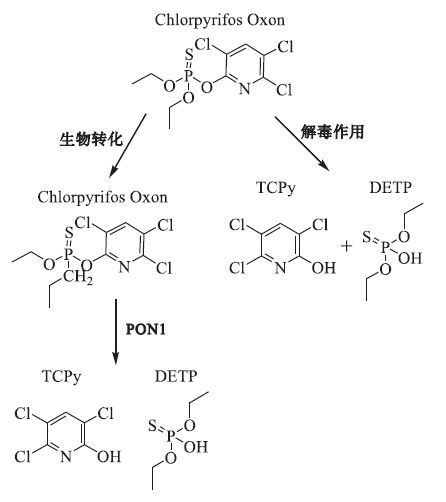
|
图 1 CPF在人体内的代谢过程 |
2 CPF在环境及人体内的残留
CPF具有环境持久性,即使是在北极地区的冰雪、雾、空气、海水中都能检测到CPF的存在。CPF在环境中的残留严重威胁着食品安全:2007年浙江余姚市的稻谷与大米进行农药残留检测,结果发现CPF在稻谷和大米中都存在超标的情况[3];上海市在市售的1294件蔬菜和510件水果样品中发现豆类、茎类、叶菜类中CPF检出率在9.9%~13.9%,其最高残留值为2.6 mg/kg[4]。流行病学调查研究发现在人类的血液、乳汁、宫颈分泌物、呼出的空气、精液、唾液,胎儿的脐血以及新生儿的大便、尿液中都能检测到CPF及其代谢产物的存在[5-6]。
3 CPF的对人类健康的危害 3.1 CPF的急性毒性作用美国环保署报道2002—2009期间有126起关于CPF的急性中毒事件,其中有17起是儿童急性中毒。CPF对机体的急性中毒作用机制是对胆碱能系统的毒性作用,其代谢产物之一CPFO的胆碱能抑制作用更强。在CPF中毒后24~48 h,其与胆碱酯酶结合成为不可逆状态,将进一步损害全身各个器官系统,严重者还会诱发一过性早搏、传导阻滞、ST-T异常、Q-T间期延长甚至室速、室颤等其它致死性的心律失常[7]。
3.2 CPF的遗传毒性作用遗传毒性是指在遗传毒物的作用下,导致的生物体细胞基因组分子结构特异改变或使遗传信息发生变化的有害效应。遗传毒性包括基因突变、染色体畸变、染色体数目异常、DNA损伤。DNA的结构与功能发生改变,阻碍了DNA的正常复制与转录。早在1983年,Woodruff等[8]等在果蝇的试验中发现CPF暴露引起果蝇环状X染色体数目丢失。其后在动物实验中也发现CPF暴露后所导致了肝、肾、脑等器官细胞中出现彗尾DNA含量增高,微核细胞比值显著增高[9]。还有研究通过检测5-甲基胞嘧啶的含量发现CPF暴露后导致了大鼠肝细胞的甲基化水平显著下降[10]。这些都提示CPF具有明显的遗传毒性。
3.3 CPF的致癌性关于CPF的致癌性目前尚不确定。在美国北卡罗莱纳州与爱荷华州的注册农药施药者的癌症发病率的调查[11-12]中发现肺癌、白血病、直肠癌、脑部肿瘤的发病风险与CPF的暴露增加密切相关,在CPF暴露概率较高的人群比没有暴露于CPF的人群患肺癌的机会增加2.18倍,直肠癌发病率是非施药者的2.7倍;Ventura等[13]研究发现CPF暴露是乳腺癌发生的危险因素;在加拿大一项纳入了316例淋巴瘤患者和1506例正常对照的病例对照研究中发现CPF暴露是一项具有显著差异的因素(OR=5.26)[14];一项涵盖美国3个州的研究显示有机磷农药暴露是非霍奇金淋巴瘤的危险因素[15];Alavanja等[16]的研究发现在具有前列腺癌家族史的农药施药者中前列腺癌的发病率增高,其妻子的乳腺癌的发生率增加。尽管这些流行病学研究发现CPF与人类的某些肿瘤如肺癌、直肠癌的发生关系密切,并与其它肿瘤如白血病、脑部肿瘤、非霍奇金淋巴瘤、乳腺癌之间也存在一定的关系,但研究者在动物实验中并未发现毒死蜱的致癌性。
3.4 CPF的免疫毒性在为数不多的关于CPF的免疫毒性的研究发现除了对淋巴细胞、胸腺细胞、T细胞的毒性作用外,CPF对肿瘤坏死因子和自身免疫等都可产生一定的影响。在64名使用CPF的白蚁防治工作人员的体检中出现了白细胞的异常[17]。Thrasher等[18]在对暴露于CPF的12名志愿者的1~4.5年的随访研究中发现这些人群的特异性反应与抗生素过敏的发生率显著增高,CD26细胞计数及自身免疫的比值显著升高。此后,该研究又对29名慢性暴露于CPF的志愿者的研究发现CD26细胞与自身抗体水平明显增高,同时伴CD5表型下降,植物凝集素与伴刀豆球蛋白刺激反应产生的有丝分裂水平下降[19]。Oostingh等[20]的研究发现CPF暴露可影响人类永生的淋巴细胞或支气管上皮细胞的细胞因子释放水平。同样,在动物实验中也发现了CPF暴露可引起T淋巴细胞数目显著增加外,对干扰素γ、TNF-α、白介素-6等细胞因子、免疫球蛋白IgM和补体C3水平也有一定的影响[21]。
3.5 CPF的内分泌干扰近年来的研究发现CPF不仅可影响雄性激素、雌激素、甲状腺素的水平,还影响促性腺激素释放,引起性别相关的胆固醇和胰岛素水平改变。对322名不孕不育患者的研究发现,其尿液中的CPF的代谢产物TCP水平与雌甾二醇的浓度呈负相关,TCP升高4个百分位数,则雌甾二醇的浓度降低1.36 pg/mL[22];此外,美国的一项流行病学研究发现,12~18岁男性人群尿液中TCP浓度上升一个四分位间距,血液中T4水平即增加3.8%,而在18~40岁阶段人群则相应的T4水平即增加3.5%,促甲状腺素水平相应降低10.7%,在>60岁的男性中促甲状腺素降低20%,但在>60岁的女性中促甲状腺素激素水平却相应的增加[23]。动物实验研究还发现在大鼠暴露CPF后可降低血液中睾酮、卵泡刺激素、黄体生成素等激素水平,并导致生精小管收缩,引起精子数目的改变[24-25]。此外,CPF暴露还可引起糖、脂质代谢异常,出现血浆胆固醇与甘油三脂水平的增高,餐后高胰岛素血症[26]。
3.6 CPF与生殖和发育自1956的反应停事件以后,化学物质对生殖发育的影响逐渐受到人们的重视,研究发现CPF也存在一定程度的生殖毒性。1996年Sherman[27]首次报道了4例因宫内暴露CPF后出现外生殖器发育缺陷的患儿。动物实验的相关机制研究发现暴露CPF后可使睾丸与附睾组织学的改变,附睾水肿、充血,精子存活率及数目下降,精子细胞激活与运动受到抑制;卵母细胞形态受损、凋亡增加[28-29]。CPF暴露还影响胎盘滋养层细胞的存活与凋亡,并减少新生鼠数量,早期流产率也相应增加[30]。
3.7 CPF与神经系统发育上个世纪90年代以来,对CPF暴露对神经发育的影响进行了一系列研究,发现低剂量CPF暴露会导致新生儿出生体重低、头围减小、新生儿原始反射异常、新生儿神经行为评分异常、幼儿期精神运动发育评分下降,并与注意力问题、多动症、在学龄期出现的广泛性发育障碍,IQ系数减低与工作记忆能力下降,以及社会行为异常等相关[31]。最近Rauh等[32]的研究表明生前暴露于CPF可改变儿童的脑结构,在MRI检查结果中出现双侧颞叶、中央后回、右侧大脑的额回、直回、楔状叶、楔前叶等部位的肥大,额叶和顶叶皮层变薄,这些异常可能与注意力、语言、认知、情绪等相关,甚至与IQ的下降相关。动物实验研究也证实在脑的发育期暴露于CPF可引起青少年甚至成年期隔核、纹状体、海马等局部脑区的形态改变[33-34]。还可影响大脑中蛋白质与DNA合成,干扰了神经元与胶质细胞等的增殖、分化和凋亡等多个阶段,从而干扰轴索形成、突触发生及神经电路异常[35]。在脑的发育期暴露CPF后不仅影响了胆碱能系统,还干扰了儿茶酚胺系统及5-羟色胺系统[36-37]。CPF暴露通过以上作用,不仅可引起脑发育畸形,还可以导致行为学与神经功能的障碍。
3.8 CPF与神经系统退行性疾病近年来,流行病学调查显示帕金森病(Parkinson′s disease,PD)和阿尔兹海默病(Alzheimer disease,AD)等神经系统退行性疾病与接触包括CPF在内的杀虫剂及其它有机磷酸酯类化合物有关[38]。在多巴胺能PC12细胞中发现CPF暴露导致PD相关基因的表达改变[39]。此外,也有研究发现小鼠单次皮下注射CPF(50 mg/kg)后可引起其淀粉样蛋白水平持续地升高,并可能导致其长远的行为改变[40]。
4 小 结CPF具有环境持久性和生物蓄积性,大剂量CPF暴露能引起急性中毒症状,但源于环境的长期低剂量CPF暴露对人类的健康也造成了极大的威胁。减少CPF的使用,控制CPF对人类的暴露对于维护人类的健康有着非常重大的意义。
| [1] | 汪家铭. 毒死蜱市场竞争优势及发展建议[J]. 化工管理 , 2010, 1 : 43–47. |
| [2] | Crane AL, Klein K, Zanger UM, et al. Effect of CYP2B6*6 and CYP2C19*2 genotype on chlorpyrifos metabolism[J]. Toxicology , 2012, 293 (1-3) : 115–122. DOI:10.1016/j.tox.2012.01.006 |
| [3] | 陈余平, 马丽萍, 汪少敏, 等. 农药残留超标稻谷在大米中残留状况的探讨[J]. 浙江农业科学 , 2008, 3 : 344–346. |
| [4] | 黄宝勇, 孙江, 肖志勇. 北京市蔬菜中毒死蜱残留长期摄入的风险评估[J]. 中国农业科技导报 , 2013, 15 (4) : 55–60. |
| [5] | Barr DB, Allen R, Olsson AO, et al. Concentrations of selective metabolites of organophosphorus pesticides in the United States population[J]. Environ Res , 2005, 99 (3) : 314–326. DOI:10.1016/j.envres.2005.03.012 |
| [6] | Needham LL. Assessing exposure to organophosphorus pesticides by biomonitoring in epidemiologic studies of birth outcomes[J]. Environ Health Perspect , 2005, 113 (4) : 494–498. DOI:10.1289/ehp.7490 |
| [7] | 陈同排. 儿童急性毒死蜱中毒28例临床分析[J]. 中国小儿急救医学 , 2012, 19 (6) : 632–634. |
| [8] | Woodruff RC, Phillips JP, Irwin D. Pesticide-induced complete and partial chromosome loss in screens with repair-defective females of Drosophila melanogaster[J]. Environ Mutagen , 1983, 5 (6) : 835–846. DOI:10.1002/(ISSN)1930-238X |
| [9] | Ismail M, Khan QM, Ali R, et al. Genotoxicity of chlorpyrifos in freshwater fish Labeo rohita using alkaline single-cell gel electrophoresis (comet) assay[J]. Drug Chem Toxicol , 2014, 37 (4) : 466–471. DOI:10.3109/01480545.2014.887093 |
| [10] | Cui Y, Guo J, Xu B, et al. Genotoxicity of chlorpyrifos and cypermethrin to ICR mouse hepatocytes[J]. Toxicol Mech Methods , 2011, 21 (1) : 70–74. DOI:10.3109/15376516.2010.529192 |
| [11] | Lee WJ, Blair A, Hoppin JA, et al. Cancer incidence among pesticide applicators exposed to chlorpyrifos in the Agricultural Health Study[J]. J Natl Cancer Inst , 2004, 96 (23) : 1781–1789. DOI:10.1093/jnci/djh324 |
| [12] | Lee WJ, Sandler DP, Blair A, et al. Pesticide use and colorectal cancer risk in the Agricultural Health Study[J]. Int J Cancer , 2007, 121 (2) : 339–346. DOI:10.1002/(ISSN)1097-0215 |
| [13] | Ventura C, Nunez M, Miret N, et al. Differential mechanisms of action are involved in chlorpyrifos effects in estrogen-dependent or -independent breast cancer cells exposed to low or high concentrations of the pesticide[J]. Toxicol Lett , 2012, 213 (2) : 184–193. DOI:10.1016/j.toxlet.2012.06.017 |
| [14] | Karunanayake CP, Spinelli JJ, McLaughlin JR, et al. Hodgkin lymphoma and pesticides exposure in men:a Canadian case-control study[J]. J Agromedicine , 2012, 17 (1) : 30–39. DOI:10.1080/1059924X.2012.632726 |
| [15] | Waddell BL, Zahm SH, Baris D, et al. Agricultural use of organophosphate pesticides and the risk of non-Hodgkin's lymphoma among male farmers (United States)[J]. Cancer Causes Control , 2001, 12 (6) : 509–517. DOI:10.1023/A:1011293208949 |
| [16] | Alavanja MC, Samanic C, Dosemeci M, et al. Use of agricultural pesticides and prostate cancer risk in the Agricultural Health Study Cohort[J]. Am J Epidemiol , 2003, 157 (9) : 800–814. DOI:10.1093/aje/kwg040 |
| [17] | Jitsunari F, Asakawa F, Shiraishi H, et al. Variations in blood cholinesterase activity and exposure to chlorpyrifos in termite-control workers[J]. Nihon Eiseigaku Zasshi , 1990, 44 (6) : 1049–1058. DOI:10.1265/jjh.44.1049 |
| [18] | Thrasher JD, Madison R, Broughton A. Immunologic abnormalities in humans exposed to chlorpyrifos:preliminary observations[J]. Arch Environ Health , 1993, 48 (2) : 89–93. DOI:10.1080/00039896.1993.9938400 |
| [19] | Thrasher JD, Heuser G, Broughton A. Immunological abnormalities in humans chronically exposed to chlorpyrifos[J]. Arch Environ Health , 2002, 57 (3) : 181–187. DOI:10.1080/00039890209602934 |
| [20] | Oostingh GJ, Wichmann G, Schmittner M, et al. The cytotoxic effects of the organophosphates chlorpyrifos and diazinon differ from their immunomodulating effects[J]. J Immunotoxicol , 2009, 6 (2) : 136–145. DOI:10.1080/15476910902977407 |
| [21] | Li X, Liu L, Zhang Y, et al. Toxic effects of chlorpyrifos on lysozyme activities,the contents of complement C3 and IgM,and IgM and complement C3 expressions in common carp (Cyprinus carpio L)[J]. Chemosphere , 2013, 93 (2) : 428–433. DOI:10.1016/j.chemosphere.2013.05.023 |
| [22] | Meeker JD, Ravi SR, Barr DB, et al. Circulating estradiol in men is inversely related to urinary metabolites of nonpersistent insecticides[J]. Reprod Toxicol , 2008, 25 (2) : 184–191. DOI:10.1016/j.reprotox.2007.12.005 |
| [23] | Fortenberry GZ, Hu H, Turyk M, et al. Association between urinary 3,5,6-trichloro-2-pyridinol,a metabolite of chlorpyrifos and chlorpyrifos-methyl,and serum T4 and TSH in NHANES 1999-2002[J]. Sci Total Environ , 2012, 424 : 351–355. DOI:10.1016/j.scitotenv.2012.02.039 |
| [24] | Mandal TK, Das NS. Correlation of testicular toxicity and oxidative stress induced by chlorpyrifos in rats[J]. Hum Exp Toxicol , 2011, 30 (10) : 1529–1539. DOI:10.1177/0960327110392400 |
| [25] | Mandal TK, Das NS. Testicular gametogenic and steroidogenic activities in chlorpyrifos insecticide-treated rats:a correlation study with testicular oxidative stress and role of antioxidant enzyme defence systems in Sprague-Dawley rats[J]. Andrologia , 2012, 44 (2) : 102–115. DOI:10.1111/and.2012.44.issue-2 |
| [26] | Slotkin TA, Brown KK, Seidler FJ. Developmental exposure of rats to chlorpyrifos elicits sex-selective hyperlipidemia and hyperinsulinemia in adulthood[J]. Environ Health Perspect , 2005, 113 (10) : 1291–1294. DOI:10.1289/ehp.8133 |
| [27] | Sherman JD. Chlorpyrifos (Dursban)-associated birth defects:report of four cases[J]. Arch Environ Health , 1996, 51 (1) : 5–8. DOI:10.1080/00039896.1996.9935986 |
| [28] | Nandi S, Gupta PS, Roy SC, et al. Chlorpyrifos and endosulfan affect buffalo oocyte maturation,fertilization,and embryo development in vitro directly and through cumulus cells[J]. Environ Toxicol , 2011, 26 (1) : 57–67. DOI:10.1002/tox.v26.1 |
| [29] | Selvaraju S, Nandi S, Gupta PS, et al. Effects of heavy metals and pesticides on buffalo (Bubalus bubalis) spermatozoa functions in vitro[J]. Reprod Domest Anim , 2011, 46 (5) : 807–813. DOI:10.1111/rda.2011.46.issue-5 |
| [30] | Ruan QL, Ju JJ, Li YH, et al. Chlorpyrifos exposure reduces reproductive capacity owing to a damaging effect on gametogenesis in the nematode Caenorhabditis elegans[J]. J Appl Toxicol , 2012, 32 (7) : 527–535. DOI:10.1002/jat.v32.7 |
| [31] | Furlong MA, Engel SM, Barr DB, et al. Prenatal exposure to organophosphate pesticides and reciprocal social behavior in childhood[J]. Environ Int , 2014, 70C : 125–131. |
| [32] | Rauh VA, Perera FP, Horton MK, et al. Brain anomalies in children exposed prenatally to a common organophosphate pesticide[J]. Proc Natl Acad Sci U S A , 2012, 109 (20) : 7871–7876. DOI:10.1073/pnas.1203396109 |
| [33] | Roy TS, Seidler FJ, Slotkin TA. Morphologic effects of subtoxic neonatal chlorpyrifos exposure in developing rat brain:regionally selective alterations in neurons and glia[J]. Brain Res Dev Brain Res , 2004, 148 (2) : 197–206. DOI:10.1016/j.devbrainres.2003.12.004 |
| [34] | Colborn T. A case for revisiting the safety of pesticides:a closer look at neurodevelopment[J]. Environ Health Perspect , 2006, 114 (1) : 10–17. DOI:10.1289/ehp.7940 |
| [35] | Slotkin TA. Guidelines for developmental neurotoxicity and their impact on organophosphate pesticides:a personal view from an academic perspective[J]. Neurotoxicology , 2004, 25 (4) : 631–640. DOI:10.1016/S0161-813X(03)00050-0 |
| [36] | Dam K, Garcia SJ, Seidler FJ, et al. Neonatal chlorpyrifos exposure alters synaptic development and neuronal activity in cholinergic and catecholaminergic pathways[J]. Brain Res Dev Brain Res , 1999, 116 (1) : 9–20. DOI:10.1016/S0165-3806(99)00067-X |
| [37] | Dam K, Seidler FJ, Slotkin TA. Chlorpyrifos releases norepinephrine from adult and neonatal rat brain synaptosomes[J]. Brain Res Dev Brain Res , 1999, 118 (1-2) : 129–133. DOI:10.1016/S0165-3806(99)00139-X |
| [38] | Dardiotis E, Xiromerisiou G, Hadjichristodoulou C, et al. The interplay between environmental and genetic factors in Parkinson's disease susceptibility:the evidence for pesticides[J]. Toxicology , 2013, 307 : 17–23. DOI:10.1016/j.tox.2012.12.016 |
| [39] | Slotkin TA, Seidler FJ. Developmental exposure to organophosphates triggers transcriptional changes in genes associated with Parkinson's disease in vitro and in vivo[J]. Brain Res Bull , 2011, 86 (5-6) : 340–347. DOI:10.1016/j.brainresbull.2011.09.017 |
| [40] | Salazar JG, Ribes D, Cabre M, et al. Amyloid beta peptide levels increase in brain of AbetaPP Swedish mice after exposure to chlorpyrifos[J]. Curr Alzheimer Res , 2011, 8 (7) : 732–740. DOI:10.2174/156720511797633197 |
 2016, Vol. 32
2016, Vol. 32


