2. 大连210医院检验科
血小板特异性抗原(human platelet antigen,HPA)由血小板特有的抗原决定簇组成,受血小板膜糖蛋白GPIbα上的一对等位基因HPA-2a、2b控制,为双等位基因共显性模式。HPA-2a可引起新生儿同种免疫血小板减少性紫癜(neonatal alloimmue thrombocytopenic purpura,NAITP),而HPA-2b除了可引起血小板输注无效(platelet refractoriness,PTR)外,还是冠心病发病的独立危险因素,且与冠心病的严重程度显著相关[1]。因此,HPA-2的基因分型对于NAITP、PTR等疾病的诊断、治疗、预防以及研究HPA-2与疾病的关系有重要意义。本研究基于熔解曲线分析法,建立一个新的HPA-2系统基因分型方法,并应用此方法对辽宁大连地区汉族155名血小板捐献者进行了HPA-2基因分型,检测HPA-2等位基因多态性,现将结果报告如下。 1 材料与方法 1.1 材料 1.1.1 标本采集
随机选取辽宁省血液中心155名血小板自愿捐献者。每人采集静脉血1 mL,以EDTA·K2抗凝,依次编号,放入-20 ℃冰箱备用。 1.1.2 试剂
SYBR Green PCR Master Mix试剂盒(美国应用生物系统公司);金牌酶(5 U/μL)(美国应用生物系统公司);10×PCR缓冲液Ⅱ(美国应用生物系统公司);25mol MgCl2溶液(美国应用生物系统公司);dNTP Mixture(大连宝生物工程有限公司);DL500TM DNA Marker,500 μL(大连宝生物工程有限公司);血液DNA提取试剂盒(美国Invitrogen公司)。 1.1.2 试剂
ABI Primer 7300型荧光定量PCR仪(美国应用生物系统公司);TP-600型PCR扩增仪(宝生物工程(大连)有限公司);GLS-1000型凝胶成像系统(上海天能科技有限公司);D-37520型高速台式离心机(德国Thermo公司);DYY-6C型电泳仪(北京市六一仪器厂医用仪器厂)。 1.2 方法 1.2.1 引物设计与合成
针对HPA-2系统的等位基因,设计2个等位基因特异性引物和共同引物。引物均由大连宝生物工程公司合成。HPA-2a等位基因特异性引物序列(5′—3′):GCGGGCAGGGCGGCTCCTGCCCCCAGGGCTCCTGAC,共同引物序列:TCCTGAGCTTCTCCAGCTTG,PCR产物长度65。HPA-2b等位基因特异性引物序列(5′—3′):TCCTGCCCCCAGGGCTCCTGAT,PCR产物长度51。 1.2.2 反应体系和反应条件
反应体系:SYBR Green PCR Master Mix试剂25 μL,引物(20 μmoL)各0.25 μL,模板DNA 2 μL,水22.25 μL。反应条件:95 ℃,预变性,10 min;然后,95 ℃,15S;60 ℃,1 min,共40个循环。在PCR反应体系中加入SYBR Green I荧光染料,实时荧光PCR结束后,应用ABI Primer 7300型荧光定量PCR仪默认的熔解曲线分析程序进行熔解曲线分析。熔解曲线分析程序:反应体系降温至60 ℃后,缓慢升温到90 ℃,收集此温度范围内的荧光信号,根据熔解曲线的Tm值的差异进行基因分型。 1.2.3 序列特异引物引导的PCR反应
(PCR-SSP,PCR-sequence specific primer )抽取30个DNA样本,按照文献[2]PCR-SSP法进行基因分型。 1.3 统计分析
采用直接计数法计算HPA-2a、2b的基因频率;采用χ2 检验进行Hardy-Weinberg平衡吻合度检验和不同地区的人群基因频率比较;运用SPSS 11.5 软件进行统计分析,P< 0.05 为差异有统计学意义。 2 结 果 2.1 熔解曲线分析(图 1,表 1)
本研究用实时荧光PCR对155个样本进行了扩增,经熔解曲线分析,基因型为HPA-2aa的样本熔解曲线呈现单一的峰型,Tm值为(85±1)℃(图 1A);基因型为HPA-2ab的样本熔解曲线呈现双峰型,Tm值分别为(80±1)℃和(85±1)℃(图 1B);基因型为HPA-2bb的样本熔解曲线呈现单一的峰型,Tm值为(80±1)℃(图 1C)。155例样本的HPA-2基因分型结果见表 1,经χ2检验,结果符合Hardy-Weinberg平衡定律,结果可靠。为了评价熔解曲线分析法的重复性,本研究对30个样本进行重复双样分析,2次结果完全一致。HPA-2基因型与基因型频率(n=155):aa131/155(0.845 1);ab22/155(0.141 9); bb2/155(0.012 9),等位基因频率a(0.916 1);b(0.083 8),Hardy-Weinberg吻合度检验χ2=0.904 2;P=0.341 6。
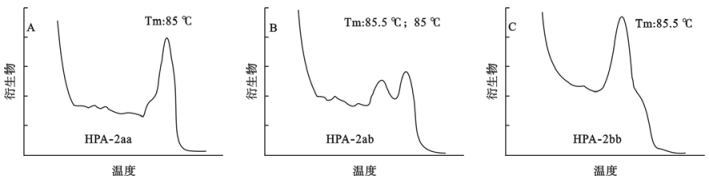 | 图 1 3例样本熔解曲线分析图谱 |
随机抽取30例DNA样本应用PCR-SSP法进行HPA-2系统基因分型,基因分型结果与熔解曲线分析法完全一致。 2.3 辽宁人群HPA-2等位基因频率与国内其他地区人群比较(表 1)
| 表 1 辽宁地区汉族人群HPA-2系统等位基因频率与其他地区人群比较 |
人类血小板抗原系统检测方法主要有2类,即血清学和基因分型法。血清学方法敏感性、特异性和重复性差,操作时间长,此外HPA抗血清来源困难,难以在临床实验室常规应用。随着分子生物学技术的发展,HPA的血清学方法已逐渐被基因分型方法取代。目前报道[2, 3, 4]的HPA基因分型方法有多种,其中PCR-SSP法是最为常用的方法,已被成功用于HPA-1~16的基因分型。但该法操作比较 繁琐、费时,易造成污染,引起实验的假阳性。为了克服PCR-SSP法的缺点,本研究应用熔解曲线分析法建立一种新的HPA-2系统基因分型方法。在HPA-2a等位基因特异性引物5′端增加了14bp长度的富含GC的碱基序列,这样HPA-2a扩增产物的GC含量要明显高于HPA-2b,经熔解曲线分析,HPA-2a扩增产物的Tm值在(85±1)℃,HPA-2b扩增产物的Tm值在(80±1) ℃。2者Tm差异高达5 ℃,因此很容易进行HPA-2的基因分型。熔解曲线分析法是一种可行的用于基因分型的新方法,因其操作简单、准确、快速,对样本无污染等优点而受到普遍关注,越来越多地应用于基因突变筛查、基因分型与甲基化分析等[5, 6, 7, 8, 9]。为了评价熔解曲线分析法的重复性和准确性,本研究同时进行重复性实验和常规PCR-SSP基因分型,结果表明该方法具有良好的准确性和重复性,简单、快速、准确、检测通量高等优点,优于常规的PCR-SSP方法。
本研究对155例献血者进行HPA-2等位基因多态性分析显示,辽宁地区汉族人群中HPA-2的等位基因分布以HPA-2a为主,高达0.9161,而HPA-2b很少,只占0.0838。辽宁地区汉族人群HPA-2系统的基因频率分布与南京汉族、上海汉族、新疆汉族、新疆维吾尔族人群分布几乎相同,但与海南黎族相比较差异有统计学意义,提示不同的种族间有一定的差异。研究结果不仅为汉族人类遗传学研究及人类的遗传和漂变研究提供了资料,也将对新生儿同种免疫血小板减少性紫癜和血小板输注无效等疾病的诊断、治疗及预防提供帮助。
| [1] | 刘建军,李志强.人类血小板抗原基础与临床研究进展[J].临床输血与检验,2007,7(3):281-285. |
| [2] | Feng ML,Liu D,Shen W,et al.Establishment of an HPA-1-to-16-typed platelet donor registry in China[J].Transfus Med,2006,16(5):369-374. |
| [3] | Lyou JY,Chen YJ,Hu HY,et al.PCR with sequence-specific primer-based simultaneous genotyping of human platelet antigen-1 to -13w[J].Transfusion,2002,42(8):1089-1095. |
| [4] | Tomicic M,Bingulac-Popovic J,Drazic V,et al.Frequency of HPA-15a and HPA-15b(Gov a/b)human platelet alloantigens in the Croatian population[J].Arch Med Res.,2006,37(1):172-174. |
| [5] | 何超,廖灿.高分辨熔解曲线分析技术及其在遗传学中的应用[J].中国优生与遗传杂志,2012,20(4):1-3. |
| [6] | 茅海燕,卢亦愚,陈寅,等.腺病毒荧光定量PCR快速检测方法建立[J].中国公共卫生,2010,26(1)95-96. |
| [7] | Er TK,Chang JG.High-resolution melting:applications in genetic disorders[J].Clin Chim Acta,2012,24(414):197-201. |
| [8] | 周薇,王汉平,谢健晋,等.高分辨熔解曲线法检测112例JAK2V6 1 7F基因突变及回顾性分析[J].临床血液学杂志,2012,25(7):449-450. |
| [9] | 李茹,廖灿,李东至,等.高分辨熔解曲线分析技术检测中国人常见β地中海贫血基因突变[J].中国优生与遗传杂志,2011,19(7):l9-21. |
 2013, Vol. 29
2013, Vol. 29


