2. 南京师范大学生命科学学院
猪链球菌( Streptococcus suis,S.suis)是重要的人畜共患病病原体,可致猪患脑膜炎、败血症、关节炎等病症;人类感染该菌,可致脑膜炎、败血症等,甚至导致病死率极高的链球菌中毒性休克综合症,严重危害人类健康〔1,2,3〕。目前尚无可预防S.suis感染的有效疫苗。课题组前期研究制备了锌转运蛋白A(ZnuA)重组蛋白并发现该蛋白具有良好的免疫原性〔4〕。本研究通过聚合酶链反应(PCR)检测znuA基因在不同血清型S.suis中的分布情况,对ZnuA蛋白进行细胞表面定位,观察重组ZnuA对Balb/c小鼠接种致死量2型猪链球菌(S.suis 2)菌株的免疫保护作用,为进一步研究S.suis 2亚单位疫苗奠定实验基础,现将结果报告如下。
1 材料与方法 1.1 材料 1.1.1 S.suis 2菌株98012、Habb为江苏患者分离株,05ZYH33为四川人源分离株,HA68为江苏猪源分离株(均为本实验室保存);7996和T15(荷兰Greeff教授惠赠);33株血清型标准参考株(加拿大Gottschalk教授惠赠);含表达质粒pET-32a: : znuA的E.coli BL21(DE3)宿主菌(本实验室保存)。
1.1.2 实验动物4周龄SPF级BALB/c小鼠20只,雌性, 体重13~14 g(军事医学科学院试验动物中心;动物合格证 号: SCXK-(军)2007-004)。
1.1.3 试剂PCR扩增试剂盒(大连TaKaRa公司);DNA胶回收试剂盒(美国Promega公司);DNA marker、protein marker(美国Fermenta公司);弗氏完全佐剂、弗氏不完全佐剂(美国Sigma公司);辣根过氧化物酶(HRP)标记山羊抗兔IgG(北京中杉金桥生物技术有限公司);diaminobenzidine(DAB)显色液(武汉博士德生物工程有限公司);底物O-phenylenedimaine(OPD)(南京大治生物技术有限公司);氨苄青霉素(ampicillin)和卡那霉素(kanamycin)(上海生物工程有限公司);其他试剂均为国产分析纯。
1.2 方法 1.2.1 不同血清型S.suis的znuA基因扩增根据05ZYH33菌株的基因组中znuA基因序列〔5〕设计合成引物。上游引物为5'-TCAGCTGCAACGAATCTTATC-3';下游引物为5'- TTAGTCCTTATCGGTTTCTT-3',引物由上海赛百盛生物技术公司合成。分别以不同血清型S.suis标准株、7996、T15以及S.suis 2国内分离株基因组为模板,采用PCR扩增znuA基因,预计扩增目的片段大小为837 bp。PCR程序为94 ℃ 5min;94 ℃ 30 s;56 ℃ 1 min;72 ℃ 90 s,共26个循环,最后72 ℃延伸10 min。1%琼脂糖凝胶电泳对PCR产物进行分析。
1.2.2 Western blot检测ZnuA蛋白表达(1)05ZYH33菌体蛋白抽提:挑取S.suis 2 05ZYH33单菌落接种于5 mL Todd- Hewitt broth(THB)液体培养基中,37 ℃振荡培养过夜。取细菌培养物1.5 mL,12000 r/min离心5 min,收集沉淀,超纯水洗涤3次。100 μL超纯水重悬,100 ℃水浴处理10 min。加入8 mmol/L尿素400 μL,10%SDS 400 μL,1 mmol/L二硫苏糖醇10 μL,4 ℃过夜处理。12 000 r/min离心5 min,收集上清。(2)蛋白免疫印迹Western blot:取抽提的05ZYH33细菌蛋白进行聚丙烯酰胺凝胶电泳,采用电转印法将蛋白转移至硝酸纤维素膜上,用5%脱脂奶粉37 ℃封闭1 h后,加1∶ 10 000稀释的兔抗ZnuA蛋白的血清,4 ℃过夜,加1∶ 1 000稀释的HRP标记山羊抗兔IgG,37 ℃孵育1 h,加底物DAB/H2O2显色。
1.2.3 流式细胞术分析取108菌落形成单位(cfu)的05ZYH33细菌,经0.01 mmol/L磷酸盐缓冲液(PBS,pH 7.4)洗3次后,悬于100 μL PBS中,加入兔抗ZnuA蛋白的多抗血清(1∶ 100),4 ℃静置1 h。0.01 mmol/L PBS洗3次后,悬于100 μL PBS中,并加入FITC-羊抗兔IgG(1∶ 50)4 ℃静置1 h。0.01 mmol/L PBS洗4次后,悬于500 μL PBS中,同时加入等量4%多聚甲醛固定30 min,流式细胞仪检测细菌荧光量。
1.2.4 小鼠免疫实验ZnuA重组蛋白按文献〔4〕制备,BALB/c小鼠20只分成实验组和对照组,每组10只。在接种05ZHH33菌株之前,实验组分3次注射ZnuA蛋白,对照组同步注射磷酸盐缓冲液(PBS)。免疫步骤如下:实验组每只小鼠皮下注射25 μg用弗氏完全佐剂乳化的ZnuA蛋白,每只100 μL。2周后,皮下注射25 μg用弗氏不完全佐剂乳化的ZnuA蛋白,每只100 μL。1周后,皮下注射25 μg用弗氏不完全佐剂乳化的ZnuA蛋白,每只100 μL。1周后,实验组和对照组分别腹腔接种108 cfu的05ZYH33各1 mL。
2 结果 2.1 不同血清型S.suis的znuA基因分布(图 1)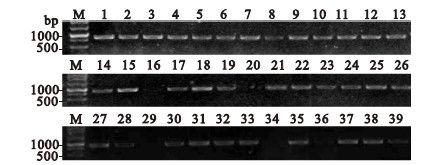 | 注: M: 250 bp DNA Marker;1: 1/2血清型;2~6: 1~5血清型;7 ~ 11: 7~11血清型;12~33: 12~33血清型;34:阴性对照;35: 7996 株;36: T15株;37: HAbb株;38: 98012株;39: HA68株。 图 1不同血清型S.suis的znuA基因分布 |
PCR扩增结果显示,在所有被检的菌株中,除血清型17、21和30型菌株及荷兰分离株T15菌株外,其他30个血清型S.suis菌株、 7996菌株以及4株S.suis 2型国内分离菌株基因组中均扩增到837 bp目的条带,表明znuA基因广泛存在于大多数血清型S.suis中。
2.2 ZnuA蛋白表达(图 2)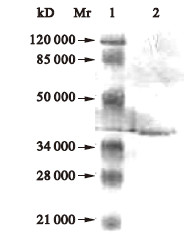 | 注: 1:蛋白Marker;2:细菌05ZYH33蛋白。 图 2细菌蛋白免疫印迹 |
采用Western blot检测菌体ZnuA蛋白,结果显示,05ZYH33细菌蛋白能与兔抗ZnuA蛋白血清发生反应,在蛋白分子量大小约为36 000 Da处有1条明显条带,表明05ZYH33细菌蛋白与兔抗ZnuA蛋白的血清能发生特异性反应,ZnuA是一个05ZYH33菌体中表达的蛋白。
2.3 细胞表面定位(图 3)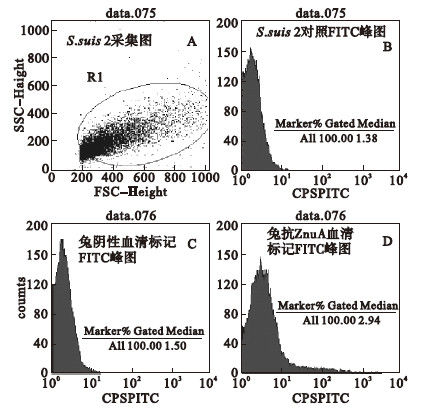 | 注: A:未标记对照S.suis 2采集图;B:未标记对照S.suis 2 平均荧光强度;C:兔阴性血清标记S.suis 2平均荧光强度; D:兔抗ZnuA血清标记S.suis 2平均荧光强度。 图 3 ZnuA的流式细胞术定位 |
采用流式细胞术对ZnuA蛋白进行细胞定位。结果显示,兔抗ZnuA血清标记S.suis 2的平均荧光强度明显高于兔阴性血清标记S.suis 2和未标记对照S.suis 2的平均荧光强度,表明ZnuA是一个存在于S.suis 2菌体表面的蛋白。
2.4 小鼠免疫保护作用在接种108 cfu 05ZYH33菌12 h后,对照组小鼠死亡8只,ZnuA重组蛋白免疫小鼠死亡1只;24 h后,对照组小鼠全部死亡,死亡率100%;ZnuA重组蛋白免疫小鼠死亡4只,死亡率40.00%,其余生存状态良好,存活> 7 d。2组小鼠24 h存活率差异有统计学意义(P < 0.001)。表明ZnuA重组蛋白对Balb/c小鼠有一定免疫保护作用,可作为S.suis亚单位疫苗的侯选分子。
3 讨论研究表明,虽然青霉素能够成功治疗大部分S.suis感染病例,但越来越多S.suis青霉素抗性菌株被分离出来,而且长期使用抗生素会使一些S.suis菌株产生抗药性[2,6-8],因此研制疫苗是控制S.suis感染的重要手段。目前尚无人用猪链球菌疫苗,甚至也无有效的可用于猪的疫苗。本课题组近年来在猪链球菌疫苗的研究方面进行了一系列工作,发现了一些具有免疫保护作用的猪链球菌菌体蛋白分子〔9,10,11,12,13〕。
猪链球菌ZnuA是新近发现的具有亚单位疫苗开发前景的细菌表面蛋白〔4,5〕。通过对S.suis 2中国强毒株05ZYH33进行全基因组序列测定并进行基因组功能注释,生物信息学分析发现基因组中的含有高亲和力锌ABC转运蛋白组分编码基因znuA(Ssu05_2086)。同源比对发现,该编码基因与多种细菌的锌ABC转运蛋白编码基因具有较高的序列同源性〔5〕。韩明月〔4〕从S.suis 2中国强毒株05ZYH33中克隆表达出ZnuA重组蛋白,并利用His亲和层析获得较高纯度的蛋白,Western blot分析结果证实,ZnuA重组蛋白与S.suis 2感染猪恢复期血清能发生特异性反应,表明ZnuA具有良好的免疫原性,是一种在S.suis 2感染过程中表达的蛋白。本研究结果表明,znuA基因广泛存在于不同血清型的S.suis中,ZnuA是不仅是一个S.suis 2菌体中表达的蛋白,还是是一种菌体表面蛋白。动物免疫实验结果表明,ZnuA重组蛋白对Balb/c小鼠具有良好的免疫保护作用,ZnuA可作为一个亚单位疫苗候选分子。本研究为进一步研究ZnuA在S.suis致病过程中的作用机理以及S.suis疫苗的研究提供依据。
| 〔1〕 | Staats JJ,Feder I,Okwumabua O,et al.Streptococcus suis:past and present[J].Vet Res commun,1997,21(6):381-407. |
| 〔2〕 | Gottschalk M,Segura M,Xu J.Streptococcus suis infections in humans:the Chinese experience and the situation in North America [J].Anim Health Res Rev,2007,8(1):29-45. |
| 〔3〕 | Tang JQ,Wang CJ,Feng YJ,et al.Streptococcal toxic shock syndrome caused by Streptococcus suis serotype 2[J].PLoS Medicine,2006,3(5):e151. |
| 〔4〕 | 韩明月,潘秀珍,邵珠卿,等.2型猪链球菌中国强毒株znuA基因的原核表达及免疫学活性分析[J].免疫学杂志,2010,26(3):220-223. |
| 〔5〕 | Chen C,Tang J,Dong W,et al. A glimpse of streptococcal toxic shock syndrome from comparative genomics of S. suis 2 Chinese isolates[J].PLoS One,2007,2(3): e315. |
| 〔6〕 | Gottschalk M,Xu J,Calzas C,et al.Streptococcus suis:a new emerging or an old neglected zoonotic pathogen?[J].Future Microbiol,2010,5(3):371-391. |
| 〔7〕 | Straw BE,D'Allaire S,Mengeling WL.et al.Diseases of swine Ames[M].IA:Iowa State University,2005,769-783. |
| 〔8〕 | Huang YT,Teng LJ,Ho SW,et al.Streptococcus suis infection[J].Journal of Microbiology,Immunology and Infection,2005,38(5): 306-313. |
| 〔9〕 | Shao Z,Pan X,Li X,et al.HtpS,a novel immunogenic cell surface exposed protein of Streptococcus suis,confers protection in mice[J]. FEMS Microbiol Lett,2011,314(2):174-182. |
| 〔10〕 | Feng Y,Pan X,Sun W,et al.Streptococcus suis enolase functions as a protective antigen displayed on the bacterial cell surface[J].J Infect Dis,2009,200(10):1583-1592. |
| 〔11〕 | Ge J,Feng Y,Ji H,et al.Inactivation of dipeptidyl peptidase IV attenuates the virulence of Streptococcus suis serotype 2 that causes streptococcal toxic shock syndrome[J].Curr Microbiol,2009,59(3):248-255. |
| 〔12〕 | Pan X,Ge J,Li M,et al.The orphan response regulator CovR:a globally negative modulator of virulence in Streptococcus suis serotype 2[J].J Bacteriol,2009,191(8):2601-2612. |
| 〔13〕 | Liu L,Cheng G,Wang C,et al.Identification and experimental verification of protective antigens against Streptococcus suis serotype 2 based on genome sequence analysis[J].Curr Microbiol,2009,58(1):11-17. |
 2012, Vol. 28
2012, Vol. 28


