2. 中山大学公共卫生学院;
3. 广东出入境检验检疫局
单增李斯特菌的传统鉴定方法主要是进行生化反应,辅以溶血实验和小鼠毒力试验。这些传统鉴定方法操作复杂、耗时长,鉴定结果易受各种因素影响。近年来各种分子生物学方法开始逐步应用于李斯特菌的检测和鉴定[1-7],其中适用于细菌鉴定的方法只有脉冲电场凝胶电泳(PFGE)法、随机扩增DNA多态性(RADP)法、测序法,但由于操作比较繁琐、操作技术和分析能力要求较高,在实际检测中应用并不多。英国沃特曼(Whatman)公司的专利纸片-FTA卡是一种方便保存、提取和转移DNA的新技术手段,能有效地减少微生物检测中的生物安全问题[8, 9],开始受到微生物学专家的重视。本研究利用FTA卡-16S rRNA基因测序技术鉴定食品中李斯特菌,探讨其应用于实际样品检测中的可能性。结果报告如下。
1 材料与方法 1.1 材料 1.1.1 菌株(1) 标准菌株:10株,其中单增李斯特菌4株,菌株号ATCC 7644;英诺克李斯特菌2株,菌株号ATCC 33090;西尔氏李斯特菌、威尔斯李斯特菌、格氏李斯特菌各1株,菌株号分别为ATCC 735967,ATCC 35897,ATCC 25401;绵羊李斯特菌1株,菌株号ATCC 19119。(2)单增李斯特菌参考菌株1株,菌株号54002;能力验证菌株3株,其中单增李斯特菌、英诺克李斯特菌、威尔斯李斯特菌各1株,菌株号分别为T018,T33,T48。(3)分离菌株:26株,其中单增李斯特菌7株;英诺克李斯特菌8株;西尔氏李斯特菌4株;威尔斯李斯特菌4株;格氏李斯特菌2株,绵羊李斯特菌1株(以上菌株分别来自美国MBL公司,中国普通微生物菌种保藏中心,中山大学公共卫生学院,广东环凯生物科技有限公司,广东、中山、江门检验检疫局技术中心及本实验室);每个菌株均选取2个菌落分纯后进行平行测定。
1.1.2 试剂和仪器(1) 主要试剂:FTA卡、FTA纯化试剂(英国Whatman公司);Ex Taq DNA聚合酶、dNTP、PCR缓冲液等PCR试剂、Tris-乙二胺四乙酸二钠盐(EDTA)三羟甲荃氨基甲烷-乙二胺乙酸二钠(TE)缓冲液(10 mmol/L Tris-HCl,1 mmol/L EDTA,pH 8.0)(大连宝生物工程有限公司)。上游引物:5'-TGGAGAGTTTGAT CCTGGCTCAG-3'(对应16S rRNA基因的第5~27个碱基);下游引物:5'- TACCGCGG CTGCTGGCAC-3'(对应16S rRNA基因的第532~515个碱基)[10] 均由大连宝生物工程有限公司合成。(2)主要仪器:2400 PCR仪(美国应用生物系统公司)。
1.2 方法 1.2.1 DNA提取挑取单个菌落进行纯培养后,制成1×107/ml~10×107/ml范围的菌悬液,吸取100 μl,滴在FTA卡上,室温下干燥1 h以上;用打孔器取直径约2 mm的FTA纸片于1.5 ml离心管中;加入200 μl FTA纯化试剂,稍加混匀后室温下静置5 min,吸去FTA纯化试剂,再加入200 μl FTA纯化试剂重复洗2次。加入200 μl TE缓冲液,稍加混匀后室温下静置5 min,吸去TE,再加入200 μl TE重复洗1次。吸去TE后,56 ℃干燥15~20 min(或于室温下过夜干燥)。此干燥纸片用于PCR反应。
1.2.2 PCR扩增鉴定及测序PCR反应体系:10×PCR缓冲液3 μl,dNTP混合液(各2.5 mmol/L)2 μl,上、下游引物各1 μl,DNA模板1个纸片(直径2 mm),灭菌去离子水10.9 μl,Ex Taq酶0.1 μl。反应条件:95 ℃ 5 min →(95 ℃ 30 s,54 ℃ 30 s,72 ℃ 45 s)×40→72 ℃ 10 min。1%琼脂糖凝胶电泳,溴化乙锭(EB)溶液中染色,凝胶成像系统下观察DNA条带。若有500 bp左右的条带,说明PCR扩增成功。扩增成功的PCR产物由大连宝生物工程有限公司完成纯化与测序。
1.3 测序比对分析采用在线序列比对程序美国国家生物信息中心(NCBI)的BLAST程序[11]和核糖体数据库计划(RDP)Seqmatch程序[12]2种比对程序进行16S rRNA基因序列的同源性比对。
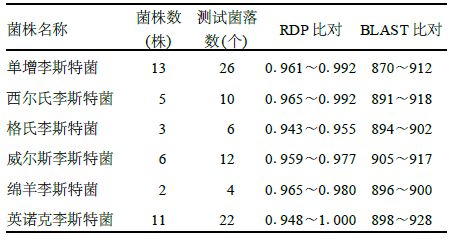
2 结果 2.1 实验菌株测序结果比对分析(表 1)结果表明,本次实验40个菌株的80个菌落通过RDP程序和BLAST程序均得到了正确的结果。
| 表 1 40株菌株测序结果比对分析 |
3 讨论
FTA卡是英国Whatman公司的专利产品,由于具有保存方法简单、无需冷藏、提取简单、保存期限长等优点,最近开始逐渐地应用于各种微生物或其他生物体DNA样本的保存和鉴定[8, 9]。本研究使用Whatman公司专用的FTA纯化试剂,无需加热、离心装置,即可将DNA纯化;这是所有其他DNA纯化方法无法比拟的。
本研究表明,应用2种在线序列比对软件的结果完全一致。由于RDP程序是一个专门用于核糖体序列比对的在线软件,它得出的比对结果更直观、清晰,而且运行时间也比BLAST快很多,适合于细菌鉴定中应用。而BLAST软件是一个通用的序列比对软件,由于数据库庞大,程序运行时间相对长一些,但最后提供的序列信息非常充分,适合进行分子分型研究。
由于李斯特菌属中种比较少,而且序列研究比较充分,数据库也比较齐全,因此,应用效果非常好,完全可作为一种鉴定方法在实际工作中应用。但由于16S rRNA基因在种内具有较高的保守性,无法区分亚种以下的分类单位。如需要进行亚种分型,可以考虑利用16S ~23S rRNA基因区隔区的多态性[13]。
| [1] | 王芳, 金莉莉, 王秋雨, 等. ERIC_PCR方法鉴定单核细胞增生性李斯特氏菌研究[J]. 辽宁大学学报:自然科学版, 2002, 29(2) : 155–158. |
| [2] | 金大智, 谢明杰, 曹际娟. 食品中单增李氏菌实时荧光PCR检测鉴定方法的建立[J]. 辽宁师范大学学报:自然科学版, 2003, 26(1) : 73–76. |
| [3] | 姜永强, 雷祚荣, 李瑾, 等. PCR与微孔板杂交结合检测单核细胞增多性李斯特氏菌[J]. 中华微生物学和免疫学杂志, 1998, 18(1) : 66–67. |
| [4] | 刘毅, 韩金祥, 黄海南, 等. 应用基因芯片技术检测20种病原菌的探讨[J]. 中华检验医学杂志, 2003, 26(10) : 629. |
| [5] | 王颖, 陈敏, 顾其芳, 等. 应用PFGE对单核细胞增生李斯特氏菌基因分型的方法探索[J]. 中国卫生检验杂志, 2002, 12(5) : 523–525. |
| [6] | 金莉莉, 王秋雨, 王海鹏. 单核细胞增生性李斯特氏菌种?株随机扩增DNA多态性研究[J]. 中国人兽共患病杂志, 2003, 19(6) : 38–41. |
| [7] | 杨霞, 剡根强. 李斯特氏菌的各种分型方法在其流行病学调查中的应用[J]. 石河子大学学报:自然科学版, 2004, 62(3) : 267–272. |
| [8] | 张守发, 于龙政, 刘冰. FTA纸片中保存的马巴贝虫DNA的PCR检测[J]. 中国兽医科学, 2006, 36(8) : 647–649. |
| [9] | 刘景武, 张伟, 何俊萍, 等. FTA滤膜用于PCR检测肉中的金黄色葡萄球菌[J]. 生物工程学报, 2005, 21(6) : 1010–1013. |
| [10] | Leslie Hall, Kelly A Doerr, Sherri L Wohlfiel, et al. Evaluation of the MicroSeq system for identification of mycobacteria by 16S ribosomal DNA sequencing and its integration into a routine clinical mycobacteriology laboratory[J]. Journal of Clinical Microbiology, 2003, 41(4) : 1447–1453. DOI:10.1128/JCM.41.4.1447-1453.2003 |
| [11] | Basic Local Alignment Search Tool (BLAST)[CP/OL].http://www.ncbi.nlm.nih.gov/blast/Blast.cgiPAGE=Nucleotides&PROGRAM=blastn&MEGABLAST=on&BLAST_PROGRAMS=megaBlast&PAGE_TYPE=BlastSearch&SHOW_DEFAULTS=on. |
| [12] | Ribosomal Database Project Ⅱ Seqmatch-Start[CP/OL].http://rdp.cme.msu.edu/seqmatch/seqmatch_intro.jsp. |
| [13] | 杨文敏, 何敏. 5种食源致病菌16SrRNA基因单链构象多态性分析[J]. 中国公共卫生, 2002, 18(12) : 1427–1428. |
 2008, Vol. 24
2008, Vol. 24