细胞毒性T细胞(CTL)能特异性杀伤病毒感染细胞并分泌IFN-γ等炎性细胞因子,在抗病毒感染的免疫应答中发挥重要作用。国外研究发现,CTL应答是感染人类免疫缺陷病毒I型(HIV-1)急性期最早能检测到的HIV-1特异性免疫应答,对于控制HIV-1病毒血症有重要作用,而在HIV-1感染慢性期,对CTL控制疾病进展作用的报道并不一致[1, 2]。国外报告的病例多为非洲和欧美人群,使用的多肽抗原为欧美流行B亚型、C亚型、AE重组亚型等。本室前期用B亚型多肽抗原对我国感染者CTL功能检测结果显示,我国HIV-1感染者特异性CTL能够识别不同Gag多肽,HIV-1特异性CTL功能与疾病进展相关[3]。由于我国主要流行毒株为HIV-1B'、B'/C亚型,与国外主要流行亚型不同,研究中国人群针对国内主要流行毒株的特异性CTL应答有助于了解我国HIV-1感染者的免疫应答特征和细胞免疫在控制HIV-1复制、延缓疾病进程中的重要作用,并为研制适用我国人群的疫苗提供实验依据。为此,我们于2006年1~3月对58名HIV-1感染者的HIV-1B'Gag特异性CTL应答进行了相关研究,以评价中国HIV-1感染者的CTL功能与疾病进展的关系。
1 对象与方法 1.1 对象由中国医科大学艾滋病(AIDS)研究所艾滋病确认实验室经蛋白印记试剂盒(新加坡Genelab公司)确认为阳性的HIV-1感染者58例。收集HIV-1感染者乙二胺四乙酸抗凝全血20 ml,菲科帕克密度梯度离心法提取外周血单个核细胞(PBMC)。所有标本均在未接受抗病毒治疗前采集。根据HIV-1感染者CD4+T细胞数量和感染时间分组。疾病长期不进展者(LTNP组):CD4+T淋巴细胞≥500×106/L,感染HIV 10年以上,未经抗病毒治疗,无艾滋病指征性疾病;无症状HIV感染者(HIV组):除LTNP以外,CD4+T淋巴细胞≥200×106/L,无艾滋病指征性疾病;AIDS期患者(AIDS组):CD4+T淋巴细胞<200×106/L或有艾滋病指征性疾病。
1.2 方法 1.2.1 HIV-1B'重叠多肽合成HIV-1B'Gag全长的54个重叠多肽(西安联美公司),每个多肽长15~22个氨基酸,相邻多肽间重叠10个氨基酸。
1.2.2 酶联免疫斑点实验(ELISPOT)测定CTL应答采用ELISPOT试剂盒(美国BD公司)测定。用抗γ-干扰素-捕获抗体包被聚偏氟乙烯膜96孔板,每孔加入100 μl浓度为2~3×106/ml的HIV-1感染者PBMC,同时每孔加入1条HIV-1B'Gag多肽;阳性对照孔加入植物血凝素作为质控,阴性对照孔加入完全培养基,37℃,5% CO2孵育20~24 h。加入生物素标记的检测抗体,室温孵育2h后加入辣根过氧化酶标记的链菌亲和素,1h后加入底物,30min后终止反应。经ELISPOT分析仪(美国CTL公司)读取孔中斑点个数,减去阴性对照孔的数值后根据孔中细胞浓度计算每106个PBMC中点形成细胞个数(spot forming cells,SFC),结果为点形成单位(spot forming unit,SFU)。SFU高于阴性对照x±2s,且绝对值高于50SFC/106 PBMC以上为阳性。对反应宽度(引起每个HIV-1感染者发生特异性CTL应答的肽段个数)和反应强度(每个HIV-1感染者各个阳性孔中SFU数值之和)2项指标进行比较分析。
1.2.3 CD4+T细胞绝对计数将20 μl CD4/CD8/CD3三色单抗(美国BD公司)加入绝对计数管中,加入50 μl抗凝全血,室温避光15min,加入免洗溶血素450 μl,室温避光15min,用流式细胞仪(FACSCalibor,美国BD公司)检测,MULTISET软件进行自动分析,计算CD4+、CD8+、CD3+淋巴细胞绝对值及相应比值等。
1.2.4 病毒载量测定以200 μl血浆采用标准版模板制备法提取RNA,用COBASAMPLICOR自动载量仪(美国Roche公司)RT-PCR方法测定病毒载量。检测范围为400~750 000拷贝/ml。
1.3 统计分析采用SPSS 13.0统计软件进行统计分析。用Kruskal-Wallis Test进行多组间的均值比较。用Spearman相关系数比较反应强度及反应宽度与CD4+T细胞绝对计数及HIV-1 RNA病毒载量的相关性。
2 结果 2.1 中国HIV-1感染者CTL对不同HIV-1B' Gag多肽的应答(表 1)58名患者中,75.0%识别p17;86.7%识别p24;75.0%识别p2p7p1p6;各患者对于多肽的识别情况不同,其中对p24-19和p17-05的识别百分率最高,分别为43.10%和41.38%。
| 表 1 中国HIV-1感染者CTL对不同HIV-1B' Gag表位发生应答情况 |
2.2 中国HIV-1感染者CTL识别HIV-1B'Gag表位的相关性
中国HIV-1感染者对HIV-lB'多肽发生特异性CTL应答的反应宽度与病毒载量呈显著负相关(r=-0.374,P=0.004);与CD4+T淋巴细胞绝对计数呈显著正相关(r=0.425,P=0.001);HIV-1感染者识别HIV-1B'多肽的反应强度与病毒载量呈显著负相关(r=-0.285,P=0.030);与CD4+T淋巴细胞绝对计数呈正相关趋势(r=0.159,P>0.05),但差异无统计学意义。
2.3 不同进程HIV-1感染者CTL反应宽度和反应强度比较(图 1)将全部病例按照疾病进展程度分为3组:LTNP组、HIV组、AIDS组。经Kruskal-Wallis Test显示,3组之间识别HIV-1B'多肽发生特异性T细胞应答的反应宽度为LTNP组>HIV组>AIDS组,其中长期不进展者反应宽度显著高于其他2组(P=0.001,P=0.005);3组之间识别HIV-1多肽的反应强度亦为LTNP组>HIV组>AIDS组,但差异无统计学意义。
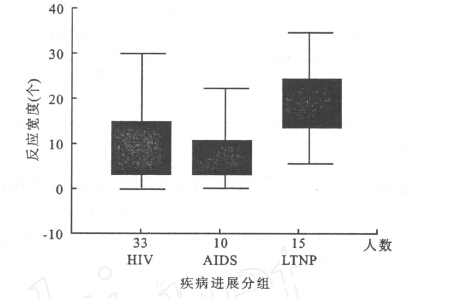
|
图 1 不同疾病进程HIV-1感染者识别HIV-1B'Gag表位反应宽度 |
2.4 中国健康人群CTL对不同HIV-1B'Gag表位的应答
6例健康对照中未发现对HIV-1B'Gag多肽表位的特异性反应。
3 讨论本研究结果显示,58名中国HIV-1感染者中75%识别中国流行B'亚型的p2p7p1p6,75%识别p17,86.7%识别p24;对p17、p24和p2p7p1p6的总体识别比例与国外研究结果相似[4]。各多肽被识别的情况不同,近半数病例识别p24-19和p17-05,提示这2条多肽中可能含有中国主要流行毒株HIV-1B'特异性的CTL优势表位,为研制适用中国人群的HIV疫苗提供了理论基础。
研究结果显示,在HIV-1感染慢性期,CTL应答与CD4+T细胞计数正相关,而与病毒载量负相关,与国外研究对病毒载量相关性的报道不一致[5-7]。本研究测定中国HIV-1感染者针对中国主要流行毒株HIV-1B'亚型Gag多肽的特异性CTL应答,发现反应宽度和反应强度均与血浆病毒载量显著负相关。抗原表位-主要组织相容性复合物分子复合体与T细胞受体结合存在特异性,中国主要的流行毒株不同于国外流行毒株[8, 9],中国人群人类白细胞抗原基因分布频率与国外人群不同,CTL和病毒表位结合存在差异,发生免疫应答的规律可能不同,与国外研究结果不一致,可能与实验所用的HIV-1多肽抗原亚型和研究对象种族不同有关。
本研究对处于疾病进展不同阶段的中国HIV-1感染者CTL识别HIV-1B,多肽的反应宽度和强度进行了比较,发现中国人群识别HIV-1B'Gag多肽的反应宽度、反应强度与病毒载量呈显著负相关;反应宽度与CD4+T淋巴细胞计数显著正相关;长期不进展者识别HIV-1B'Gag多肽的反应宽度显著高于无症状HIV感染者和AIDS患者。提示随着HIV-1B'Gag特异性CTL功能下降,HIV-1感染者病程进展,保持较高水平的反应宽度和反应强度可能对维持疾病不进展有重要意义,HIV-1B'Gag多肽表位的特异性CTL应答对延缓疾病进程有保护作用。
| [1] | A1tfeld M, Rosenberg ES, Shankarappa R, et al. Cellular immune responses and viral diversity in individuals treated during acute and early HIV-1 infection[J]. J Exp Med, 2001, 193 : 169–180. DOI:10.1084/jem.193.2.169 |
| [2] | Gea Banacloche JC, SA Migueles, L Martino, et al. Maintenance of large numbers of virus specific CD8+T cells in HIV-infected progressors and long-term nonprogressors[J]. J Immunol, 2000, 165 : 1082–1092. DOI:10.4049/jimmunol.165.2.1082 |
| [3] | 尚红, 韩晓旭, 王亚男, 等. HIV/AIDS患者特异性细胞毒性T细胞功能的研究[J]. 中华微生物学和免疫学杂志, 2003, 23(9) : 696–699. |
| [4] | Yu XG, Shang H, Addo M, et al. Important contribution of p15 Gag-specific responses to the total Gag-specific CTL responses[J]. AIDS, 2002, 16 : 32l–328. |
| [5] | Edwards BH, A Bansal, S Sabbaj, et al. Magnitude of functional CD8+T-cell responses to the Gag protein of human immunodeficiency virus type 1 correlates inversely with viral load in plasma[J]. J Virol, 2002, 76(5) : 2298–2305. DOI:10.1128/jvi.76.5.2298-2305.2002 |
| [6] | Stephen A Migueles, Mark Connors. Frequency and function of HIV-specific CD8+T cells[J]. Immunology Letters, 2001, 79 : 141–150. DOI:10.1016/S0165-2478(01)00276-0 |
| [7] | Barouch DH, S Santra. Control of viremia and prevention of clinical AIDS in rhesus monkeys by cytokine-augmented DNA vaccination[J]. Science, 2000, 290 : 486–492. DOI:10.1126/science.290.5491.486 |
| [8] | 邢爱华, 邢辉, 李翔, 等. 陕西省HIV-I流行毒株亚型分析[J]. 中国公共卫生, 2007, 23(9) : 1044–1046. |
| [9] | 韩晓旭, 卢春明, 周立平, 等. 辽宁省HIV-1株的基因序列测定和亚型分析[J]. 中国公共卫生, 2003, 19(11) : 1312–1313. |
 2008, Vol. 24
2008, Vol. 24


