吸烟是肺癌发生的重要危险因素[1],吸烟者肺癌的发病率是不吸烟者的十几倍[2]。肺癌的发病率与烟草消耗量有明显的相关性,但至今烟草诱发肺癌的机制、作用靶点及关键步骤仍未能阐明。本研究通过检测与易受环境因素影响肿瘤原癌基因K-ras基因和抑癌基因人类脆性组氨酸三联体(FHIT)基因,分析肺癌患者K-ras基因点突变和FHIT基因转录异常与吸烟关系,从基因水平探讨吸烟诱发肺癌的可能机制及作用靶点,以便寻找更有效的防治手段,为肺癌的预防及早期诊断、早期治疗提供依据。
1 对象与方法 1.1 对象随机选取山东大学齐鲁医院胸外科2004年1月~2005年12月手术治疗的肺癌患者80例。全部患者术前均未经任何化疗和放疗,且术后经病理检查证实诊断;随机选取20例同期术中采集的正常肺组织标本作为正常对照组。
1.2 方法 1.2.1 标准采集对每位患者的吸烟情况及临床病理特征均进行详细记录。标本采集于术中,分别切取肺癌组织及不在同一肺叶的正常边缘肺组织各1小块,液氮内速冻,-80℃深低温冰箱保存。
1.2.2 K-ras基因突变的检测 1.2.2.1 DNA抽提及模板制备取冷冻新鲜组织25g,研碎后用生理盐水(NS)洗涤后,加入细胞裂解液300l,加入50~100l核糖核酸酶A混匀,37℃1~2h加入蛋白酶K100g管,56℃2h以上;酚、氯仿各抽提一遍;加入1/2体积的3mol/L乙酸钠和2倍体积的无水乙醇混匀20℃1h以上。15000r/min离心10min,沉淀加无水乙醇洗一遍,取DNA产物电泳鉴定观察DNA完整性。
1.2.2.2 PCR扩增目标片断扩增引物由上海博亚生物工程公司合成,按参考文献[3]K-ras基因的引物序列设计如下:P1上游引物:5'-CATGTTCTAATATAGTCACA-3';P2下游引物:5'-CAAGGCACTCTTTGCCTACGGC-3'。取每10~20l/DNA产物作为模板,反应体系为10×buffer 5l,MgCl23l,核苷三磷酸1l,基因引物P1和P2各50mol/Ll,Taq 2l,DNA10l,无菌去离子水DDW39l,ddH2O定容至50l,封以石蜡油50l。扩增条件为:94℃预变性5min,循环程序:94℃变性30s,52℃退火1min,68℃延伸1min,共30个循环,72℃延伸7min。取扩增产物电泳,观察110bp目标条带,以证实扩增成功。
1.2.2.3 限制性片断长度多态性分析(RFLP)检测K-ras基因第12位密码子点突变取PCR产物20l,加入buffer 3l,BanI酶20U/2l混匀后煮37℃恒温水浴酶切过夜。取10l酶切产物与2l缓冲液混匀加入加样孔聚丙烯酰胺电泳。
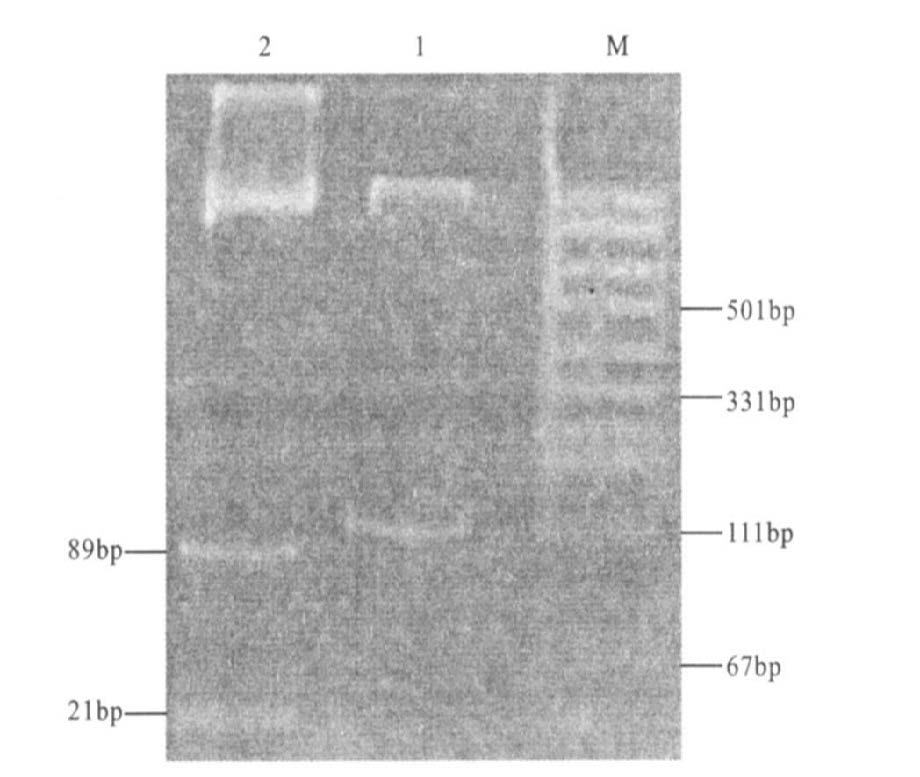
1.2.2.4 实验结果判定由于野生型K-ras基因第一外显子第12密码子存在着酶切位点,经限制性内切酶酶切后,成为89和21bp2个片断,电泳表现为2个条带,而突变型K-ras基因序列中丧失BanI酶切位点,无法切成2个条带,酶切电泳后仍为110bp1个条带。
1.2.3 FHIT基因转录异常的检测 1.2.3.1 总RNA提取取每份标本的冷冻新鲜组织100mg,移入组织匀浆器中,加入异硫青硫胍(GIT)变性液600l匀浆后吸取500l至Eppedorf管中,按说明书经氯仿抽提,异丙醇离心沉淀出总RNA溶于去离子水中,测量吸光度(A)值,即可直接用于RT-PCR或于-80℃保存备用。
1.2.3.2 FHIT基因引物设计与合成引物均由上海博亚生物工程公司合成,根据Genebank Database提供的FHIT基因全长cDNA序列,引物设计如下:外引物:Exonl-10;5U2(F) 5'-CATCCTGGAAGCTTTGAAGCTCA-3';3D2(R) 5'-TCACTGGTTGAAGAAGAATACAGG-3'。内引物:Exon3-10;5U1(F) 5'-TCCGTAGTGCTATCTACAT-3;3D1(F)5'-CATGCTGATTCAGTTCCTCTTGG-3'。
1.2.3.3 FHIT基因cDNA的合成及电泳鉴定(RT-PCR)取组织总RNA提取物1g加入经焦碳酸乙二酯(DEPC)处理的0.5ml Eppedorf管中,再依次加入以下试剂:反转录酶1l,逆转录反应体系7l,下游引物3D2 1l,去Rnase水补至20l。离心混匀37℃1h,95℃10min灭活反转录酶,快速离心使蒸气沉于管底。在以上RT产物20l的0.5ml Eppedorf管中加入以下试剂构成PCR体系:10×buffer 10l、MgCl2 6l、dNTP 2l、上游引物5U2 1l、Taq2.5U/0.5l、超纯水60.5l。快速离心混匀;95℃5min,冰浴冷却,然后快速离心使蒸气沉于管底,加入2l TaqDNA聚合酶,快速离心混匀,加入60l液体石蜡。循环条件为94℃1min,58℃1min,72℃1min,共30个循环,72℃延长7min。将扩增产物稀释20倍,取4l进行第2轮PCR,引物为5U1和3D1,反应体系同第1轮PCR。取10l第2轮PCR产物进行电泳并溴化乙锭(EB)染色拍照。
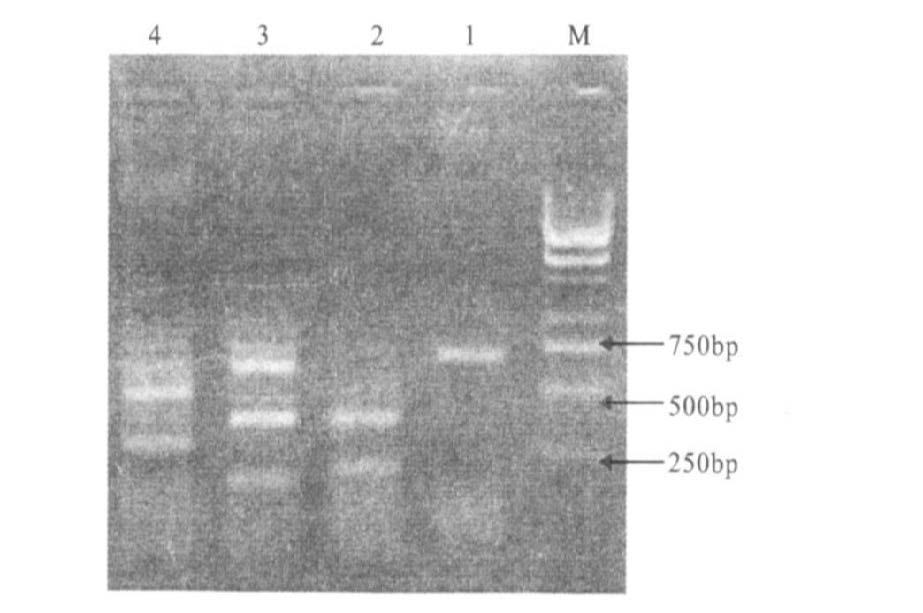
1.2.3.4 FHIT基因转录异常的判断正常FHIT基因转录本长约700bp,电泳结果显示700bp1个条带,当FHIT基因缺失时,电泳可见多个大小不等的RNA转录本条带,多集中在400~250bp附近,当FHIT基因纯合性缺失时,标本无任何转录本扩增处,电泳图缺乏上述各种条带。
1.3 统计分析应用SAS 6.0统计软件进行x2检验。
2 结果 2.1 基本情况肺癌患者共计80例,男58例,女22例;年龄33~74岁。病理类型:鳞癌(SCC)41例,腺癌(ACC)29例,小细胞肺癌(SCLC)6例,大细胞肺癌(LCLC)4例;TNM分期(按MICC1997年标准)I期19例,II期33例,III期26例,IV期2例。有吸烟史54例,吸烟指数(BI=每天吸烟支数×吸烟年数)为110~950,平均为465。不吸烟患者为从未吸烟,不包括曾吸烟已忌烟者。
2.2 肺癌与肺正常组织K-ras、FHIT基因异常的比较80例肺癌标本中42例存在K-ras基因12密码子点突变(图 1),突变率为52.58%,57例标本存在FHIT基因转录异常(图 2),缺失率为71.25%,而正常肺组织未见K-ras基因点突变和FHIT基因转录异常,2组比较差异均有统计学意义(P<0.05)。
|
注:pUC19DNA+/MspI(HpaII)Marker;1:突变型K-ras丧失酶切点为110bp条带;2:野生型K-ras存在酶切位点,被切成21和89bp片断,显示为2个条带。 图 1 K- ras 基因电泳图 |
|
注:GeneRuler 1kb DNA marker;1:正常FHIT基因转录本700bp条带;2,3,4:FHIF基因异常转录本为大小不等的片断,多位于400~250bp之间,其中3仍可见700bp左右的正常条带及其他异常条带。 图 2 FHIT基因电泳图 |
2.3 吸烟对肺癌患者K-ras、FHIT基因异常的影响(表 1,2)
吸烟组肺癌患者的K-ras基因点突变率、FHIT基因异常转录率明显高于不吸烟组,2组比较差异有统计学意义(P<0.05)。进一步分析吸烟组患者吸烟指数(BI)与K-ras基因点突变、FHIT基因异常转录的关系,列联表x2检验显示肺癌患者K-ras基因突变、FHIT基因异常转录与BI相关联,Pearson列联系数(P)分别为0.337和0.399;两两比较显示,不同BI组之间的K-ras基因点突变率比较差异均有统计学意义(P<0.05),而FHIT基因异常转录率则在BI>200时即明显升高(P<0.05),高达90.48%。
| 表 1 吸烟与肺癌患者K-ras基因突变、FHIT基因异常转录关系 |
| 表 2 肺癌患者吸烟指数与K-ras基因突变、FHIT基因异常转录关系 |
2.4 吸烟对不同型肺癌患者K-ras、FHIT异常的影响(表 3)
分层分析不同肺癌病理类型吸烟与K-ras基因点突变、FHIT基因异常转录的关系。结果显示,肺腺癌中吸烟与K-ras基因点突变关系密切,而肺鳞癌和小细胞肺癌中吸烟与FHIT基因异常转录的关系密切,差异均有统计学意义(P<0.01)。
| 表 3 吸烟对不同病理类型肺癌患者K-ras、FHIT基因异常的影响 |
3 讨论
多种肿瘤存在癌基因Ras的突变和激活,常见于肺癌、结肠癌和胰腺癌。Ras家族包括H-ras、N-ras和K-ras3个成员,而K-ras与肺癌关系最密切[4]。本研究显示,肺癌患者存在较高的K-ras点突变和FHIT转录异常阳性率,而正常肺组织中未见两者之间异常,表明K-ras点突变和FHIT转录异常与肺癌的发生关系密切。6例SCLC组织中无一例K-ras点突变,与Wistuba8的研究结果相同,但有5例FHIT转录异常,表明K-ras点突变与NSCLC发生密切相关,而SCLC的发生与FHIT异常转录的关系更为密切。肺癌组吸烟者K-ras点突变和FHIT转录异常率明显高于不吸烟患者(P<0.05),并且2个基因异常与患者吸烟指数均呈正相关,提示K-ras和FHIT基因可能为烟草致肺癌的分子靶点,K-ras点突变和FHIT转录异常可能为烟草致肺癌的关键步骤。按病理类型分层分析结果表明,吸烟是肺腺癌和大细胞癌患者K-ras突变的重要因素。而对于肺鳞癌和小细胞肺癌患者,吸烟是其FHIT转录异常的重要因素,进一步证实两者是吸烟致肺癌的作用靶点。但本研究2个基因异常无明显关联性,且其异常变化存在差异,说明烟草可经过不同的靶点导致肺癌的发生发展,靶点不同对其最终致癌的病理类型存在影响,是否与烟草中的不同致癌物分别有不同的作用靶点有关,仍有待进一步研究。
| [1] | Tyczynski JE, Bray F, Parkin DM. Lung cancer in Europein 2000: epidemiology, prevent ion, and early det ect ion[J]. Lancet Oncol, 2003(1) : 45–55. |
| [2] | Williams MD, Sandler AB. The epidemiology of lung can cer[J]. Cancer T reat Res, 2001, 105 : 31–52. DOI:10.1007/978-1-4615-1589-0 |
| [3] | Sagawa M, Saito Y, Fujumura S, et al. K-ras poit mut at ion occurs in the early stage of cancinogenesis in lung cancer[J]. Br J of Can?? cer, 1998, 77(5) : 720–723. |
| [4] | Minamoto T, Mai M, Ronai Z. K-ras mutation: early detection in mol ecular diagnosis and risk assessm ent of colorect al, pancreas, and lung cancers-a review[J]. Cancer-Det ect-Prev, 2000, 24(1) : 1–12. |
| [5] | Wistuba IJ, Gazdar AF, Minna JD. Molecular genetics of small cell lung carcinoma[J]. Semin Oncol, 2001, 28(2 Supply) : 3–13. |
 2008, Vol. 24
2008, Vol. 24




