乳腺癌是女性发病率最高的恶性肿瘤之一,内分泌治疗是目前乳腺癌综合治疗中的重要措施,而以他莫西芬(Tamoxifen,TAM)为代表的选择性雌激素受体调节剂(selective estrogen receptor modulators,SERM)是目前临床上治疗乳腺癌的具有代表性的内分泌治疗药物,但由于其仅能对部分雌激素受体阳性的乳腺癌患者起作用,而雌激素受体阴性的患者极易对其产生耐药性[1],从而限制了其疗效的发挥。1,25二羟维生素D3(简称活性维生素D3) 属于类固醇类化合物,除了其传统的钙、磷调节功能以外,在乳腺肿瘤、白血病以及前列腺肿瘤的治疗方面发挥重要的作用[2-4]。本研究拟以转染活性维生素D3靶控雌激素受体α阳性表达载体的MDA-MB-231乳腺癌细胞为研究对象,观察活性维生素D3联合他莫西芬对细胞凋亡的影响及其机制。
1 材料与方法 1.1 细胞株MDA-MB-231细胞(人雌激素受体阴性乳腺癌细胞,中科院上海细胞所);转染了pVDRE-Tk-ERα表达质粒的细胞命名为MDA-MB-231VDRE-ERα细胞,常规传代培养。
1.2 主要试剂他莫西芬(美国Sigma公司),以10×10-3mol/L的浓度溶于无水乙醇中,配成储备液,-20 ℃保存;1α,25二羟维生素D3(美国Fluka公司),以2×10-3mol/L的浓度溶于无水乙醇中,配成储备液,-20 ℃保存;末端原位凋亡检测试剂盒(瑞士罗氏公司);DMEM/F12培养液(美国Hyclone公司);热灭活胎牛血清(天津TBD公司);雌激素受体α鼠单克隆抗体,核因子κB P65亚单位鼠单克隆抗体(美国Santa Cruz公司);辣根过氧化物酶标的抗鼠IgG抗体(北京中杉公司)。
1.3 细胞培养参照《细胞培养》[5]相关方法,常规培养MDA-MB-231和MDA-MB-231VDRE-ERα细胞。
1.4 活性维生素D3ERα诱导表达的影响将转染空载体的MDA-MB-231vector细胞和MDA-MB-231VDRE-ERα细胞以5×104的浓度接种于铺有盖玻片的24孔板中,分别以1.0×10-7,5.0×10-7,10.0×10-7mol/L浓度的活性维生素D3处理MDA-MB-231VDRE-ERα细胞24h,同时设置未处理组为对照。收入获细胞后,参照抗体试剂说明书操作,最后于激光共聚焦显徽镜下观察实验结果,并计算各组的平均荧光强度。
1.5 TUNEL法检测MDA-MB-231VDRE-ERα细胞凋亡将MDA-MB-231VDRE-ERα细胞以3×104/ml的浓度接种于有盖玻片的24孔板中,分别以5.0×10-7mol/L浓度的维生素D3,5×10-6mol/L的他莫西芬单独或联合处理72h,同时设置未处理组为对照。参照Roche公司末端原位凋亡检测(TUNEL)试剂说明书进行实验,用普通光学显微镜观察阳性结果,并计算出各组的凋亡率。
1.6 Western blot检测NFκB表达及核转位变化将处于对数生长期的细胞接种于培养瓶内,待细胞贴壁后,分别以5.0×10-7mol/L浓度的活性维生素D3、5×10-6mol/L的他莫西芬单独或联合处理细胞48h后,用冰预冷的磷酸盐缓冲液(PBS)洗涤2遍,用细胞刮轻轻刮取全部细胞入1.5 ml离心管并保证每组细胞数目能达到1×10-7个,加入100 μl预冷至0 ℃的细胞总蛋白裂解液,冰上放置30 min,4 ℃、15 000 r/min离心15 min,将上清液转移至另一1.5 ml离心管中并用Lowry法测定总蛋白浓度,将蛋白浓度调整为4~5μg/μl,-20 ℃保存备用。细胞核蛋白的提取参照相关文献[6]配制,Lowry法[7]测定其浓度后分装并保存于-70 ℃冰箱。分别取含总蛋白和核蛋白的裂解液与2×上样缓冲液混合,加入β-巯基乙醇,沸水浴中放置5 min,行聚丙烯酰胺凝胶电泳。电泳完毕后,将凝胶上的蛋白用湿式转印法转至聚偏四氟乙烯膜PVDF上,丽春红染膜验证转染效率,用1%牛血清白蛋白/Tris盐酸缓冲液封闭聚偏四氟乙烯(PVDF)膜,4 ℃过夜,然后依据免疫印记步骤,依次加入按一定比例稀释的核因子κB P65亚单位鼠单克隆抗体、辣根过氧化物酶标记的二抗以及卵白素,最后用二氨基联苯胺显色,扫描并保存结果。
1.7 统计分析采用SPSS 10.0统计软件进行两样本均数比较的t检验。
2 结果 2.1 活性维生素D3对ERα诱导表达的影响(图 1)MDA-MB-231VDRE-ERα细胞在蓝色激光激发下细胞整体呈现绿色荧光,尢其以胞核最为明显,未经活性维生素D3处理的转染细胞荧光强度较低。经1.0×10-7mol/L的活性维生素D312 h后即可观察到细胞内荧光强度的明显增高,而处理24 h后其荧光强度进一步增强,并随着活性维生素D3处理浓度的提高而进一步增强。表明活性维生素D3可以通过VDRE-Tk启动子调控下游ERα基因高效表达。
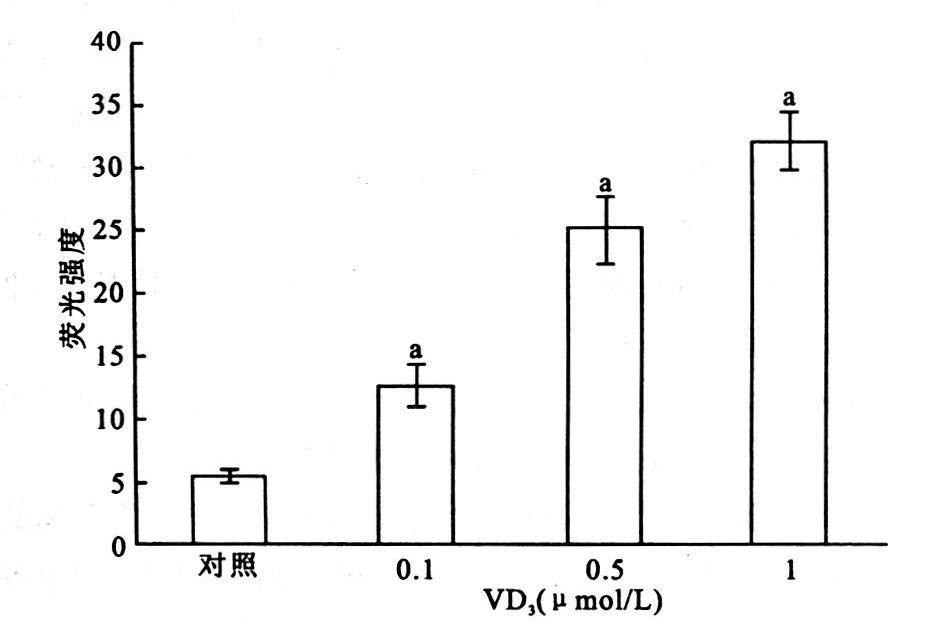
|
注:与对照组比较,a P<0.01。 图 1 免疫荧光检测MDA-MB-231VDRE-ERαERα表达 |
2.2 MDA-MB-231VDRE-ERα细胞凋亡的变化(图 2)
通过TUNEL检测发现,MDA-MB-231VDRE-ERα细胞经活性维生素D3和Tamoxifen单独或联合处理72 h后,各组均有部分细胞发生了凋亡,尤其是联合处理组,其细胞凋亡率达到25.6%显著高于对照组和单独处理组,而单独处理组的细胞凋亡率则活性维生素D3组为5.8%,他莫西芬组为7.6%。提示,活性维生素D3和他莫西芬联合作用能够较单独作用有效诱导MDA-MB-231VDRE-ERα乳腺癌细胞发生凋亡,从而起到抑制肿瘤的作用。
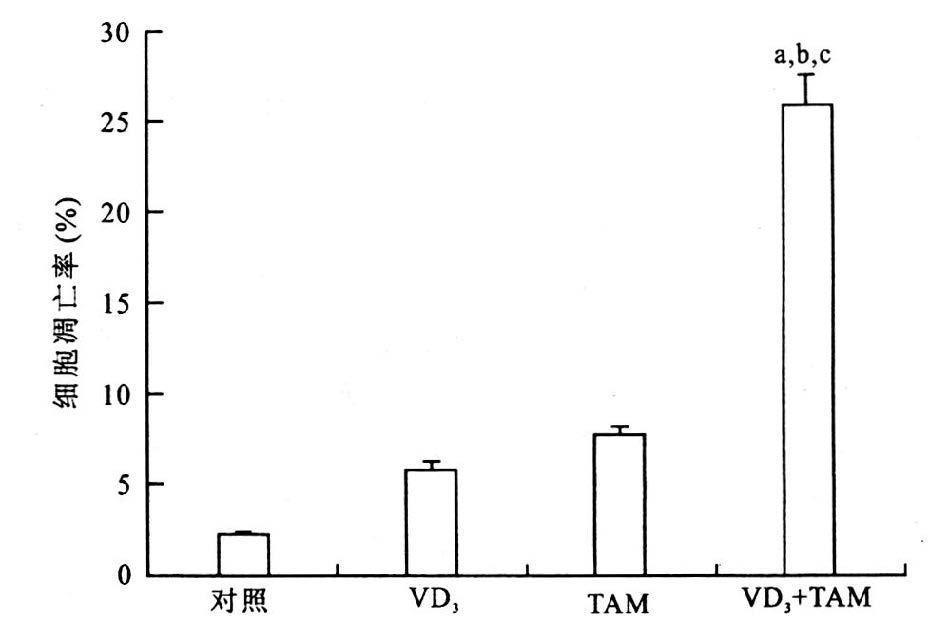
|
注:与对照组比较,a P<0.01;与VD3组比较,b P<0.01;与TAM组比较,c P<0.01。 图 2 不同处理方式后细胞凋亡的变化 |
2.3 MDA-MB-231VDRE-ERα细胞NFκB
P65亚单位蛋白表达及活性变化(图 3,4) Western blot实验结果显示,经活性维生素D3和他莫西芬单独或联合处理MDA-MB-231VDRE-ERα细胞48 h后,细胞核内NFκB P65亚单位的水平较对照组显著下降,其在细胞内总的蛋白表达水平在联合处理48 h后亦有所降低。
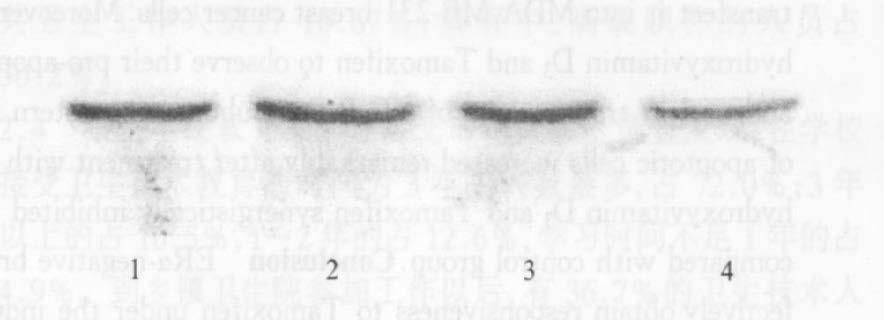
|
注:1:对照;2:VD348 h;3:TAM 48 h;4:VD3+TAM 48 h。 图 3 MDA-MB-231VDRE-ERα细胞NFκB P65亚单位核转位的情况 |
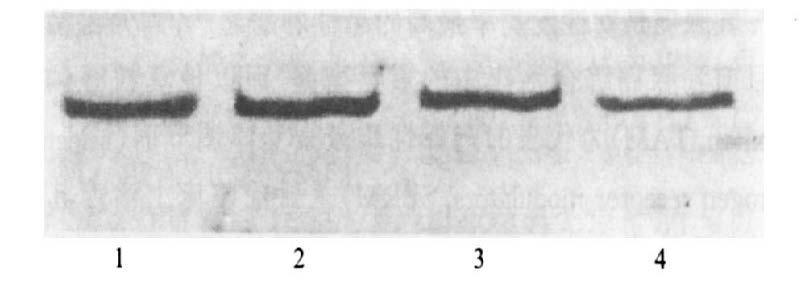
|
注:1:对照;2:VD348 h;3:TAM 48 h;4:VD3+TAM 48 h。 图 4 MDA-MB-231VDRE-ERα细胞NFκB P65亚单位表达的变化 |
3 讨论
他莫西芬是目前临床应用广泛而有效的内分泌治疗药物,也是术后辅助治疗的常用药物。1977年美国FDA批准他莫西芬用于临床治疗进展期乳腺癌,几年后用于原发性乳腺癌的辅助治疗[8]。相当部分的乳腺癌患者的肿瘤细胞雌激素受体表达缺失,使得癌细胞对他莫西芬的敏感生大大降低并产生耐药性,从而限制了其临床应用。活性维生素D3作为维生素D在体内的生物活性形式,可通过抑制肿瘤细胞增殖和诱导其发生凋亡机制来发挥其抗肿瘤作用[9]但鉴于其容易导致高钙血症的副作用,研究人员遂将其与其他抗肿瘤药物联合使用,并在体内、外实验中证实了这种方法的有效性[7]。
NFκB是细胞正常代谢和免疫反应中的重要分子之一[10]。活化后的NFκB进入细胞核并与其靶基因上游启运子区域的NFκB反应元件(NRE)发生结合从而启动下游靶基因的转录。因此,通过降低NFκB的活性不仅能够直接诱导细胞发生凋亡和增殖抑制,还能够有效解除其对VDR转录调控活性的抑制,从而充分发挥活性维生素D3的抗肿瘤效应。本研究发现,与转染空载体的MDA-MB-231细胞比较,活性维生素D3和他莫西芬联合作用可有效诱导MDA-MB-231VDRE-ERα细胞发生凋亡,使其恢复对活性维生素D3和他莫西芬的敏感性。同时,NFκB P65活性亚单位的核转位较对照组和单独处理组受到明显抑制,而细胞总NFκB P65亚单位的表达也有所降低,提示,NFκB也是他莫西芬和活性维生素D3的重要靶作用点,二者能够通过协同抑制NFκB的活性和表达从而达到抑制乳腺癌细胞增殖并促使其发生凋亡的作用。
| [1] | Swain SM. Tamoxifen for patients with estrogen-negative breast cancer[J]. Clin Oncol, 2001, 19(suppl) : 93–97. |
| [2] | Mehta RG, Mehta RR. Vitamin D and cancer[J]. Nutr Biochem, 2002, 13(5) : 252–264. DOI:10.1016/S0955-2863(02)00183-3 |
| [3] | Pendas-Franco N, Gonzalez-Sancho JM, Suarez Y, et al. Vitamin D regulates the phenotype of human breast cancer cells[J]. Differentiation, 2007, 75(3) : 193–207. DOI:10.1111/j.1432-0436.2006.00131.x |
| [4] | Gross C, Stamey T, Hancock S, et al. Treatment of early recurrent prostate cancer with 1,25-dihydroxyvitamin D3 (calcitriol)[J]. J Urol, 1998, 159(6) : 2035–2039. DOI:10.1016/S0022-5347(01)63236-1 |
| [5] | 司徒镇强, 吴军正.细胞培养[M].修订版.北京: 世界图书出版公司, 2004: 78-88. |
| [6] | 王勇, 黄文化. 一种改进的核转录因子的电泳迁移率改变分析法[J]. 第三军医大学学报, 2001, 23(1) : 119–120. |
| [7] | 沈关心, 龚非力(译). 抗体技术实验指南[M]. 北京: 科学出版社, 2003: 271. |
| [8] | Langan Fahey SM,Jordan VC,Fritz NF,et al.Clinical pharnmacology and endocrinology of longterm tamoxifen therapy[A].In:Jordan VC,ed.Longterm tamoxifen treatment for breast cancer[M].Madison:University of Wisconisin Press,1994:27-56. |
| [9] | Golovko O, Nazarova N, Tuohimaa P. Vitamin D-induced up-regulation of tumour necrosis factor alpha (TNF-alpha) in prostate cancer cells[J]. Life Sci, 2005, 77(5) : 562–577. DOI:10.1016/j.lfs.2004.10.072 |
| [10] | Cao Y, Karin M. NF-kappaB in mammary gland development and breast cancer[J]. Journal of Mammary Gland Biology and Neoplasia, 2003, 8(2) : 215–223. DOI:10.1023/A:1025905008934 |
 2008, Vol. 24
2008, Vol. 24

