2. 郑州大学生物工程系
志贺菌属 (Shigella)细菌是主要肠道病原菌之一,是人类及灵长类动物细菌性痢疾的致病菌,能引起感染性腹泻,在发展中国家其发病率和病死率较高。近年研究发现,病原菌主动外排机制(active efflux)在耐药机制中占有重要地位。因为外排泵系统广泛存在,它不仅介导了众多革兰阴性菌与革兰阳性菌对多类抗生素的耐药性,而且参与真菌的耐多药性[1]。外排泵cmr基因属于主易化超家族(MFS),是广泛存在于细菌乃至真核生物的耐多药泵家族[2, 3]。本研究克隆了临床耐药志贺菌H24的包括其调控序列在内的完整cmr耐药泵基因,并对其进行了异源表达,对其在大肠埃希菌中产生的耐药作用进行了探讨。
1 材料与方法 1.1 材料(1)菌种及质粒:大肠埃希菌DH5α,志贺菌临床分离耐药株H24等(郑州大学公共卫生学院流行病教研室保存);大肠埃希菌药敏质控株ATCC25922(河南省疾病预防控制中心惠赠);质粒pMD18-T(日本TaKaRa公司)。(2)工具酶及试剂:PstⅠ内切酶、KpnⅠ内切酶、胰RNA酶、DNA 回收试剂盒(日本TaKaRa公司);7种抗生素(中国药品生物制品检定所);酵母提取物和蛋白胨(美国Oxiod公司);质子泵抑制剂氰氯苯腙(CCCP,美国Sigma公司);营养肉汤水解酪蛋白(MH)培养基(北京奥博星公司)。
1.2 方法 1.2.1 志贺菌临床耐多药株筛选用MH培养基琼脂平皿二倍稀释法,测定临床收集的30株志贺菌耐药株对四环素、氯霉素、红霉素、庆大霉素、环丙沙星、硫酸链霉素、硫酸新霉素的最低抑菌浓度(Minimum Inhibition Concentration,MIC);标准控制菌为ATCC25922。
1.2.2 志贺菌基因组DNA提取按常规方法进行[4]。
1.2.3 志贺菌临床株耐多药株cmr基因片段获取 (1)扩增:从GenBank查到志贺菌cmr基因序列,利用Primer 5.0设计引物。引物设计位点使克隆出的片段包含有cmr 基因的调控序列,正向连接与lac启动子相隔约200 bp,希望用自身启动子表达[5]。引物由北京赛百盛公司合成。上游引物P1为:GGGGTACCGCGTCGCGTTAATAAGAG,下游引物P2为:GGCTGCAGGCGTAGGTGAAGGGATGG;以志贺菌临床多耐药株H24为模板,以P1和P2为引物进行PCR扩增。PCR条件为:94℃ 5 min,94℃ 40 s,58℃ 45 s,72℃ 120 s,30个循环,72℃延伸10 min。对PCR产物进行琼脂糖凝胶电泳。(2)目的片段回收:PCR产物计50 μl,1%琼脂糖凝胶电泳后,用DNA快速回收试剂盒回收,方法参考产品说明书。
1.2.4 pMD -cmr重组质粒构建回收的目的片段与pMD18-T载体在16℃下连接过夜。用连接好的质粒转化大肠埃希菌DH5α,涂布于含80 μg/ml Amp的LB琼脂平板上,37℃培养过夜后,利用蓝白斑筛选挑取少许白色单克隆,在含100 μg/ml Amp的LB液体培养基中培养过夜;碱裂解法从菌液中提取质粒,用PstⅠ单酶切和KpnⅠ和PstⅠ双酶切进行鉴定。
1.2.5 pMD-cmr重组菌株耐药性检测及氰氯苯腙对其耐药性影响以转入pMD18空质粒(自连接)的DH5α菌为对照,采用琼脂平皿二倍稀释法测定7种抗生素对pMD-cmr重组菌株的最低抑菌浓度(MIC)。另外在含抗生素琼脂培养基中加入氰氯苯腙至20 μmol/l,再次检测定细菌MIC值。
1.3 序列测定及分析取酶切鉴定正确的重组质粒进行纯化并由上海生工生物工程有限公司测序。
2 结 果 2.1 耐药株筛选在MH培养基上用琼脂平皿二倍稀释法筛选出的宋氏志贺菌耐多药株H24,对7种抗生素均呈不同程度耐药,其中对氯霉素、红霉素、四环素和硫酸链霉素的MIC值分别为64,128,128,64,均呈高度耐药,对环丙沙星、硫酸新霉素和庆大霉素等的MIC值分别为0.25,16,0.25,呈轻度耐药。
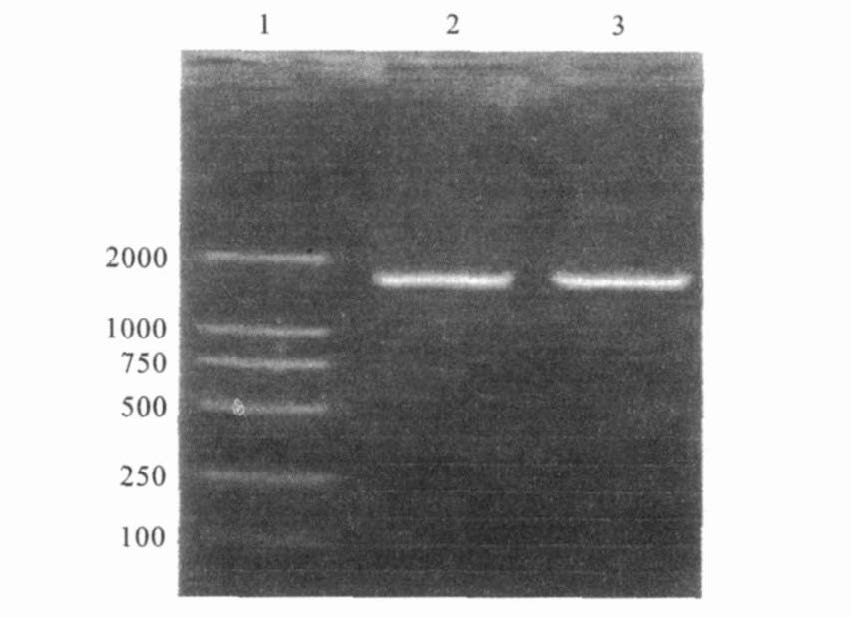
2.2 cmr基因扩增PCR 扩增宋氏志贺菌H24 cmr基因,扩增产物经1%琼脂糖凝胶电泳分析,在约1 620 bp 处有一特异扩增条带,分子量大小与预期扩增值相符(图 1)。
|
注:1 :DL2000Marker ;2 ,3 : cmr PCR 扩增产物。 图 1 cmr PCR扩增产物( 1600bp) |
2.3 pUC-cmr重组质粒鉴定
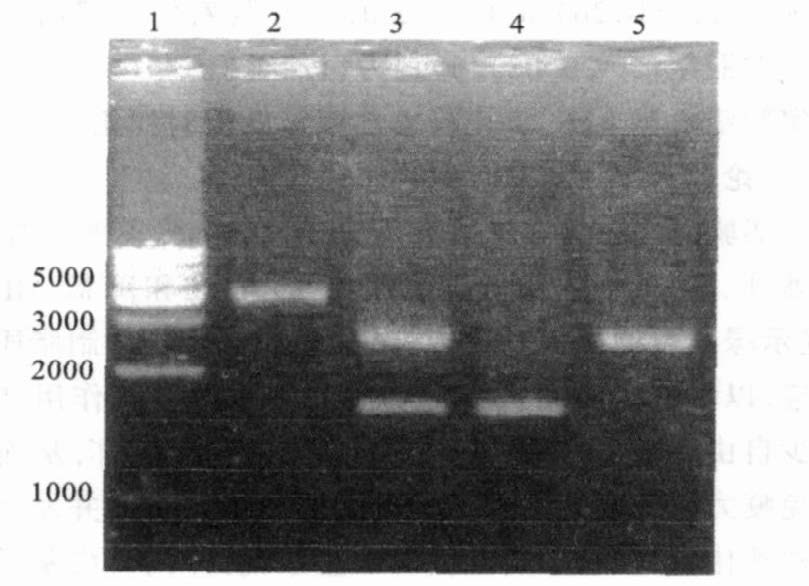
经PstⅠ单酶切和KpnⅠ、PstⅠ双酶切鉴定,确认获得正确的重组质粒(图 2)。
|
注:1 :1kb Marker ;2 :pMD-cmr PstⅠ单酶切;3 :pMD-cmr KpnⅠ、Pst Ⅰ双酶切;4 : cmr PCR 扩增;5 :pMD18-T 质粒。 图 2 pMD-cmr 重组质粒酶切鉴定 |
2.4 重组大肠埃希菌耐药性及氰氯苯腙的影响(表 1)
由表 1可见,携带有重组pMD-cmr质粒的菌株与携带空质粒的菌株比较耐药性有所增强。对四环素和红霉素的MIC值提高了1倍,显示该基因有增强细菌耐药性的作用。加入氰氯苯腙后,各抗生素对2种菌株的MIC值均有不同程度下降。
| 表 1 重组菌株pMD-cmr的最低抑菌浓度 |
2.5 测序结果序列分析
测序结果显示,志贺菌临床耐药株H24与Genbank报道的宋氏志贺菌标准株cmr基因相比,碱基序列完全一致,并未发现有基因突变。
3 讨 论主动外排耐药系统可分为5个家族。1998年Anidy等发现志贺菌中存在主动外排机制[5],国内杨海燕等证实志贺菌存在Acrab-Tolc耐药泵[6]。
本研究克隆出志贺菌临床耐药株H24包括调控序列在内的cmr基因,并连接到pMD18-T载体上。cmr带有自身的调控序列,而且距pMD18-T载体的lac启动子较远,cmr可在自身启动子调控下进行表达,pMD18质粒高拷贝的特点则可使cmr表达量升高。结果显示,通过最低抑菌浓度(MIC)比较,携带有cmr基因的重组菌株对红霉素和四环素的耐药性增高一倍,对其他抗生素则无变化。临床耐多药株 的cmr基因经测序分析,与宋氏志贺菌标准株比较并未发现基因突变,证实cmr基因介导的耐药与编码区基因的突变无关,而可能与cmr基因的表达量升高有关。
本文结果还显示,志贺菌临床耐药株H24对四环素和红霉素的MIC值均为128 μg/ml,但当该耐药株cmr基因在大肠埃希菌中表达后,对四环素和红霉素的耐药性仅提高了1倍,MIC值分别为8和32 μg/ml,表明志贺菌临床耐药株H24对四环素和红霉素的耐药性除与cmr基因表达量升高相关外,可能还有其他耐药基因发挥作用,这可能是多基因、多种耐药机制共同作用的结果。
加入质子泵抑制剂氰氯苯腙后,重组株和对照株对上述4种抗生素的耐药性降低到同一水平,表明cmr外排泵是质子泵,它的高表达可导致菌株对上述2种抗生素的耐药性升高,但可被质子泵抑制剂氰氯苯腙所抑制。加入氰氯苯腙后,2种菌株对7种抗生素的MIC值均有较大幅度下降,提示菌体中可能还有其他以质子梯度为能量的外排泵存在。
鸣谢 本研究在河南省分子医学重点开放实验室完成| [1] | 郝建华, 戚焕贞. 常见革兰氏阴性菌的耐药机制[J]. 山东医药, 2002, 42(34) : 112. |
| [2] | Ines M Borges-Walmsley, Kenneth S McKeegan, Adrian R Walm2 sley. Structure and function of efflux pumps that confer resistance to drugs[J]. Biochem, 2003, 376 : 313–338. DOI:10.1042/bj20020957 |
| [3] | Rotem D, Sal-man N, Schuldine S. In vit ro monomer swapping in Cmr,a multidrug transporter from Escherichia coli,reveals that the oligomer is the functional unit[J]. Biochem, 2001, 276(51) : 48243–48249. |
| [4] | 姜泊, 张亚历, 周殿元. 分子生物学常用实验方法[M]. 北京: 人民军医出版社, 1996: 107-108. |
| [5] | Kunihiko N, Akihito Y. Analysis of a complete library of putative drug transporter genes in escherichia coli[J]. Bacteriol, 2001, 183(20) : 5803–5812. DOI:10.1128/JB.183.20.5803-5812.2001 |
| [6] | Ghosh A S, Ahamed J, Chauhan K K, et al. Involvement of an efflux system in high-level fluoroquinolone resistance of Shigella dysenteriae[J]. Biochem Biophys Res Commun, 1998, 242(1) : 54–56. DOI:10.1006/bbrc.1997.7902 |
| [7] | 杨海燕, 段广才, 郗园林. 主动外排系统acrAB 在志贺菌中分布和表达[J]. 中国公共卫生, 2005, 21(6) : 685–687. |
 2007, Vol. 23
2007, Vol. 23