伴随重组DNA技术的发展,重组肽技术已经成为当前肽类合成、肽类修饰、肽类结构和肽类功能改善等相关研究的工具[1-6]。本研究以治疗2型糖尿病的新药的胰高血糖素样肽-1[GLP-1(7-37)]衍生物[19个氨基酸的蛋白结合序列+GLP-1(7-37)]作为目的肽[7],使用本实验室专利权的带6个组氨酸标签的高效表达质粒载体pMFH-mcs[8],通过重组肽技术探索GLP-1(7-37)衍生物表达和纯化的最优化条件,在降低实验和生产成本前提下,改进蛋白表达和纯化的技术条件,提高目的肽纯度和产量的新策略。为今后GLP-1(7-37)衍生物的工业化生产提供科学依据。
1 材料与方法 1.1 材料Ni-NTA琼脂糖树脂预装柱(美国Invitrogen公司);C18 Sep-Pak 反相柱(美国Waters公司);带有C18 反相柱(4.6mm×100mm)(美国Agilent公司):高效液相色谱(HPLC)系统(美国 Agilent公司);高效质粒表达载体pMFH-mcs、质粒载体pMFH-GLP-1(本实验室)、大肠埃希菌BL21(DE3)(本实验室自备);限制性核酸内切酶EcoRI和BamHI(美国New England Biolabs公司);T4 DNA连接酶(日本TaKaRa公司);尿素(美国Amresco公司);乙腈(美国Tedia公司);其余试剂均为国产分析纯产品。
1.2 方法 1.2.1 pMFH-GLP-1衍生物重组质粒的构建选用大肠埃希菌偏爱密码子设计引物,引物5'端和3'端分别有EcoRI和BamHI酶切位 点,以pMFH-GLP-1质粒为模板,用重叠PCR方法获得GLP-1衍生物全长基因序列。反应条 件为:95℃ 5 min;95℃ 1 min;55℃ 1 min;30个反应循环,72℃延长反应10 min。PCR产 物和高效质粒表达载体pMFH-mcs用限制性核酸内切酶EcoRI和BamHI 37℃ 双酶切后用T4DNA连接酶16℃定向连接过夜,连接产物转化大肠埃希菌表达菌BL21(DE3),转化菌种涂含有氨苄抗生素的平板,挑取单菌落培养并抽取质粒进行验证。
1.2.2 pMFH-GLP-1衍生物在大肠埃希菌BL21(DE3)中表达条件的确定构建成功的pMFH-GLP-1衍生物质粒转化进入大肠埃希菌BL21中,37℃摇菌至A600=0.6。以诱导前菌体或空载体作为对照,然后放分别进行如下实验:(1)各取1mL菌液加入IPTG至终浓度为1 mmol/L,分别在25,30,37,42℃诱导温度下,摇菌诱导表达12 h,测定其A6000的值。根据公式:270/(菌体A6000×浓缩系数)计算上样量,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测融合蛋白的表达,确定其最佳表达温度;(2)各取1 ml菌液加入IPTG之终浓度分别为0.2,0.4,0.6,0.8,1.0,1.2 mmol/L,在最佳诱导表达温度下,摇菌诱导表达12 h,测定其A6000的值,确定其异丙基-β-D-硫代半乳糖苷(IPTG)最佳诱导表达浓度;(3)各取1 ml菌液加入IPTG至最佳诱导浓度,在最佳诱导温度下分别诱导表达1,2,3,4,5,6,8 h,测定其A6000的值,确定其最佳诱导表达时间。
1.2.3 融合蛋白的纯化和鉴定在最佳诱导表达条件下,pMFH-GLP-1衍生物重组质粒在大肠埃希菌BL21中高效表达。表达的融合蛋白带有6个组氨酸标签,菌体4000 r/min离心20 min得到菌体沉淀物。加50 ml BufferA(6 mmol/L Urea+50 mmol/L NaH2PO42H2O pH=8.0) 于菌体沉淀物中,在摇床内室温摇动20 min,重悬菌体用超声波破碎仪破碎,有效细胞破碎时间为3 min,4℃ 10000 r/min离心30 min以沉淀菌体碎片。上清液经Ni-NTA琼脂糖树脂柱的纯化:用BufferA加10 mmol/L,40 mmol/L咪唑洗脱杂蛋白,250 mmol/L咪唑浓度下洗脱所要融合蛋白。融合蛋白利用Waters 5g C18 反相疏水柱进行脱盐处理,由70%的乙腈洗脱融合蛋白。然后由四级杆质谱和高效液相色谱(HPLC)鉴定其分子量和纯度。HPLC检测条件为25 min线性梯度洗脱,流动相A(100%乙腈)由10%至80%,流动相B(100%水,0.1%三氟乙酸) 由90%至20%;流速1 ml/min;检测波长280nm。
1.2.4 目的肽(GLP-1衍生物)的纯化和鉴定由于构建克隆时,在载体和GLP-1衍生物的DNA序列之间设计有甲酸的水解位点:GAT-CCG(半胱氨酸-脯氨酸),表达的带6个组氨酸的融合蛋白用70%甲酸(v/v)进行酸解而释放目的肽(GLP-1衍生物)。酸解条件为:45℃避光水解24h。水解产物再次经Ni-NTA琼脂糖树脂柱纯化以除去融合蛋白和融合蛋白水解后的载体蛋白部分。收集流过Ni-NTA琼脂糖树脂柱的通过蛋白,经HPLC分析和制备,收集目的肽的HPLC单峰,经冷冻干燥得到目的肽产品。由四级杆质谱鉴定其分子量。
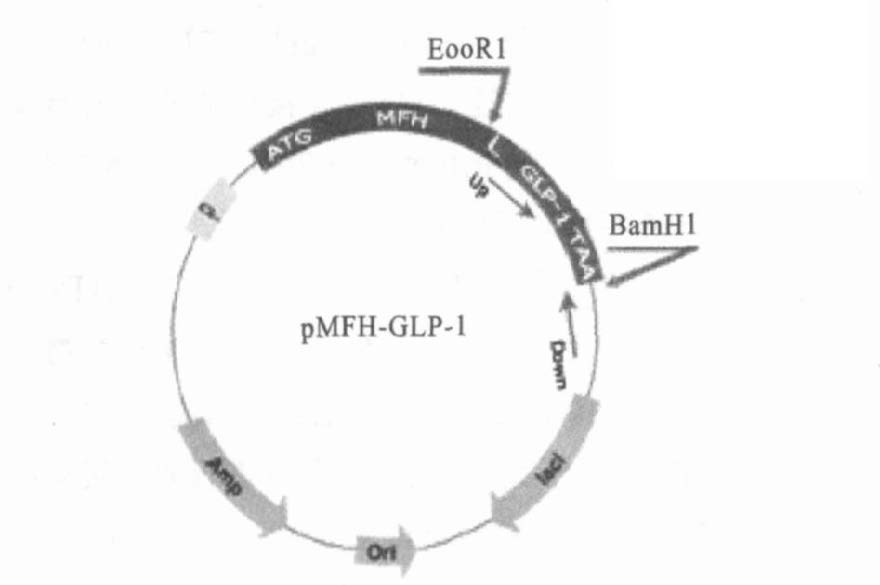
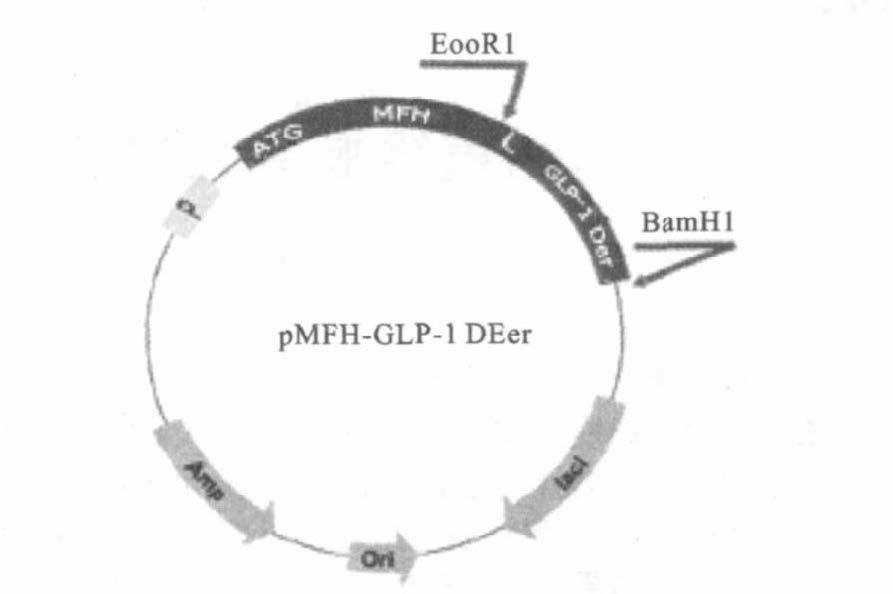
2 结 果 2.1 pMFH-GLP-1衍生物重组质粒的构建(图 1,图 2)在含有氨苄抗生素的平板上挑取转化后的单菌落培养,抽取质粒进行PCR验证和EcoRI及BamHI双酶切验证可知,PCR或双酶切的目的DNA片段与理论值符合,验证的质粒用下游引物进行DNA测序,无碱基错配,最终确定pMFH-GLP-1衍生物重组质粒构建成功。
|
注:Up →示上游引物;Down →示下游引;L 示D-P(甲酸酸解位点) 。 图 1 A pMFH- GLP-1 质粒示意图 |
|
注:Der 示衍生物;L 示D-P(甲酸酸解位点) 。 图 2 B pMFH- GLP-1 衍生物克隆质粒示意图 |
2.2 pMFH-GLP-1衍生物重组质粒在大肠埃希菌BL21中的最佳表达条件
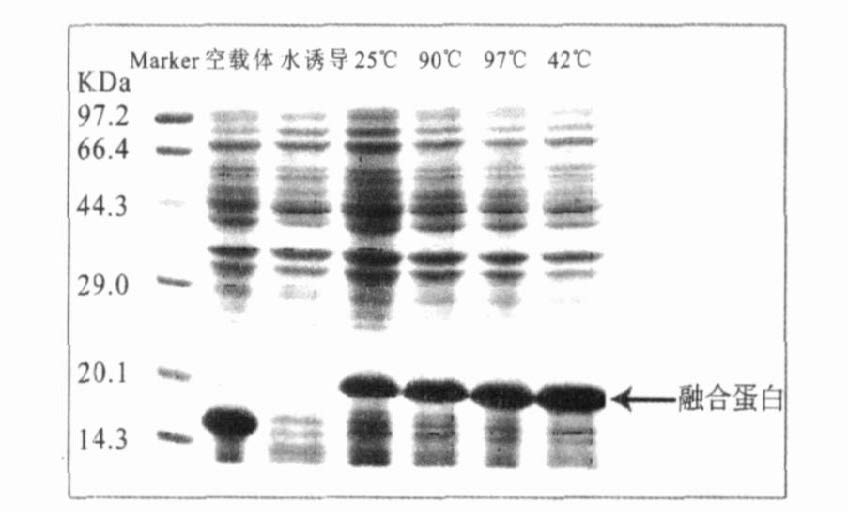
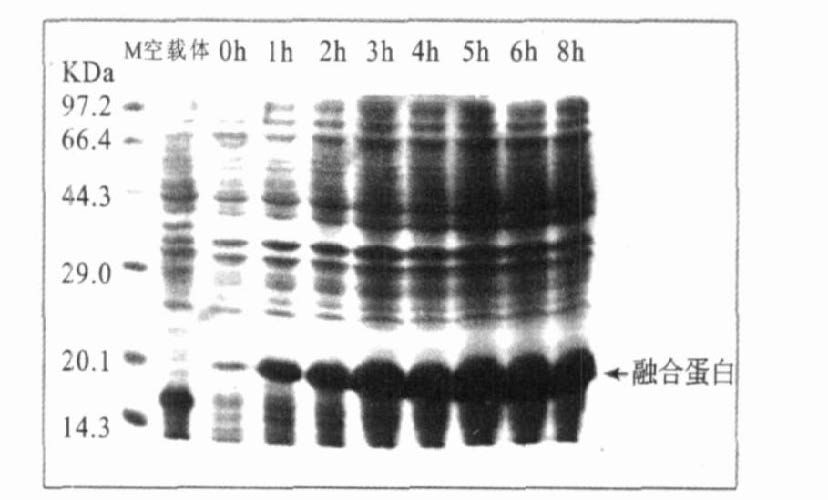
(1)诱导表达温度(图 3):显示:37℃诱导温度下等量菌体表达的融合蛋白比25,30℃诱导温度下表达的蛋白多而与42℃诱导温度下表达的蛋白量无明显差异,并且考虑工业化生产的方便性确定37℃为最佳诱导表达温度。(2)诱导表达时间(图 4):显示等量菌体诱导表达6h的蛋白量比表达更短时间组要多,与诱导表达更长时间组的差异无统计学意义,确定6h为最佳诱导表达时间。(3)诱导表达的IPTG浓度:显示:等量菌体在IPTG0.6 mmol/L时诱导表达的蛋白量比更低IPTG浓度组要多,与更高IPTG浓度组差异无统计学意义,确定0.6 mmol/L为最佳诱导表达的IPTG浓度。实验结果显示,诱导表达温度37℃、诱导表达时间6h、诱导剂IPTG浓度0.6 mmol/L为pMFH-GLP-1衍生物克隆在大肠埃希菌表达菌BL21中的最佳表达条件。
|
注:蛋白标准分子量;空载体为pMFH-mcs ;未诱导为未加入IPTG前的融合蛋白表达。 图 3 不同诱导温度下融合蛋白的表达 |
|
注:M:蛋白标准分子量;空载体为pMFH-mcs。 图 4 不同诱导表达时间融合蛋白的表达 |

|
注:Marker :蛋白标准分子量;空载体为pMFH - mcs ; 未诱导为未加入IPTG前的融合蛋白表达。 图 5 不同诱导表达IPTG浓度下融合蛋白的表达 |
2.3 融合蛋白的鉴定
在最佳诱导表达条件下,pMFH-GLP-1衍生物重组质粒在大肠埃希菌BL21中高效表达的产物经Ni-NTA琼脂糖树脂柱纯化,250 mmol/L咪唑浓度下洗脱所需的融合蛋白,利用Waters 5g C18 反相疏水柱进行脱盐处理,由70%的乙腈洗脱。融合蛋白由四级杆质谱鉴定其分子量为19981 Da,与理论值(19981 Da)相符合。由HPLC检测,纯度>99%。
2.4 目的肽(GLP-1衍生物)的制备和鉴定C18反相柱(4.6×100mm)分离,30 min线性梯度洗脱,流动相A(100%乙腈)由10%至70%,流动相B(100%水,0.1%三氟乙酸) 由90%至30%;流速1 ml/min;检测波长280nm,两箭头间为目的肽的单峰。融合蛋白经甲酸水解后,水解产物再经Ni-NTA琼脂糖树脂柱纯化。收集流过Ni-NTA琼脂糖树脂柱的通过蛋白即为目的肽,经HPLC分析并确定目的肽分离和制备条件:30 min线性梯度洗脱,流动相A(100%乙腈)由10%至70%,流动相B(100%水,0.1%三氟乙酸)由90%至30%;流速1 ml/min;检测波长280nm,目的肽的保留时间为11.721 min,制备中收集目的肽的HPLC单峰,经冷冻干燥得到目的肽样品。制备的目的肽经四级杆质谱鉴定其分子量为 5548Da,与理论值(5547Da)相符合,纯度>98%。
3 讨 论本研究使用带6个组氨酸标签的高效表达载体pMFH-mcs为融合蛋白的产量和纯化提供了保证,相关研究已详细比较了MFH与其它的蛋白表达系统,证明MFH系统的蛋白表达产率高[9]。由于融合蛋白、融合蛋白载体部分2组分带6个组氨酸标签,因此纯化过程中除第一次利用Ni-NTA 亲和层析技术纯化融合蛋白外,又再次利用Ni-NTA 亲和层析技术分离、纯化无组氨酸标签的目的肽,即收集流过Ni-NTA琼脂糖树脂柱的通过蛋白即为目的肽,这一策略为后续利用HPLC技术分析、纯化目的肽和确定其制备条件提供方便。因为避免了由于融合蛋白、融合蛋白载体部分、目的肽三组分间极性相近而难以利用常规HPLC系统完全分离的纯化难题,后续利用HPLC技术分离、纯化和制备目的肽的过程中可充分发挥此技术灵敏度高、分辨率高、分析样品用量少速度快、可收集单一组分回收或制备样品且经过色谱柱后样品活性不被破坏等技术优点,从而可进一步提高目的肽纯度和制备高纯度目的肽。半胱氨酸-脯氨酸(Asp-Pro)或半胱氨酸-甘氨酸(Asp-Gly)均为甲酸特异性的高效酸解位点,酸解效率可达75%。当然也可在载体与目的肽间设计甲硫氨酸(Met)作为溴化氰的裂解位点,其裂解效率可达92%或更高,但在药物肽的科研和生产中,溴化氰作为剧毒物质怎样彻底去除而不影响药物肽的功能仍需进一步探讨。本研究在保证目的肽产率的前提下,通过改善蛋白表达条件和纯化技术路线,降低了实验成本,制备了高纯度的目的肽(GLP-1衍生物)样品。
| [1] | Makino T, Matsumoto M, Suzuki Y, et al. Semisynthesis of human ghrelin :condensation of a Boc-protected recombinant peptide with a synthetic O-acylated fragment[J]. Biopolymers, 2005, 79(5) : 238–247. DOI:10.1002/(ISSN)1097-0282 |
| [2] | Sharpe S, Yau W M, Tycko R. Expression and purification of a re2 combinant peptide from the Alzheimer’s beta-amyloid protein for solid-state NMR[J]. Protein Expr Purif, 2005, 42(1) : 200–210. DOI:10.1016/j.pep.2005.03.005 |
| [3] | Smith D B, Johnson K S. Single-step purification of polypeptides expressed in Escherichia coli as fusions with glutathione S-trans2 ferase[J]. Gene, 1988, 67(1) : 31–40. DOI:10.1016/0378-1119(88)90005-4 |
| [4] | Guan C, Li P, Riggs P D, Inouye H. Vectors that facilitate the ex2 pression and purification offoreign peptides in Escherichia coli by fusion to maltose-binding protein[J]. Gene, 1988, 67(1) : 21–30. DOI:10.1016/0378-1119(88)90004-2 |
| [5] | Z Su, Vinogradova A, Koutychenko A, et al. Rational design and se2 lection of bivalent peptide ligands of thrombin incorporating P4-P1 tetrapeptide sequences : from good substrates to potent inhibitors[J]. Protein Eng Des Sel, 2004, 17(8) : 647–657. DOI:10.1093/protein/gzh073 |
| [6] | Smith B J. Chemical cleavage of polypeptides[J]. Methods Mol Bi2 ol, 2003, 211 : 63–82. |
| [7] | Jason L Iltz, Danial E Baker, Stephen M Setter. Exenatide : an in2 cretin mimetic for the treatment of type 2 diabetes mellitus[J]. Clinical Therapeutics, 2006, 28(5) : 652–665. DOI:10.1016/j.clinthera.2006.05.006 |
| [8] | Lindhout D A, Thiessen A, Schieve D, et al. High-yield expression ofisotopically labeled peptides for use in NMR studies[J]. Protein Sci, 2003, 12(8) : 1786–1791. DOI:10.1110/(ISSN)1469-896X |
| [9] | Osborne MJ, Z Su, Sridaran V, et al. Efficient expression ofisotopi2 cally labeled peptides for high resolution NMR studies : application to the Cdc42/ Rac binding domains of virulent kinases in Candida al2 bicans[J]. J Biomol NMR, 2003, 26(4) : 317–326. DOI:10.1023/A:1024043620972 |
 2007, Vol. 23
2007, Vol. 23

