哮喘是近年来引起广泛关注的慢性呼吸系统疾病,目前世界上大约有1.5亿人遭受哮喘的折磨[1]。研究表明,大气污染物二氧化硫(SO2)与哮喘有关,低浓度SO2可增加哮喘病人的易感性[2, 3]。黏蛋白(mucin,MUC)5AC(MUC5AC)和白介素-13(IL-13)基因表达与哮喘发病密切相关[4, 5]。SO2及其衍生物能引起小鼠机体DNA损伤和氧化应激[6, 7],且SO2能引起大鼠肺组织凋亡基因、原癌基因和某些代谢酶基因表达的改变[8, 9]。本研究采用来源于人支气管上皮的永生化细胞系(BEP2D),应用荧光实时定量PT-PCR、免疫细胞化学和酶联免疫吸附法(ELISA)等技术,测定经SO2衍生物处理后BEP2D细胞中MUC5AC和IL-13 mRNA和蛋白水平的变化,为从细胞和分子水平探索哮喘的发病机制,阐明SO2污染与哮喘之间的关系提供依据。
1 材料与方法 1.1 主要试剂亚硫酸钠(Na2SO3)、亚硫酸氢钠(NaHSO3)(美国Sigma公司);LHC-8无血清培养液(美国Biofluids INC公司);TRIzol(美国Invitrogen公司)。
1.2 细胞培养BEP2D细胞(军事医学科学院二所),用LHC-8(Laboratony of humar Carcinogenesis-8无血清培养基)在培养箱(3111型,美国Thermo公司)内孵育(95%相对湿度、5% CO2及37℃)。
1.3 细胞染毒处理选择生长到指数生长期的细胞用于实验,用0,0.000 1,0.001,0.01,0.1,1 mmol/L的SO2衍生物(Na2SO3和NaHSO3混合液,M/M=3:1)分别处理细胞4 h后,收集细胞和培养上清进行剂量效应研究;同时,用0.1 mmol/L SO2衍生物处理细胞4 h后,更换新鲜LHC-8培养基,分别在0,0.5,1,4,24 h后收获细胞进行恢复时间效应研究。
1.4 荧光实时定量RT-PCR测定采用TRIzol试剂,参照说明书提取各组BEP2D细胞的总RNA。取2 μg的RNA采用禽白血病病毒(AMV)反转录体系合成cDNA。然后以cDNA进行PCR扩增。PCR反应体积为20 μl,其中含1 μl cDNA、2 μl PCR buffer、3.5 mmol/L MgCl2、0.2 mmol/L dNTP、上下游引物各0.5 μmol/L、探针0.2 μmol/L及1 U Taq DNA聚合酶。所用引物和TaqMan探针如下:MUC5AC(AF015521):上游:5′-GTGCCGCCTACGAGGATTTT-3′,下游:5′-ACCACGCCATCCACCTTCA-3′,TaqMan探针5′-FAM-CTACGCCGCAGCCAGGAGTCAGC-TAMRA-3′;IL-13(NM-02188)上游:5′-GTAGGCGGGAAGGAGGGTTAGG-3′,下游:5′-TAGGGCAGGGGAGGGGTGTAG-3′,TaqMan探针5′-FAM-ACATGTCATCCCTGGGTCCACCGA-TAMRA-3′;GAP DH(NM-002046)上游:5′-GGAAGGACTCATGACCACAGT-3′,下游:5′GCCATCACGCCACAGTTTC-3′,TaqMan探针5′-FAM-TGCCATCACTGCCACCCAGAAGAC-TAMRA-3′。反应在Rotor-Gene 3000荧光定量PCR仪上进行。MUC5AC、IL-13和GAPDH的退火温度分别为55,63,56℃;扩增片段长度分别为97,191和85 bp,所有PCR扩增片段大小均经溴化乙啶染色的琼脂糖胶显影所证实。梯度稀释cDNA用做标准曲线,定量分析采用Rotor-Gene 3000 6.0软件,结果以目的基因与GAPDH基因表达的比值表示。
1.5 MUC5AC蛋白表达的免疫细胞化学法检测用10%中性福尔马林缓冲液固定细胞,做细胞涂片。采用两步法,高压抗原热修复后,按试剂盒说明书进行免疫细胞化学实验[9901试剂盒和二氨基联苯氨(DAB)显色试剂,福州迈新公司]。一抗为小鼠抗MUC5AC的单克隆抗体(45M1,美国Neomarkers公司,1:200)。用已知阳性片作为阳性对照,以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。光镜400倍下对每组3个独立样本随机取5个视野,每个视野计数100个细胞,计算阳性细胞率。胞浆呈棕色者为MUC5AC阳性表达细胞。
1.6 IL-13的ELISA法检测采用ELISA法测定细胞培养液中IL-13水平,按试剂盒(美国R&D公司)说明书进行操作,样品在酶标仪上测定(Model 550,美国Bio-Rad公司)。
1.7 统计分析采用SPSS 11.0软件进行One-way ANOVA检验。
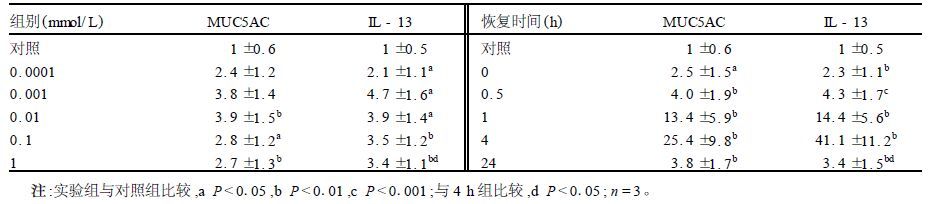
2 结果 2.1 荧光实时定量PCR分析(表 1)将对照组标准化为1,各组数值为与对照组的比值作为相对平均表达的倍数。在SO2衍生物的作用下,除在较低剂量下MUC5AC mRNA表达差异无统计学意义外 ,BEP2D细胞MUC5AC和IL-13的mRNA表达在所测浓度范围内均比对照组显著上升,MUC5AC增幅为2.4~3.9倍;IL-13幅度为2.1~4.7倍。0.1 mmol/L处理4 h后,换上LHC-8培养基,在不同的恢复时间里MUC5AC和IL-13 mRNA水平都显著增高,且都在4 h上升到最高值(25倍和41倍);之后在24 h有所下降,但与4 h组比较差异无统计学意义。
| 表 1 SO2衍生物对人BEP2D细胞MUC5AC和IL-13 mRNA的影响(x±s) |
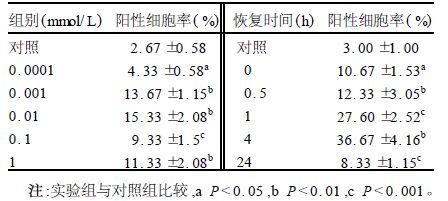
2.2 MUC5AC的免疫细胞化学分析(表 2)
表 2可见,对照组细胞中MUC5AC阳性细胞很少[(2.67±0.58)%],SO2衍生物处理后MUC5AC阳性细胞数显著增加(4.33%~15.33%)。恢复实验也表明,4 h时阳性细胞数量多[(36.67±4.16)%]。不加一抗的阴性对照无特异性染色。
| 表 2 SO2衍生物对BEP2D细胞MUC5AC蛋白表达的影响(x±s) |
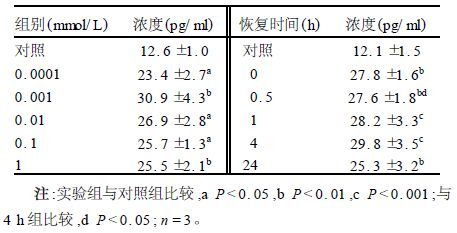
2.3 IL-13的ELISA分析(表 3)
表 3可见,在所测浓度范围内及恢复时间内BEP2D细胞培养液中IL-13的水平均分别比各自对照组显著升高,且恢复时间效应是在4 h出现最高值。虽然恢复24 h的数值比4 h的值有所降低,但与之比较差异有统计学意义;其值与对照组比较显著增高。
| 表 3 SO2衍生物对BEP2D细胞上清液IL-13水平的影响(x±s) |
3 讨论
支气管上皮细胞是机体防御外来刺激进入的第一道屏障,并通过分泌黏液和释放炎性细胞因子发挥其生物学效应,与哮喘的发病有联系[4, 5, 10]。MUC5AC是呼吸道上皮细胞特有的分泌黏蛋白的基因[4],黏蛋白对正常呼吸系统有重要的保护功能,然而,黏液过度分泌可使黏液层增厚、变稠,纤毛活动受阻,使上呼吸道排出有害物质的能力减弱,诱发各种呼吸道炎症,引发哮喘等慢性呼吸系统疾病[11]。IL-13是一种细胞因子,在哮喘的发病机制中有重要作用。有研究表明,哮喘患者支气管黏膜和痰液中IL-13的基因mRNA表达上调[12],且外来刺激物会引起支气管上皮细胞IL-13的基因表达显著增加[13]。IL-13作用于支气管上皮细胞可以引起气道高反应性、黏液分泌增多、炎性细胞浸润、促进IgE合成等,使气道炎症加重,导致哮喘[5]。
吸入SO2易在呼吸道溶解并形成其衍生物[7]。本研究表明,SO2衍生物能增加人BEP2D细胞MUC5AC和IL-13 mRNA和蛋白表达,即使在染毒结束后的一段时间内,上述基因表达增加的效应仍然存在,提示SO2衍生物对人BEP2D细胞的影响是通过转录和翻译水平的调节引起的,这可能是SO2加重哮喘疾病的原因之一。
| [1] | Kourosh R Ahmadil, David B Goldstein. Multifactorial diseases:Asthma genetics point the way[J]. Current Biology, 2002, 12 : R702–R704. DOI:10.1016/S0960-9822(02)01211-3 |
| [2] | Linn WS, Avol EL, Peng R, et al. Replicated dose-response study of sulfur dioxide effects in normal,atopic and asthmatic volunteers[J]. Am Rev Respir Dis, 1987, 136 : 1127–1134. DOI:10.1164/ajrccm/136.5.1127 |
| [3] | Anderson E, Knutsson A, Hagberg S, et al. Incidence of asthma among workers exposed to sulphur dioxide and other irritant gases[J]. Eur Respir J, 2006, 27(4) : 720–725. DOI:10.1183/09031936.06.00034305 |
| [4] | Morcillo EJ, Cortijo J. Mucus and MUC in asthma[J]. Curr Opin Pulm Med, 2006, 12(1) : 1–6. DOI:10.1097/01.mcp.0000198064.27586.37 |
| [5] | Wills-Karp M, Luyimbazi J, Xu X, et al. Interleukin-13:central mediator of allergic asthma[J]. Science, 1998, 282 : 2258–2261. DOI:10.1126/science.282.5397.2258 |
| [6] | Meng ZQ. Oxidative damage of sulfur dioxide on various organs of mice:sulfur dioxide systemic oxidative damage agent[J]. Inhal Toxicol, 2003, 15(2) : 181–195. DOI:10.1080/08958370304476 |
| [7] | Meng ZQ, Qin GH, Zhang B, et al. DNA damaging effects of sulfur dioxide derivatives in cells from various of mice[J]. Mutagenesis, 2004, 119(6) : 465–468. |
| [8] | Bai JL, Meng ZQ. Effects of sulfur dioxide on apoptosis-related gene expressions in lungs from rats[J]. Regul Toxicol Pharmacol, 2005, 43(3) : 272–279. DOI:10.1016/j.yrtph.2005.09.002 |
| [9] | Qin GH, Meng ZQ. Effect of sulfur dioxide inhalation on CYP1A1 and CYP1A2 in rat liver and lung[J]. Toxicol Lett, 2005, 160 : 34–42. DOI:10.1016/j.toxlet.2005.06.002 |
| [10] | Velden VH, Versnel HF. Bronchial epithelium:morphology,function and pathophysiology in asthma[J]. Eur Cytokine Netw, 1998, 9 : 585–597. |
| [11] | Knowles M, Boucher R. Mucus clearance as the primary innate defense mechanism for mammalian airways[J]. J Clin Invest, 2002, 109 : 571–577. DOI:10.1172/JCI0215217 |
| [12] | Berry MA, Parker D, Neale N, et al. Sputum and bronchial submucosal IL-13 expression in asthma and eosinophilic bronchitis[J]. J Alergy Clin Immunol, 2004, 114 : 1106–1109. DOI:10.1016/j.jaci.2004.08.032 |
| [13] | Pathmanathan S, Krishna M T, Blomberg A, et al. Repeated daily exposure to 2 ppm nitrogen dioxide upregulates the expression of IL-5,IL-10,IL-13,and ICAM-1 in the bronchial epithelium of healthy human airways[J]. Occupational and Environmental Medicine, 2003, 60 : 892–896. DOI:10.1136/oem.60.11.892 |
 2007, Vol. 23
2007, Vol. 23