随着射线与辐射技术应用的愈来愈广, 职业接触人数不断增加, 电离辐射及其对机体的损伤引起人们广泛关注。辐射可导致具有严密超螺旋结构的DNA发生链断裂, 断片游离, 使染色体发生各种畸变。辐射导致的生物学效应除与暴露射线的种类、剂量、受照方式、辐射品质等因素有关外, 还与机体对损伤的修复功能密切相关。研究报道, 健康人群中辐射敏感性的显著不同, 其根源可能在于DNA修复酶的基因多态性〔1, 2〕。本研究采用1:1病例对照研究方法, 分析2组人群的人类着色性干皮病基因(XPD)等位基因分布频率, 探讨XPD基因多态性与辐射损伤易感性的关系, 为寻找个体对电离辐射易感的分子标志物提供依据。
1 对象与方法 1.1 对象以唐山市所有从事射线工作的人员为对象(即利用射线装置从事医学检查、治疗、工业探伤、食品处理等领域的工作人员1 457人), 在全面健康体检的基础上, 选择有染色体异常的放射人员182人为病例组, 同时以年龄相差不超过5岁、同性别、同民族、同工作单位、同工种、累积工龄相差不超过1年, 累积受照剂量相同且无辐射损伤的放射人员为暴露对照组, 进行1:1配对。
1.2 现场调查采用统一的调查表, 对研究对象进行面对面调查。内容包括基本情况、疾病史、接触有毒有害物质情况、吸烟情况及生活习惯等。根据《放射人员登记表》详细摘录工种、工龄、累积受照剂量及职业变动史。现场采集静脉血5 ml, 取0.5 ml加质量分数2%乙二胺四乙酸二钠盐(EDTA)抗凝, 进行实验室检查。
1.3 染色体分析采用微量全血培养法, 取静脉血0.5 ml, 加入含有20%小牛血清的RPMI1 640培养基培养54 h, 收获前4~6 h加入秋水仙素, 常规制片, 姬姆萨染色, 油镜下观察200个分散良好的中期分裂相, 统计有畸变的细胞数, 计算细胞畸变率。观察的染色体畸变类型包括双着丝粒染色体、断片、微小体、环状染色体。观察的细胞中染色体出现任何一种畸变记为异常, 一个细胞中出现1条或1条以上染色体畸变均记为1个畸变细胞。
1.4 XPD基因检测盐析法提取DNA。采用聚合酶链反应-限制性片断长度多态性(PCR-PFLP)方法分析X PD基因751、312位点基因型分布情况。PCR引物序列分别为5'-TCAAACATCCTGTCCCTACT-3'和5'-CTGCGATTAAAGGCTGTGG-A-3', 5'-TGACCGGTGCCAGGGCAACC-3'和5'-GGACACGGCTCTGCATAACC-3'。反应体系为25 μl, 含0.1 μg模板DNA、10 Lmol/L上下游引物, 2.5 mmol/L dNTPs, 25 mmol/L MgCl2, 1.0 U T aqDNA聚合酶及10×Buffer。反应条件:751位点为94 ℃预变性3 min、94 ℃变性1 min、58 ℃退火30 s, 72 ℃延伸30 s为一个循环, 共扩增35个循环, 结束后于72 ℃延伸5 min; 312位点为94 ℃预变性30 min、94 ℃变性1 min、60 ℃变性1 min、72 ℃延伸50 s为一个循环, 共扩增35个循环, 结束后于72 ℃延伸6 min。各取PCR产物5 μl, 加入限制性内切酶Pst ⅳ或Sty ⅳ置37 ℃水浴消化4 h。用2.5%琼脂糖凝胶电泳分析酶切产物。XPD751位点基因型:野生型纯合子(Lys/Lys)为234 bp和110 bp, 杂合子(Lys/Gln)为234, 171, 110和63 bp, 突变型纯合子(Gln/Gln)为171, 110和63 bp。XPD312位点基因型:野生型纯合子(Asp/Asp)为604 bp, 杂合子(Asp/Asn)为640, 485, 119 bp, 突变型纯合子(Asn/ Asn)为485, 119 bp。
1.5 统计分析用Excel建库, SAS 6.12统计软件进行分析; 定量资料进行1:1配对t检验、非正态分布资料用配对符号秩和检验、配对计数资料用1:1配对χ2检验、多分类有序及无序资料采用行×列表χ2检验、Hardy-Weinberg遗传平衡定律进行χ2检验〔3〕。
2 结果 2.1 一般情况本研究选择有染色体异常的182人, 其中, 男143人(78.6%), 女39人(21.4%), 平均年龄(37.7±8.9)岁, 范围22~58岁。文化程度初中及以下15人(8.24%), 高中及中专87人(47.80%), 大专及以上80人(43.96%)。对照组与病例组性别及民族一一匹配, 平均年龄(38.1±8.6)岁, 范围22~56岁。文化程度初中及以下13人(7.14%), 高中及中专89人(48.90%), 大专以上80人(43.96%)。病例组与对照组的年龄分布、文化程度差异均无统计学意义(χ2=0.629, P > 0.05;χ2=0.028, P> 0.05)。
2.2 研究人群Hardy-Weinberg遗传平衡定律检验对研究人群进行Hardy-Weinberg遗传平衡定律检验。结果显示, Hardy-Weinberg平衡定律的拟合优度均优良, 样本人群具有良好的代表性, 可以从基因型频率来估计基因频率(χ2=1.15, P > 0.05;χ2=0.028, P > 0.05)。
2.3 染色体损伤影响因素分析影响放射人员外周血淋巴细胞染色体损伤的主要因素有暴露射线的种类、累积受照剂量、受照方式、吸烟情况。
2.3.1 研究对象的工种分布暴露射线的种类与工种有关, 病例182人中, 从事X线诊断31人, X线投照29人, CT检查38人, 核医学12人, (导管室、放疗、介入治疗)14人, 加速器操作8人, 测井4人, 工业探伤14人, 核仪表观测32人。对照组的工种与病例一一匹配, 工种相同。
2.3.2 病例组与对照组累积放射工龄及累积受照剂量比较累积放射工龄是职业环境中机体暴露于射线的重要因素, 工龄的长短可直接影响累积受照剂量的大小, 病例组平均工龄(12.61±8.98)年, 范围0.2~33年。对照组平均工龄(13.75±9.43)年, 范围0.2~34年, 2组间分布差异无统计学意义(χ2=1.088, P > 0.05)。累积受照剂量是辐射致染色体损伤的决定性因素, 在随机效应中, 效应发生的频度随剂量增加而增加, 而确定性效应, 在一定的阈剂量以上, 剂量越大效应越严重〔4〕。病例组累积受照剂量M=24.76(QL=12.62, QU=45.90) mSv, 对照组累积受照剂量M=25.23, (QL=13.37, QU=44.97) mSv, 2组间分布经检验, 差异无统计学意义(P > 0.05)。
2.3.3 病例组和对照组吸烟情况比较为排除吸烟的影响, 对182对研究对象的吸烟情况进行比较, 经比较2组的吸烟率(病例组19.2%, 对照组18.7%)及吸烟指数差异无统计学意义(P > 0.05)。
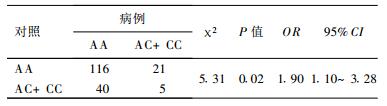
2.4 病例组与对照组XPD751, 312位点基因型及等位基因分布比较结果显示, 751(A/C)位点野生型AA与突变型(包括突变杂合子AC和突变纯合子CC)基因在2组间分布差异有统计学意义(P < 0.05), 病例组野生基因型AA频率高于对照组; 312(G/A)位点野生型GG与突变型(包括突变杂合子GA和突变纯合子AA)基因在病例组与暴露对照组之间差异无统计学意义(P > 0.05), 见表 1, 2。
| 表 1 病例组与对照组XPD751位点基因型分布比较 |
| 表 2 病例组与对照组XPD312位点基因型分布比较 |
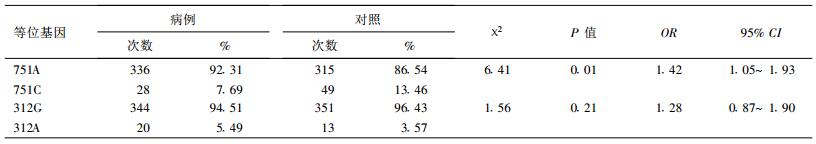
对XPD751, 312位点等位基因携带率比较结果显示, 751A等位基因频率病例组高于对照组, 差异有统计学意义(P < 0.05);312位点等位基因两组间频率分布比较, 差异无统计学意义(P > 0.05), 见表 3。
| 表 3 XPD等位基因携带比较 |
3 讨论 3.1 XPD751位点基因多态性与染色体损伤的关系
XPD751位点基因多态性以35931A→ C替代物为特性, 导致编码XPD751蛋白Lys→ Gln氨基酸的改变, 不同区域的氨基酸变异可能影响不同蛋白质的相互作用, 从而导致不同表现型。目前对XPD基因751(A/C)突变的意义还不十分清楚, 但研究表明, 可能是减少了DNA修复能力, 并增加了癌症发生的易感性〔5〕。本次研究发现, XPD751位点野生型AA与突变型基因(包括突变杂合子AC和突变纯合子CC)在病例组与对照组之间差异有统计学意义(OR=1.90, 95% CI=1.10~3.28, P < 0.05), 病例组野生基因型频率高于对照组。751A等位基因频率病例组(92.31%)高于对照组(86.54%), 差异有统计学意义(OR=1.42, 95% CI=1.05~1.93, P < 0.05)。结果表明, 751AA基因型在辐射致染色体损伤过程中可能是一种危险因素。这与Angelini〔6〕、Moller〔7〕、Lunn〔8〕等的研究结果一致, 他们在研究中发现, Lys751Lys与降低的X射线导致的DNA损伤修复有关。
3.2 XPD312位点基因多态性与辐射致染色体损伤的关系以往序列比对的研究结果显示, 312位点是一个进化上高度保守的位点, 提示其在维持XPD蛋白功能上起一定作用; 而751位于X PD蛋白的N端, 保守性差, 但这2个基因表型的变化均可导致一些反映DNA修复能力的指标的变化〔9〕。
本研究未发现, XPD312位点与辐射致染色体损伤有关联, 病例组312(GA+AA)和312GG基因型与对照组比较, 分布差异无统计学意义(P > 0.05)。312A等位基因在病例组与对照组的分布差异无统计学意义(P > 0.05)。Goode等的研究报道, Asp312等位基因增加肺癌风险〔10〕。Butkiewicz等的研究结果, Asp312纯合子增加非小细胞肺癌的发病风险, 而且发现XPD312Asp和751Lys多态性在所研究的人群中呈连锁不平衡〔11〕。有研究证实, XPD312Asp等位基因的变异可减弱细胞的凋亡反应, 从而使致癌物损伤的细胞存活并增殖, 引起肿瘤患病风险的增高〔12〕。Joanna等在对体外淋巴细胞辐射损伤及修复的研究中发现, XPD312Asn等位基因与降低的修复速率有关〔13〕。本次结果中, 312位点总突变频率为0.09, 远低于欧美人群0.32~0.42的频率〔9〕, 可能由于种族和环境因素所致, 此位点基因多态性与辐射致染色体损伤之间是否存在联系, 还有待进一步探讨。
本次研究结果显示, XPD基因多态性对辐射至染色体损伤存在一定影响, 提示XPD基因多态性是构成个体辐射易感性的重要因素, 这对职业医学领域识别和筛检辐射高危人群具有一定积极的意义。
| [1] | Hall J, Angele S, Radiation. DNA damage and cancer[J]. Mol Med Today, 1999, 60(5) : 157–164. |
| [2] | Gatti RA. The inherited basis of human radiosensitivit[J]. Acta Oncol, 2001, 40 : 702–711. DOI:10.1080/02841860152619115 |
| [3] | 黄代新, 杨庆恩. 卡方检验和精确检验在HWE检验中的应用[J]. 法医学杂志, 2004, 20(2) : 116–119. |
| [4] | 金泰虞. 职业卫生与职业医学[M].5版. 北京: 人民卫生出版社, 2003: 297. |
| [5] | Benhamuo S, Sarasin A. ERCC2/XPD polymorphisms and cancer risk[J]. Mutagenesis, 2002, 17(6) : 463–469. DOI:10.1093/mutage/17.6.463 |
| [6] | Sabrina Angelini, Rajiv Kumar, Fabio Carbone, et al. Micronuclei in humans induced by exposure to low level of ionizing radiation: influence of polymorphisms in DNA repair genes[J]. Mutation Research, 2005, 570(1) : 105–117. DOI:10.1016/j.mrfmmm.2004.10.007 |
| [7] | Moller P, Wallin H, Dybdahl M, et al. Psoriasis patients with basal cell carcinoma have more repair-mediated DNA strand-breaks after UVC damage in lymphocytes than psoriasis without basal cell carcinoma[J]. Cancer Letter, 2000, 151 : 187–192. DOI:10.1016/S0304-3835(99)00414-0 |
| [8] | Lunn RM, Hellzlsourer KJ, Parshad R, et al. XPD polymor phisms.effect on DNA repair proficieney[J]. Carcinogenesis, 2000, 21(4) : 551–555. DOI:10.1093/carcin/21.4.551 |
| [9] | Shen MR, Jones IM, Mohrenweiser H. Nonconservative amino acid substitution variants exist at polymorphic frequency in DNA repair genes in healthy humans[J]. Cancer Res, 1998, 58(4) : 604–608. |
| [10] | Goode EL, Ulrich CM, Potte JD. Polymorphisms in DNA repair gene and associations with cancer risk[J]. Cancer Epidemiol Biomarkers Prev, 2002, 11(12) : 1513–1530. |
| [11] | Butkiewicz D, Rusin M, Enewold L, et al. Genetic polymorphisms in DNA repair genes and risk of lung cancer[J]. Carcinogenesis, 2001, 22(4) : 593–597. DOI:10.1093/carcin/22.4.593 |
| [12] | Seker H, Butkiewicz D, Bowman ED, et al. Functional significance of XPD polymorphic variants:attenuated apoptosis in human lym-phoblastoid cells with the XPD 312Asp/Asp genotype[J]. Cancer Research, 2001, 61(20) : 7430–7434. |
| [13] | Joanna RW, Joanna P, Monika P, et al. Influence of polymor-phisms in DNA repair genes XPD, XRCC1 and MGMT on DNA damage induced by gamma radiation and its repair in lymphocytes in vitro[J]. Radiation Research, 2005, 164 : 132–140. DOI:10.1667/RR3400 |
 2007, Vol. 23
2007, Vol. 23