镍(Ni)是人类条件必需的微量元素和常见工业及环境污染物之一, 其毒性可累及肝、肾、肺和心血管等系统, 对机体的许多酶系统也有一定毒害作用〔1〕。国际癌症研究机构(IARC)将镍及其化合物列为第一类致癌物。以往研究证实, 镍化合物对雌雄两性的生殖功能均有不良影响, 有关镍干扰小鼠动情周期, 诱发卵巢细胞凋亡, 引起卵巢早衰的机制未见报道。本研究以卵巢贴片细胞形态学变化结合流式细胞仪分析细胞周期, 探讨镍诱导小鼠卵巢细胞凋亡的毒作用及其机制, 为研究镍生殖毒性机制及其防治提供实验依据。
1 材料与方法 1.1 实验动物健康雌性昆明种小白鼠48只(兰州大学实验动物中心)。
1.2 试剂与仪器硫酸镍(NiSO4), AR (西安化学试剂厂); 4%美蓝; 吉姆萨染液; 75%乙醇; 磷酸缓冲液(PBS); 碘化丙啶(PI); 美国COUL TER EPICSRXI型流式细胞仪; 80-2离心沉淀器(上海手术器械厂); OL YMPUS光学显微镜, 设备号051750。
1.3 实验方法动物入室适应环境3 d, 按体重分层随机分为4组, 12只/组。腹腔注射1次/d, 连续12 d。NiSO4染毒剂量的选择依据小鼠NiSO4腹腔注射染毒半数致死量(LD50)
(40 mg/kg)的1/4, 1/8, 1/16进行, 以NiSO4计分别为10.0, 5.0, 2.5 mg/kg, 对照组以生理盐水0.2 ml/(10 g·bw)腹腔注射。阴道涂片美蓝染色后镜下观察细胞形态。染毒结束后摘取卵巢待检。细胞贴片吉姆萨染色油镜下观察细胞形态并进行统计分析; 其中凋亡指数〔2〕=(100个细胞中凋亡细胞数目/100)×100。流式细胞仪检测结果用Muticycle软件分析亚二倍体峰及细胞周期, 得出各细胞周期百分率, 并按以下公式计算增殖指数(PI)〔3〕: 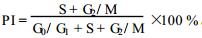
采用SPSS 11.5统计软件进行处理。流式细胞术检测结果以Muticycle软件分析, 统计细胞周期不同时相细胞比例及凋亡率。
2 结果 2.1 一般状况染毒早期动物出现轻微兴奋表现, 于染毒后期表现为不同程度精神萎靡、活动减少、拥挤蹲伏、毛发蓬松等。
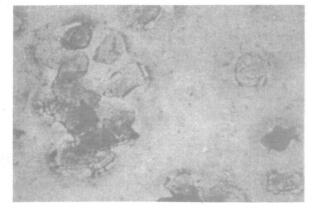
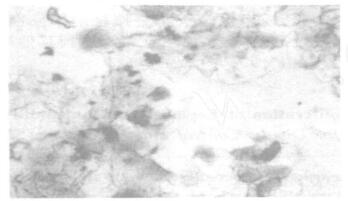
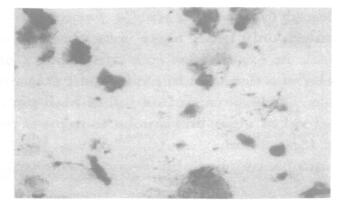
2.2 NiSO4对雌性小鼠动情周期的影响(图 1~4)
|
图 1 动情前期 |
|
图 2 动情期 |
|
图 3 动情后期 |
|
图 4 动情间期 |
实验结果显示, 对照组小鼠动情周期较规律, 各染毒组小鼠表现为非动情期延长, 主要是动情前期延长且不规则, 光镜下可见有大量上皮细胞, 呈粒状胞浆, 尚有少量角化上皮细胞, 但无白细胞, 尤以高剂量组更为显著。可见染毒组小鼠在染毒期间动情周期受到抑制。
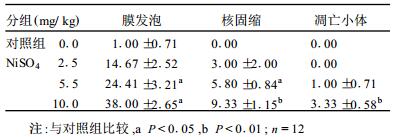
2.3 NiSO4导致小鼠卵巢细胞凋亡的形态学变化(表 1)| 表 1 小鼠卵巢细胞凋亡的形态学变化(x ± s) |
表 1数据表明, 低剂量组小鼠卵巢细胞的凋亡情况与对照组比较, 差异无统计学意义(P > 0.05);中剂量组小鼠卵巢细胞的凋亡情况与对照组比较, 差异有统计学意义(P < 0.05);高剂量组小鼠卵巢细胞的凋亡情况与对照组比较, 差异有统计学意义(P < 0.01)。
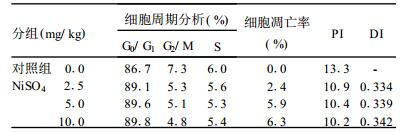
2.4 腹腔注射硫酸镍对小鼠卵巢细胞周期的影响(表 2)| 表 2 NiSO4对小鼠卵巢细胞周期的影响(%) |
由表 2可见, 不同剂量组细胞周期分布均以G0/G1期为主, 而且随剂量增加G0/G1期细胞比较增高, 表明该期细胞阻滞; G2、S期细胞比率下降; 随剂量增加细胞凋亡率增加、PI降低(促进凋亡)、DI增加。
3 讨论卵巢的主要功能表现为周期性的排卵及其分泌相应激素水平的周期性变化, 同时伴有阴道上皮细胞学的周期性变化〔4〕。雌性动物发情周期有4个时期〔5〕, 不同时相阴道脱落细胞学细胞形态不同。判定小鼠生理周期的主要依据是阴道上皮细胞类型〔6〕, 其成熟程度与体内雌激素水平成正比〔7〕, 大量白细胞和有核上皮说明体内雌激素水平较低, 处于动情间期, 持续出现该现象预示动情周期被抑制和紊乱。王学习等〔8〕研究亦显示, 腹腔注射硫酸镍染毒后大鼠动情周期延长。可能机制是过量镍进入机体, 损伤卵巢功能, 使雌激素分泌水平下降所致。
流式细胞仪能准确快速的分析细胞周期、测定细胞DNA含量〔9-11〕, 确定细胞周期长短和不同时期的比例变化情况。细胞按G1-S-G2-M顺序完成增殖过程, 细胞凋亡与细胞周期密切相关, 阻断细胞周期进程可引起细胞凋亡, 而凋亡也常伴有生长阻滞〔12, 13〕。不同因素诱导的凋亡发生在细胞周期不同时相〔14〕。以往研究证实, 过量镍进入机体后, Ni2+与DNA碱基结合, 使有序的DNA氢系统不稳定, 引起DNA2蛋白质交联和DNA单链断裂, 导致DNA损伤和细胞毒性作用。本研究进一步表明, 硫酸镍导致卵巢损伤是通过抑制细胞增殖, 诱导细胞凋亡途径实现的。这可能是NiSO4诱发机体卵巢早衰的原因之一。
| [1] | 刚葆琪, 庄志雄. 我国镍毒理学研究进展[J]. 卫生毒理学杂志, 2000, 14(3) : 129–135. |
| [2] | 彭黎明, 王曾礼. 细胞凋亡的基础与临床[M]. 北京: 人民卫生出版社, 1982: 777. |
| [3] | 阳朝晖, 宋健, 程蓓, 等. 刺激素促进合成型大鼠血管平滑肌细胞增殖并诱导细胞周期特异性凋亡[J]. 中华实验外科杂志, 2005, 22(3) : 328–33. |
| [4] | 刘茹, 陈建锋. 辛硫磷对大鼠卵巢抗氧化系统功能的影响[J]. 环境与职业医学, 2004, 21(2) : 94–97. |
| [5] | 张忠诚. 家畜繁殖学[M]. 北京: 中国农业出版社, 2000: 97-98. |
| [6] | 高建民, 索伦, 张建芳, 等. 小鼠动情周期与超排效果[J]. 黑龙江动物繁殖, 2005, 13(1) : 3–5. |
| [7] | 郑陆, 潘力平, 隋波, 等. 运动性动情周期紊乱动物模型的建立[J]. 山东体育学院学报, 2005, 21(2) : 46–49. |
| [8] | 王学习, 朱玉真. 硫酸镍对雌性大鼠性腺机能的影响[J]. 中国公共卫生, 2003, 19(8) : 946–947. |
| [9] | 张俊娥, 刘继红, 邓秀新. 采用倍性分析仪鉴定柑橘愈伤组织的遗传变异[J]. 遗传学报, 2003, 30(2) : 169–174. |
| [10] | Doleze I J. Flow cytometry analysis of nulear DNA content in higher plants[J]. Phytochem Anal, 1991, 2 : 143–154. DOI:10.1002/(ISSN)1099-1565 |
| [11] | Gallbraith DW, Harkins KR, Maddox J M, et al. Rapid cycle in intact plant tissues[J]. Science, 1983, 220 : 1049–1051. DOI:10.1126/science.220.4601.1049 |
| [12] | 曲乐丰, 景在平. 血管平滑肌细胞凋亡在腹主动脉瘤形成机制中的作用[J]. 中华实验外科杂志, 1999, 16 : 477–478. |
| [13] | Evan GI, Brown L, Whyte M, et al. Apoptosis and the cell cycle[J]. Curr Opin Cell Biol, 1995, 7 : 825–834. DOI:10.1016/0955-0674(95)80066-2 |
| [14] | Gong J, Li X, Darzynkiewicz Z. Different patterns of apoposis of HL-60 cell induced by cycloheximide and camptothecin[J]. J Cell Physiol, 1993, 157 : 263–270. DOI:10.1002/(ISSN)1097-4652 |
 2007, Vol. 23
2007, Vol. 23