2. 德州学院数学与大数据学院, 山东 德州 253000
2. College of Mathematics and Big Data, Dezhou University, Dezhou 253000 China
肺癌的发病率和死亡率在我国各类恶性肿瘤中均居首位,分别占全部恶性肿瘤发病率和死亡率的 22.0%和 28.5%[1]。除血行、淋巴转移、直接侵犯等常见的侵袭模式,世界卫生组织2015年首次提出了肺癌新的侵袭模式—气腔播散(spread through air spaces,STAS)。STAS最常见于浸润性肺腺癌(invasive lung adenocarcinoma ,IAC)中,与肺癌患者肿瘤复发或不良预后密切相关[2-3]。STAS的诊断标准是手术后的常规病理,目前尚无其他方法对术前患者进行有效评估以帮助临床医生选择合适的手术方式、放疗靶区精准勾画等,影响患者预后。CT检查是最常用且最有效的肺癌术前诊断方法,笔者认为可通过病灶的CT征象来预测IAC患者STAS阳性的可能。本研究收集我院经手术病理证实为IAC患者的资料,根据其是否发生STAS分为2组,通过回顾性分析方法,比较2组患者在临床特征及病灶CT征象、病理学特征等方面的区别,以期评估或预测IAC患者发生STAS的可能性,探索应用CT检查来预测IAC患者发生STAS的临床应用价值。
1 材料与方法 1.1 临床资料收集我院2018年1月—2023 年1月经手术病理证实的236例IAC患者,其中男101例(42.80 %) ,女135例(57.20 %) ,年龄30~78岁,平均年龄(60.95 ± 9.62)岁。依据纳入标准(I~III期患者)分为STAS阳性及阴性组,患者各118例。
本研究收集的资料有:(1)临床资料:性别、年龄、吸烟史、肿瘤家族史;(2)病理资料:病理类型及分期等;(3)CT征象:病变部位、形态、密度分类、肿瘤平均径线、实性成分平均径线、实性成分占比值、瘤-肺界面、分叶征、毛刺征、空泡/空洞、空气支气管征、胸膜凹陷征、血管改变。
1.2 CT检查方法及图像分析采用Siemens Somatom Definition AS螺旋CT机进行胸部吸气末屏气扫描,管电压120 kV,自适应管电流,层厚5.0 mm,重建层厚1.0 mm,重建间隔0.75 mm,必要时行冠状位、矢状位重建,传输图像至PACS工作站。图像观察:肺窗窗宽为
遵循2015年版WHO肺部肿瘤分型及诊断标准[4],并做出病理分期。STAS定义[5]为肿瘤细胞出现在远离主病灶的正常肺泡腔中,并以微细胞簇、小癌巢或单个细胞的形式出现,播散出的肿瘤细胞必须与主病灶无直接连接。
1.4 统计学分析应用SPSS 22.0进行统计学分析。计量资料采用均数 ± 标准差(
2组之间性别组成、吸烟史、肿瘤家族史等临床特征对于STAS发生无统计学意义;年龄分布对于STAS发生具有统计学意义,年龄越大发生STAS概率越大(表1)。
|
|
表 1 STAS阳性组与阴性组临床资料对照 Table 1 Comparison of clinical data between STAS-positive and STAS-negative groups |
统计学分析显示,肿瘤密度改变、肿瘤形态及边缘情况(形态、瘤-肺界面、分叶征、毛刺征、胸膜凹陷征)、内部特征(空泡/空洞征、空气支气管征)、血管改变、肿瘤平均径线、实性成分平均径线、实性成分占比值组间差别具有统计学意义,而肿瘤发病部位组间差别无统计学意义,见表2及图1~4。
|
|
表 2 STAS阳性组与阴性组CT征象与STAS对照 Table 2 Comparison of CT signs between STAS-positive and STAS-negative groups |
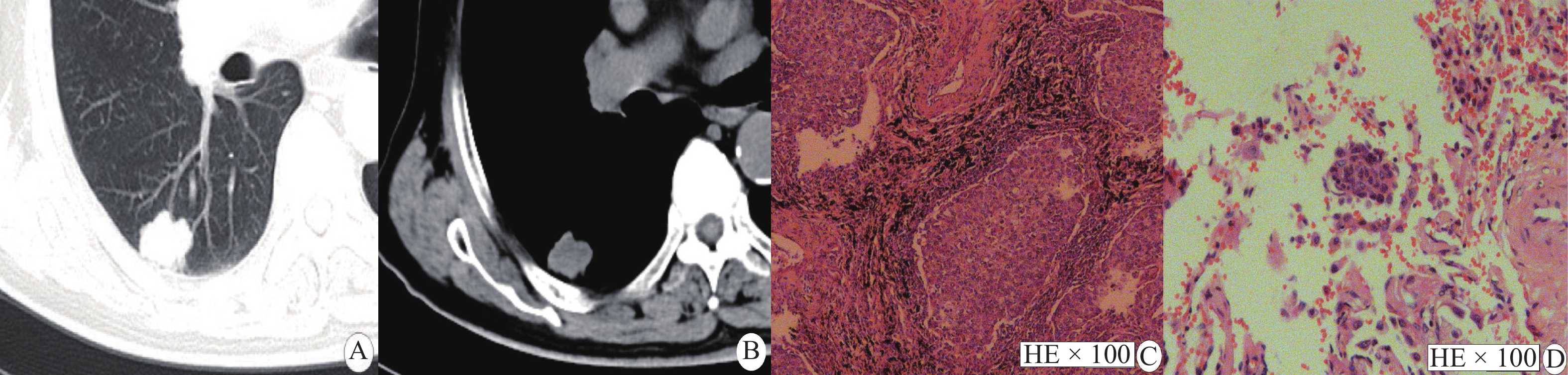
|
图 1 实性结节显示STAS阳性 Figure 1 Solid nodule shows a STAS-positive case 注:男性,72岁,IAC患者,STAS阳性。A、B:CT示右肺下叶胸膜下实性结节,最大平均径线23.0 mm,实性成分平均径线23.0 mm,实性成分占比值1.0;C:病理图片(HE × 100)显示实体型腺癌;D:病理图片(HE × 100)显示肺泡腔内游离肿瘤细胞。 |
|
图 2 部分实性结节显示STAS阳性 Figure 2 Part-solid nodule shows a STAS-positive case 注:女性,35岁,IAC患者,STAS阳性。A:CT示右肺中叶部分实性结节,最大平均径线18.0 mm,实性成分平均径线15.0 mm,实性成分占比值0.83;B:病理图片(HE × 100)显示贴壁型腺癌伴少量微乳头成分;C:病理图片(HE × 100)显示肺泡腔内游离肿瘤细胞。 |
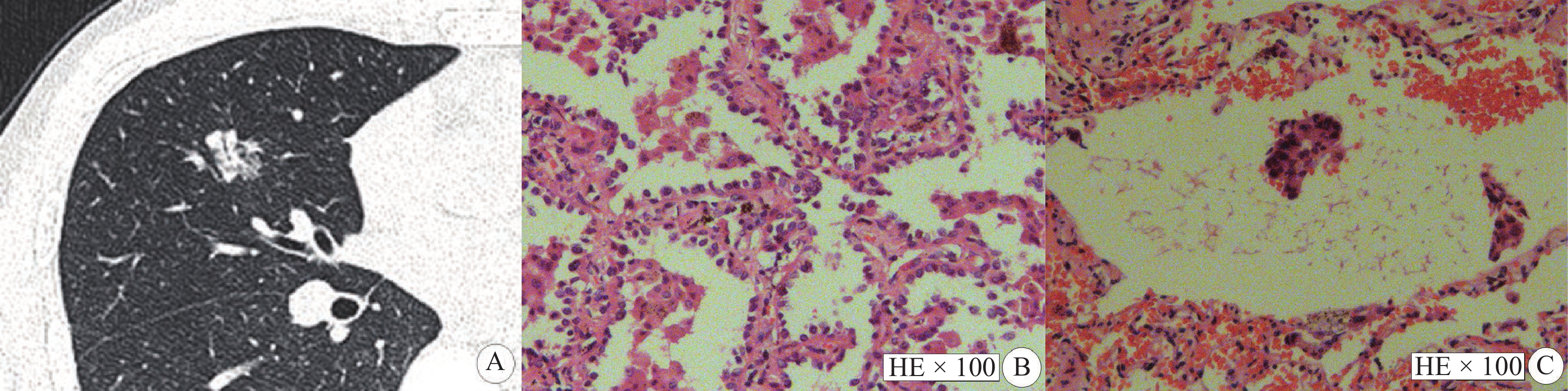
|
图 3 部分实性结节显示STAS阴性 Figure 3 Part-solid nodules shows a STAS-negative case 注:女性,42岁,IAC患者,STAS阴性。A:CT示左肺上叶舌段部分实性结节,最大平均径线10.0 mm,实性成分平均径线2.0 mm,实性成分占比值0.2;B:病理图片(HE × 100)显示贴壁型腺癌;C:病理图片(HE × 100)显示肺泡腔内未见游离肿瘤细胞。 |

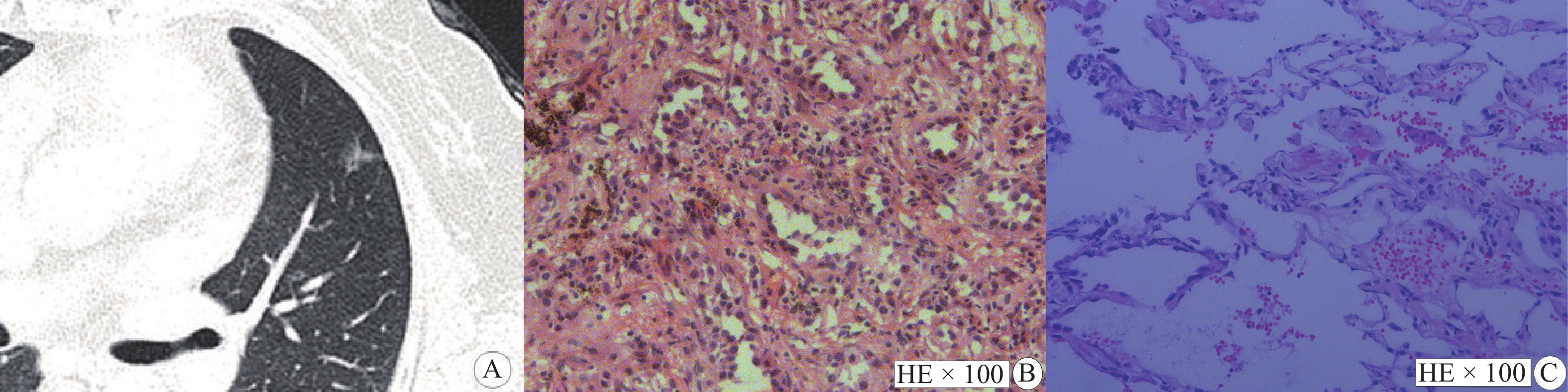
|
图 4 纯磨玻璃结节显示STAS阴性 Figure 4 Pure ground glass nodule shows a STAS-negative case 注:男性,55岁,IAC患者,STAS阴性。A:CT示右肺下叶磨玻璃结节,最大平均径线18.0 mm,实性成分平均径线0 mm,实性成分占比值0;B:病理图片(HE × 100)显示贴壁型腺癌;C:病理图片(HE × 40)显示肺泡腔内未见游离肿瘤细胞。 |
根据单因素分析结果,将组间具有统计学意义的各征象同时纳入二元Logistic回归分析中,结果显示实性成分占比值、空气支气管征、分叶征、瘤-肺界面等几个特征是预测浸润性肺腺癌STAS的独立危险因素(表3)。
|
|
表 3 用于预测CT征象与STAS关系多因素Logistic分析 Table 3 Multivariate logistic analysis for predicting the relationship between CT signs and STAS |
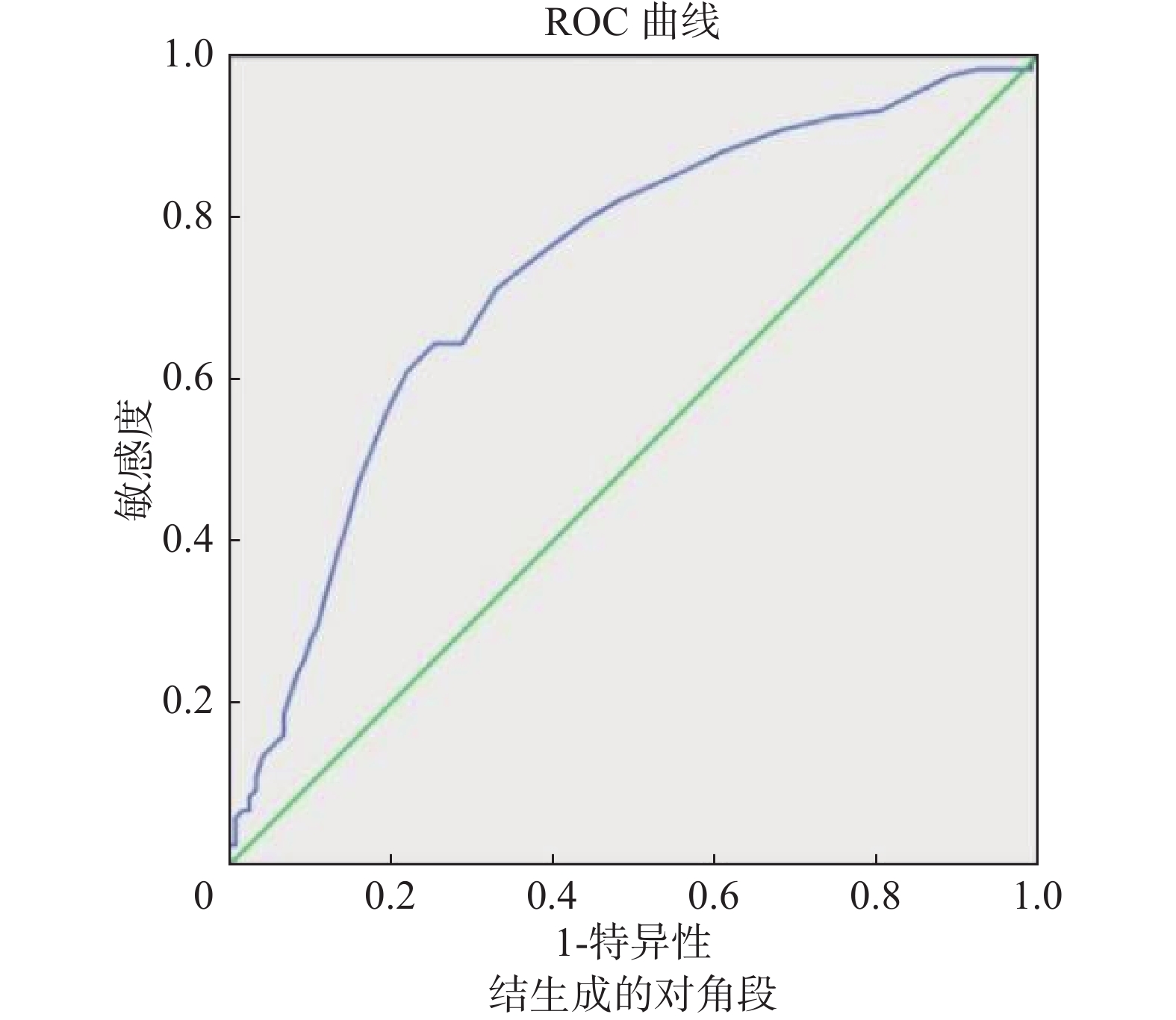
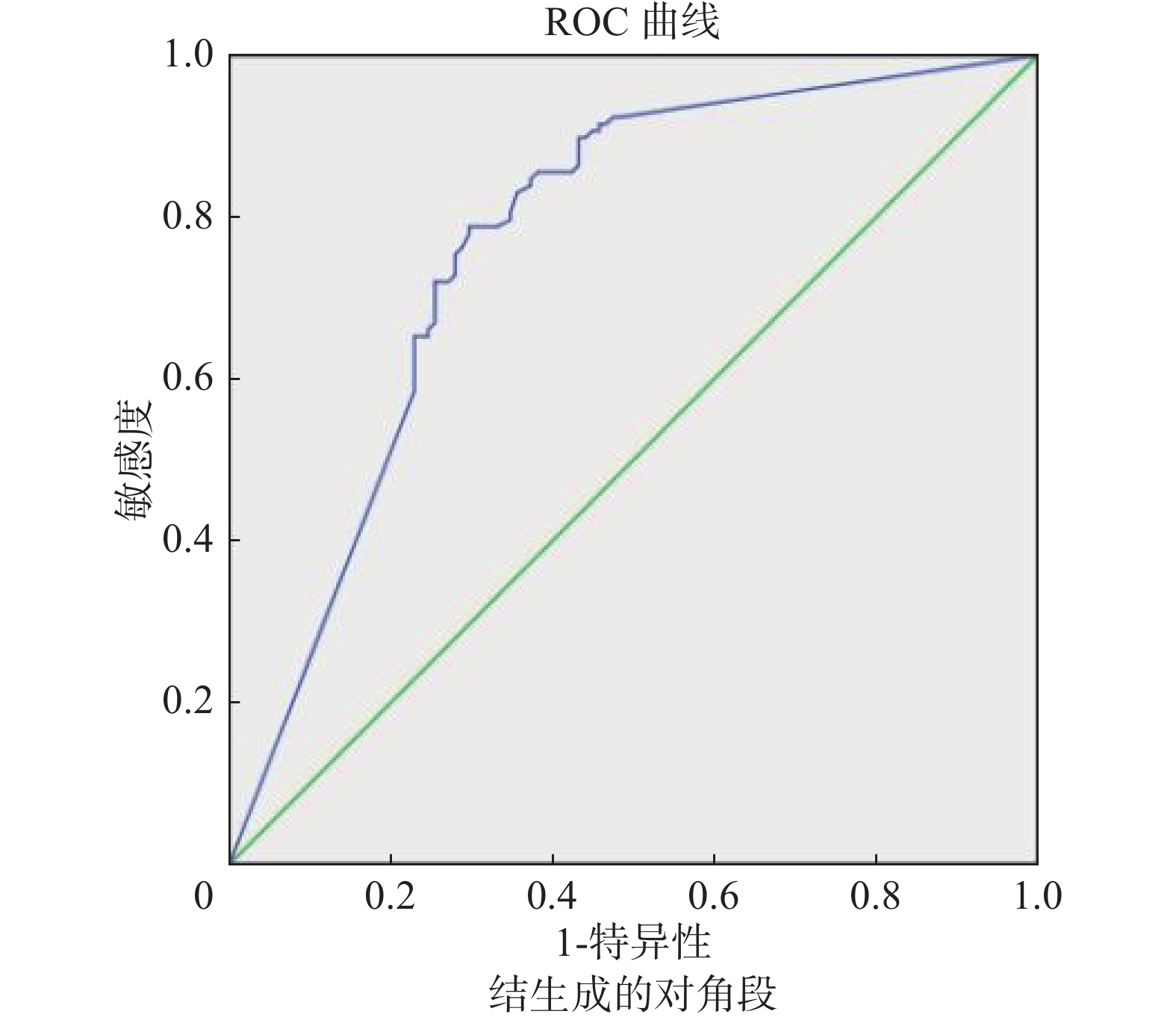
以肿瘤平均径线、实性成分平均径线、实性成分占比值等CT指标作为检测变量绘制ROC曲线,获得肿瘤平均径线AUC为0.734,以19.5 mm作为阈值时,敏感性为64.4%,特异性为74.6%;实性成分平均径线AUC为0.794,以9.1 mm作为阈值时,敏感性为82.2%,特异性为69.5%;实性成分占比值AUC为0.770,以0.65作为阈值时,敏感性为78.8%,特异性为70.3%(图5~图7)。
|
图 5 肿瘤平均径线判定STAS ROC曲线 Figure 5 Receiver operating characteristic curve for STAS prediction using mean tumor diameter |

|
图 6 实性成分平均径线判定STAS ROC曲线 Figure 6 Receiver operating characteristic curve for STAS prediction using mean diameter of solid components |
|
图 7 实性成分占比值判定STAS ROC曲线 Figure 7 Receiver operating characteristic curve for STAS prediction using percentage of tumor solid components |
本研究236例IAC患者,结果显示2组在肿瘤病理分期、组织学亚型、淋巴结转移及脉管瘤栓、是否伴微乳头成分等方面的差异均具有统计学意义(表4)。
|
|
表 4 STAS阳性组与阴性组病理学改变的比较 Table 4 Comparison of pathological changes between STAS-positive and STAS-negative groups |
在我国肺癌居2022年所有恶性肿瘤发病率和死亡率的首位。肺腺癌作为最常见的病理类型,其发病率仍呈上升趋势。STAS是浸润性肺腺癌常见转移方式,是影响患者预后的重要危险因素。
STAS阳性可增加肺癌术后肿瘤复发的概率并预示不良预后[6-7],如果对STAS阳性患者只进行局部切除,有可能存在潜在手术切缘阳性的风险,预示着具有较高的复发风险[8]。目前STAS的确诊仅能依赖术后常规病理,很难在术中冰冻条件下明确诊断。因此,学界一直致力于通过CT征象等信息来评估和预测STAS是否存在,以期为临床医生选择最佳的治疗决策提供支持和依据,改善患者预后,该项研究和预测标准也引起国内外学者的广泛关注[9-10] 。
本研究发现STAS发生与患者年龄具有一定的相关性,阳性组大于阴性组,两者差异具有明显统计学意义(P < 0.001),与孙婷婷等[11]研究结果相似,考虑年轻患者多于体检时发现病变,病变早期居多,所以STAS发生率较低,而高龄患者以出现症状就医而诊断,病变多较晚,期别较高。也有学者对患者年龄与STAS是否具有相关性存在一些争议[12-13]。本研究女性总体发病率高于男性;组内比较女性发病率均略高于男性,考虑与女性肺腺癌的总发病率高于男性有关;而两组之间男女发病率基本一致,组间数据比较差异无统计学意义(P > 0.05),认为STAS的发生与性别没有相关性,与De Margerie等[14-15] 研究结果一致。
吸烟史及肿瘤家族史虽是发生肺癌的重要危险因素,但本研究中,有无吸烟史、家族史组间发病率基本一致,差异无统计学意义(P > 0.05),所以认为二者虽可能提高肺癌发病率,但与肺癌患者STAS的发生没有显著相关性,与De Margerie等[14]的研究结果相似。
Shiono等[2]证实STAS阳性与淋巴管和胸膜浸润存在相关性;邱协[16] 证实STAS的发生与淋巴结转移具有相关性。本研究也证实了有淋巴结转移、伴脉管癌栓等病理分期较晚IAC患者更容易发生STAS,随着病理分期的增加,STAS发生率逐渐增加。Warth 等[17]发现肺腺癌不同病理组织学亚型与STAS发生密切相关,本研究结果证实了以上观点。入组236例IAC患者中,分化程度越高STAS发生率越低,分化程度越低STAS发生率越高,这也符合肺腺癌的生物学行为规律,提示临床医生在制定手术方案时应该高度重视肺腺癌病理亚型的评估和诊断。
伴有微乳头成分的肺腺癌更容易发生STAS[18],少量的微乳头成分(占肿瘤 > 1%)即可缩短患者的总生存期和无疾病生存期[19]。本研究中伴有微乳头成分者STAS发生率77.94%,不伴有微乳头成分者STAS发生率38.69%,两组之间差异具有统计学意义(P < 0.001),也证明了伴有微乳头成分的肺腺癌发生STAS阳性的概率明显高于不伴有微乳头成分的肺腺癌患者。
胸部高分辨率CT扫描是肺癌诊断及术前评估的最佳检查手段,在研究STAS发生与病灶CT征象之间关系方面发挥着重要作用。大多数学者的研究[20-22]均证实肿瘤病灶的密度、分叶征、毛刺征等在STAS阳性组与阴性组之间存在差异。本研究统计结果显示,肿瘤结节类型、形态学表现、瘤一肺界面、分叶征、毛刺征、空泡/空洞、空气支气管征、胸膜凹陷征、血管改变等均与STAS发生具有一定相关性,其中实性/部分实性结节、不规则的肿瘤形态、瘤-肺界面模糊、有分叶、毛刺、空泡/空洞、空气支气管征、胸膜凹陷、有血管改变等CT征象的病例更容易发生STAS。CT征象反映肺癌的生物学特性和病理学改变,是病理学特性的宏观表现,本研究一定程度上印证了此说法,上述临床工作中常提示恶性病变的影像征象与STAS发生具有一定相关性,而肿瘤发生部位与STAS发生没有相关性。
有学者研究发现肿瘤最大径线、实性成分最大径线、实性成分占比在STAS阳性组与阴性组之间存在差异[14,23]。文献[24]报道肿瘤直径越大肺腺癌STAS阳性风险越高,并提示肿瘤最大径每增加1 mm,STAS阳性的风险增加4.1%。De Margerie等[14]研究发现STAS阳性的肺癌直径显著大于STAS阴性的肺癌直径(直径差 > 2 mm)。本研究兼顾肿瘤长径与短径,采用平均径线进行研究,分别测量肿瘤平均径线、实性成分平均径线以及实性成分占比值。结果显示阳性组均大于阴性组,组间差异均有统计学意义(P < 0.01),所以认为以上指标与STAS的发生均具有相关性,而且随着指标数值的逐渐增加,STAS的发生概率也逐渐增大。以上述3个指标作为检查变量绘制ROC曲线,分别以19.5 mm、9.1 mm、0.65作为肿瘤平均径线、实性成分平均径线、实性成分占比值预测STAS阳性的阈值时,可以取得良好的敏感性和特异性,分别为64.4%和74.6%、82.2%和69.5%、78.8%和70.3%,对应的AUC分别为0.734、0.794、0.770。肿瘤实性成分占比值反映了肿瘤实性区域占整个肿瘤的比值,随着占比值的增加,STAS的发生率也逐渐增高;肿瘤无实性区域,在密度上表现为磨玻璃结节,STAS的发生率明显降低[13,21]。有学者研究显示,实性结节较部分实性结节、部分实性结节较磨玻璃结节,STAS 阳性的风险均升高17.544倍[23]。De Margerie等[14]研究显示更多实性成分肺腺癌患者中STAS阳性率则更高;Kameda等[25]建立的单因素预测模型中,证实肿瘤内实性成分直径与肿瘤最大径的比值(C/T)是重要变量,并且在多因素分析中C/T比值也是STAS发生的独立危险因素。本研究中从磨玻璃结节、部分实性结节到实性结节,STAS发生率由低到高,与以上学者的结论吻合。
本研究将有统计学意义的单因素CT征象纳入多因素分析显示,实性成分占比值、空气支气管征、分叶征、瘤-肺界面等CT征象是预测浸润性肺腺癌STAS阳性的独立危险因素。与同类研究相比本研究样本量较大,剔除了IV期及远处转移患者多因素影响,说服力更强。希望在以后研究设计中开展前瞻性研究以验证诸多征象在STAS预测方面的效能。
气腔播散(STAS)是浸润性肺腺癌(IAC)转移的重要途径之一,通过患者临床资料、特征性CT表现等综合分析可以一定程度上预测浸润性肺腺癌STAS的发生,从而为临床选择个性化、精准治疗方案提供依据和保障,临床应用前景看好。
| [1] |
郑荣寿, 陈茹, 韩冰峰, 等. 2022年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2024, 46(3): 221-231. Zheng RS, Chen R, Han BF, et al. Cancer incidence and mortality in China, 2022[J]. Chin J Oncol, 2024, 46(3): 221-231. DOI:10.3760/cma.j.cn112152-20240119-00035 |
| [2] |
Shiono S, Yanagawa N. Spread through air spaces is a predictive factor of recurrence and a prognostic factor in stage I lung adenocarcinoma[J]. Interact Cardiovasc Thorac Surg, 2016, 23(4): 567-572. DOI:10.1093/icvts/ivw211 |
| [3] |
Morimoto J, Nakajima T, Suzuki H, et al. Impact of free tumor clusters on prognosis after resection of pulmonary adenocarcinoma[J]. J Thorac Cardiovasc Surg, 2016, 152(1): 64-72. e1. DOI: 10.1016/j.jtcvs.2016.03.088.
|
| [4] |
Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization classification of lung tumors: Impact of genetic, clinical and radiologic advances since the 2004 classification[J]. J Thorac Oncol, 2015, 10(9): 1243-1260. DOI:10.1097/JTO.0000000000000630 |
| [5] |
Kadota K, Nitadori JI, Sima CS, et al. Tumor spread through air spaces is an important pattern of invasion and impacts the frequency and location of recurrences after limited resection for small stage I lung adenocarcinomas[J]. J Thorac Oncol, 2015, 10(5): 806-814. DOI:10.1097/JTO.0000000000000486 |
| [6] |
Mao LT, Chen H, Liang MZ, et al. Quantitative radiomic model for predicting malignancy of small solid pulmonary nodules detected by low-dose CT screening[J]. Quant Imaging Med Surg, 2019, 9(2): 263-272. DOI:10.21037/qims.2019.02.02 |
| [7] |
Kadota K, Kushida Y, Kagawa S, et al. Limited resection is associated with a higher risk of locoregional recurrence than lobectomy in stage I lung adenocarcinoma with tumor spread through air spaces[J]. Am J Surg Pathol, 2019, 43(8): 1033-1041. DOI:10.1097/PAS.0000000000001285 |
| [8] |
Dai CY, Xie HK, Su H, et al. Tumor spread through air spaces (STAS): a call for more evidence[J]. J Thorac Dis, 2017, 9(10): E951-E953. DOI:10.21037/jtd.2017.09.08 |
| [9] |
Shih AR, Mino-Kenudson M. Updates on spread through air spaces (STAS) in lung cancer[J]. Histopathology, 2020, 77(2): 173-180. DOI:10.1111/his.14062 |
| [10] |
Jiang CS, Luo Y, Yuan JL, et al. CT-based radiomics and machine learning to predict spread through air space in lung adenocarcinoma[J]. Eur Radiol, 2020, 30(7): 4050-4057. DOI:10.1007/s00330-020-06694-z |
| [11] |
孙婷婷. 周围型肺腺癌气腔播散阳性与阴性患者CT征象及病理学比较研究[D]. 大连: 大连医科大学, 2021. DOI: 10.26994/d.cnki.gdlyu.2021.000165. Sun TT. Comparative study on CT signs and pathology of positive and negative patients with spread through air space of peripheral lung adenocarcinoma[D]. Dalian: Dalian Medical University, 2021. DOI: 10.26994/d.cnki.gdlyu.2021.000165. (in Chinese) |
| [12] |
孙平丽, 刘京男, 曹岚清, 等. 气腔内播散与肺腺癌患者临床病理学特征及预后之间的相关性分析[J]. 中华病理学杂志, 2017, 46(5): 303-308. Sun PL, Liu JN, Cao LQ, et al. To evaluate the clinicopathologic characteristics and outcome of tumor cells spreading through air spaces in patients with adenocarcinoma of lung[J]. Chin J Pathol, 2017, 46(5): 303-308. DOI:10.3760/cma.j.issn.0529-5807.2017.05.004 |
| [13] |
Li CJ, Jiang CS, Gong JS, et al. A CT-based logistic regression model to predict spread through air space in lung adenocarcinoma[J]. Quant Imaging Med Surg, 2020, 10(10): 1984-1993. DOI:10.21037/qims-20-724 |
| [14] |
De Margerie-Mellon C, Onken A, Heidinger BH, et al. CT manifestations of tumor spread through airspaces in pulmonary adenocarcinomas presenting as subsolid nodules[J]. J Thorac Imaging, 2018, 33(6): 402-408. DOI:10.1097/RTI.0000000000000344 |
| [15] |
段晓蓓, 陈相猛, 黄斌豪, 等. 18F-FDG PET/CT在预测T1~2期肺腺癌气腔内播散中的临床应用[J]. 中华核医学与分子影像杂志, 2022, 42(5): 263-268. Duan XP, Chen XM, Huang BH, et al. Clinical application of 18F-FDG PET/CT parameters in predicting tumor spread through air spaces in patients with lung adenocarcinomas at T1-2 stage[J]. Chin J Nucl Med Mol Imaging, 2022, 42(5): 263-268. DOI:10.3760/cma.j.cn321828-20201025-00388 |
| [16] |
邱协. 肺癌肿瘤间质细胞和气腔扩散的关系研究[D]. 苏州: 苏州大学, 2018. Qiu X. Relationship between the stromal cells and tumor spread through air spaces in lung adenocarcinoma[D]. Suzhou: Soochow University, 2018. (in Chinese) |
| [17] |
Warth A, Muley T, Kossakowski CA, et al. Prognostic impact of intra-alveolar tumor spread in pulmonary adenocarcinoma[J]. Am J Surg Pathol, 2015, 39(6): 793-801. DOI:10.1097/PAS.0000000000000409 |
| [18] |
Zhang ZR, Liu Z, Feng HX, et al. Predictive value of radiological features on spread through air space in stage cIA lung adenocarcinoma[J]. J Thorac Dis, 2020, 12(11): 6494-6504. DOI:10.21037/jtd-20-1820 |
| [19] |
Cha MJ, Lee HY, Lee KS, et al. Micropapillary and solid subtypes of invasive lung adenocarcinoma: clinical predictors of histopathology and outcome[J]. J Thorac Cardiovasc Surg, 2014, 147(3): 921-928. e2. DOI: 10.1016/j.jtcvs.2013.09.045.
|
| [20] |
Kim SK, Kim TJ, Chung MJ, et al. Lung adenocarcinoma: CT features associated with spread through air spaces[J]. Radiology, 2018, 289(3): 831-840. DOI:10.1148/radiol.2018180431 |
| [21] |
Yin QF, Wang HE, Cui HS, et al. Meta-analysis of association between CT-based features and tumor spread through air spaces in lung adenocarcinoma[J]. J Cardiothorac Surg, 2020, 15(1): 243. DOI:10.1186/s13019-020-01287-9 |
| [22] |
Qi L, Xue K, Cai YJ, et al. Predictors of CT morphologic features to identify spread through air spaces preoperatively in small-sized lung adenocarcinoma[J]. Front Oncol, 2021, 10: 548430. DOI:10.3389/fonc.2020.548430 |
| [23] |
吴越, 范力文, 谭明瑜, 等. 老年肺腺癌患者肿瘤经气道播散的CT特征[J]. 中国老年学杂志, 2020, 40 (17): 3626-3629. DOI: 10.3969/j.issn.1005-9202.2020.17.014. Wu Y, Fan LW, Tan MY, et al. CT features of tumor dissemination through the airways in elderly patients with lung adenocarcinoma[J]. Chin J Gerontol, 2020, 40(17): 3626-3629. DOI: 10.3969/j.issn.1005-9202.2020.17.014. (in Chinese) |
| [24] |
Park CH, Kim TH, Lee S, et al. Correlation between maximal tumor diameter of fresh pathology specimens and computed tomography images in lung adenocarcinoma[J]. PLoS One, 2019, 14(1): e0211141. DOI:10.1371/journal.pone.0211141 |
| [25] |
Kameda K, Lu SH, Eguchi T, et al. Can tumor spread through air spaces (STAS) in lung adenocarcinomas be predicted pre- and intraoperatively[J]. J Thorac Oncol, 2017, 12(1S): S411-S412. DOI:10.1016/j.jtho.2016.11.473 |




