2. 北京深睿博联科技有限责任公司, 北京 100089
2. Beijing Deepwise & League of PhD Technology Co. Ltd, Beijing 100089 China
据GLOBOCAN 2020,肺癌是全球恶性肿瘤相关死亡的主要原因,占所有此类死亡的18.0%[1]。肺癌是中国恶性肿瘤发病和死亡的首位原因,2022年约有106.1万例肺癌新发病例和73.3万肺癌死亡病例,分别占恶性肿瘤新发病例的22.0%和死亡病例的28.5%[2]。根据第八版肺癌病理分期,IA1期肺癌的5年生存率为90%;然而,在IIIC阶段急剧下降至12%[3],提示肺癌的早期筛查和诊断对于改善肺癌患者预后、减轻肺癌疾病负担至关重要。
早期肺癌通常表现为肺结节,其中表现为实性结节的肺癌尤其值得关注。研究表明,相比表现为磨玻璃结节的肺癌,实性结节肺癌的恶性程度更高,生长更快,更早出现淋巴结转移,预后更差[4-7]。随着肺癌筛查的普遍开展和薄层CT的广泛应用,亚厘米( ≤ 10 mm)恶性肺结节的检出机会也逐渐增加[8]。亚厘米肺结节是T分期最小的结节,恶性亚厘米实性肺结节尽管体积很小,也可侵犯血管和胸膜,出现淋巴结转移和远处转移[7]。肺结节是否需要手术以及手术时机对患者的预后至关重要,这就需要放射科医师能及时并精准地将早期恶性结节识别出来。在临床工作中,亚厘米实性肺结节由于体积小,缺乏典型CT影像表现,良恶性鉴别非常困难,而PET-CT、CT功能成像、穿刺活检等方法大多对亚厘米实性肺结节无效[9]。对于无法判定良恶性的亚厘米肺实性结节目前主要依靠有规律地CT随诊,但与肺亚实性结节的惰性生物学行为不同,由随诊导致的实性结节肺癌延迟诊断是否会影响早期肺癌患者的预后尚不确定,对于良性结节误诊为恶性而手术切除或需要手术切除结节进一步诊断的患者,则会给患者带来不必要的创伤,可能会引发不必要的并发症[10]。因此,更安全且准确的诊断方法仍有待进一步探索。
影像组学可以高通量提取隐藏在图像中的高维度且有价值的医学图像信息,并对其进行更深层的挖掘和分析,协助医生进行疾病的诊断、预后评估和疗效反应预测等[11-13]。目前已有多项研究使用影像组学来判断肺结节的良恶性,并且取得了良好的效能[14-16],但鲜有研究探讨CT影像组学在鉴别亚厘米实性肺结节良恶性方面的价值。本研究旨在建立专用于亚厘米实性肺结节的影像组学模型,将组学模型与放射科医师诊断进行比较,评估影像组学对亚厘米实性肺结节良恶性的预测价值,为肺癌早期诊断提供有效的辅助方法。
1 资料与方法 1.1 研究对象回顾性分析我院2020年3月—2023年1月经薄层增强CT检出的亚厘米实性肺结节。纳入标准:(1)实性肺结节,平均径 ≤ 1 cm;(2)结节经手术病理证实良/恶性;(3)随诊( ≥ 2年)仍稳定或结节随诊不到2年,但随诊期间缩小或消失后临床确定为良性结节。排除标准:(1)经手术病理证实转移瘤;(2)层厚 > 1.25 mm的CT图像;(3)图像质量差或有明显伪影。最终,本研究共纳入296例患者(303例肺结节)。
1.2 图像采集受检者均采用64排螺旋CT扫描仪(LightSpeed VCT或Optima CT660)吸气末、单次屏气连续扫描,扫描范围自肺尖至肺底。管电压120 kVp,管电流自适应,图像常规层厚和层间隔均为5 mm;重建算法使用标准算法:1.25 mm或1 mm,重建间隔0.8 mm。图像资料传入图像存储与传输系统(picture archiving and communication systems,PACS)内存档。CT增强扫描时,静脉注射造影剂80~90 mL,速度2.5 mL/s,延迟35 s成像。
1.3 图像分割和特征提取将DICOM格式的CT肺窗图像从PACS导出后,导入至深睿医疗多模态科研平台(https://keyan.deepwise.com)进行图像标注、特征提取和降维、组学模型构建。由一名放射科医师沿病灶边缘手动逐层勾画感兴趣区(region of interest, ROI),同时避免包含相邻的血管、支气管和正常肺组织,对得到的三维感兴趣区进行量化分析。图像经归一化和重采样预处理后,自动提取组学特征,包括一阶特征、形状特征、灰度共生矩阵特征(gray level co-occurrence matrix,GLCM)、灰度区域矩阵特征(gray level size zone matrix,GLSZM)、灰度游程矩阵特征(gray level run length matrix,GLRLM)、灰度相依矩阵特征(gray level dependence matrix,GLDM)和邻域灰度差分矩阵特征(neighbouring gray tone difference matrix,NGTDM)。为了评估观察者内一致性,随机选择了30例患者的图像,并于2周后由相同的放射科医师按照上述方法再次进行分割,采用组内相关系数(intraclass correlation coefficient,ICC)评估观察者内一致性,筛选出一致性较好的非零组学特征(ICC > 0.75)纳入后续分析。
1.4 特征筛选和建模本研究采用五折交叉验证法对模型进行验证。为了缓解组学特征的冗余性,采用特征性相关分析(C=0.90)和最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)算法进行特征降维,并筛选出最优组学特征。分别采用5种分类器构建组学模型,包括逻辑回归(logistic regression,LR)、支持向量机(support vector machine,SVM)、随机森林(random forest,RF)、线性分类支持向量机(linear support vector classifier, Linear SVC)和梯度提升(gradient boosting),并利用全局超参搜索对超参进行优化。绘制受试者工作特征(receiver operating characteristic,ROC)曲线评价不同组学模型的对亚厘米实性肺结节良恶性的诊断效能。
1.5 医师评估回顾收集患者基本信息和诊断报告,每份报告均由2名放射科医师双签诊断,即一名初级放射科医师给出结果,另一名高年资放射科医师签署并确认。根据报告结果,将放射科医师的诊断分为3类:良性(报告诊断为良性或倾向良性);恶性(报告诊断为恶性、警惕或倾向恶性);待定(仅建议随访,未给出明确倾向;或列出几种良恶性可能待鉴别)。将医师的诊断结果与最优影像组学模型的结果进行对比,评估组学模型的诊断效能。
所有肺结节均在肺窗(窗宽1600 Hu,窗位−600 Hu)和纵隔窗(窗宽350 Hu,窗位40 Hu),于轴位、冠状和矢状位3个层面观察,计算层面内最大径及与其垂直的最大短径的平均值作为平均径。
1.6 统计学分析采用SPSS 25.0进行统计学分析。采用Kolmogorov-Smirnov正态性检验评价计量资料是否服从正态分布,符合正态分布的计量资料用均值 ± 标准差表示,不符合则采用中位数(上下四分位数)表示;计数资料采用数目(百分比)表示。为比较组间差异,定量变量采用Mann-Whitney U检验和独立样本t检验,分类变量采用Pearson卡方检验和McNemar检验。使用受试者工作特征曲线下面积(area under the curve,AUC)、准确性、灵敏度、特异性、阳性预测值和阴性预测值来评估模型的诊断性能;采用Delong检验比较不同模型的AUC。双侧检验,检验水准α=0.05。
2 结 果 2.1 一般资料本研究共纳入了296位患者,303例肺结节,其中良性167例,恶性136例。良性组和恶性组肺结节平均径的差异有统计学意义(P < 0.001),2组在年龄、性别、肺结节部位上差异无统计学意义(P > 0.05)(表1)。良性和恶性结节的手术病理和随诊结果总结在表2。
|
|
表 1 良性组与恶性组的基线特征 Table 1 Baseline characteristics of benign and malignant groups |
|
|
表 2 肺结节手术病理和随诊结果 Table 2 Surgical pathology and follow-up results of pulmonary nodules |
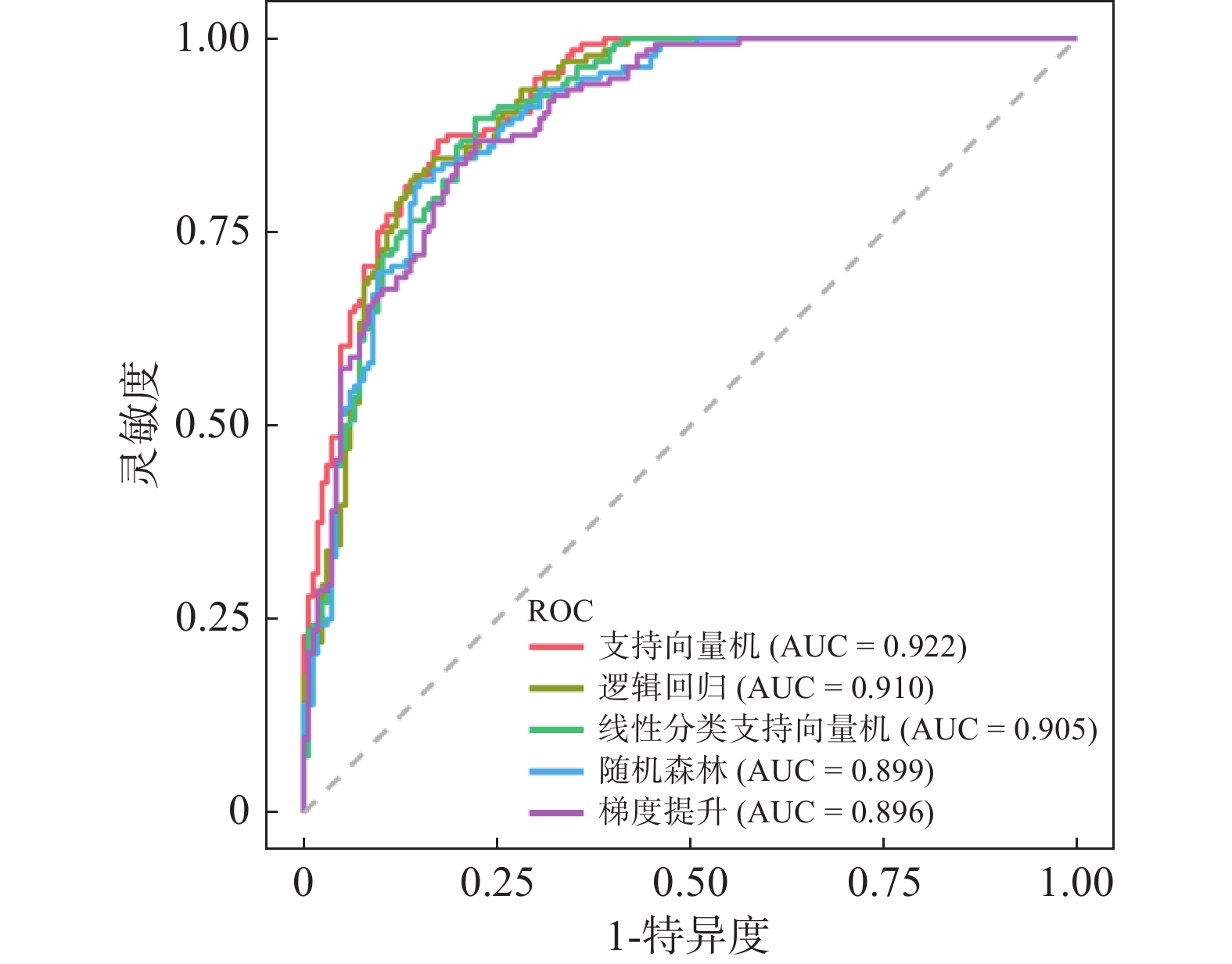
图像经均一化处理后自动提取了1781个特征,通过ICC筛选和特征性相关分析(C=0.90),移除1110个特征,共筛选出314个组学特征,在这些特征的基础上,采用超参搜索和LASSO降维,确定每个模型最终用于训练的特征。最终,SVM模型保留的特征参数为22个,LR模型、linear SVC模型、RF模型和GB降至17个。5种组学模型的诊断效能见表3,支持向量机、逻辑回归、线性分类支持向量机、随机森林和梯度提升的AUC分别为0.922、0.910、0.905、0.899和0.896,Delong检验结果提示5种模型的AUC差异无统计学意义。相比于其它分类器,支持向量机具有最高的准确率和F1分数。5种组学模型的ROC曲线分析见图1,支持向量机分类器的DCA曲线分析见图2。
|
|
表 3 5种组学模型在验证集的诊断效能 Table 3 Diagnostic performance of the five radiomics models on validation set |
|
图 1 5种组学模型的ROC曲线 Figure 1 The receiver operating characteristic curves of five radiomics models |
|
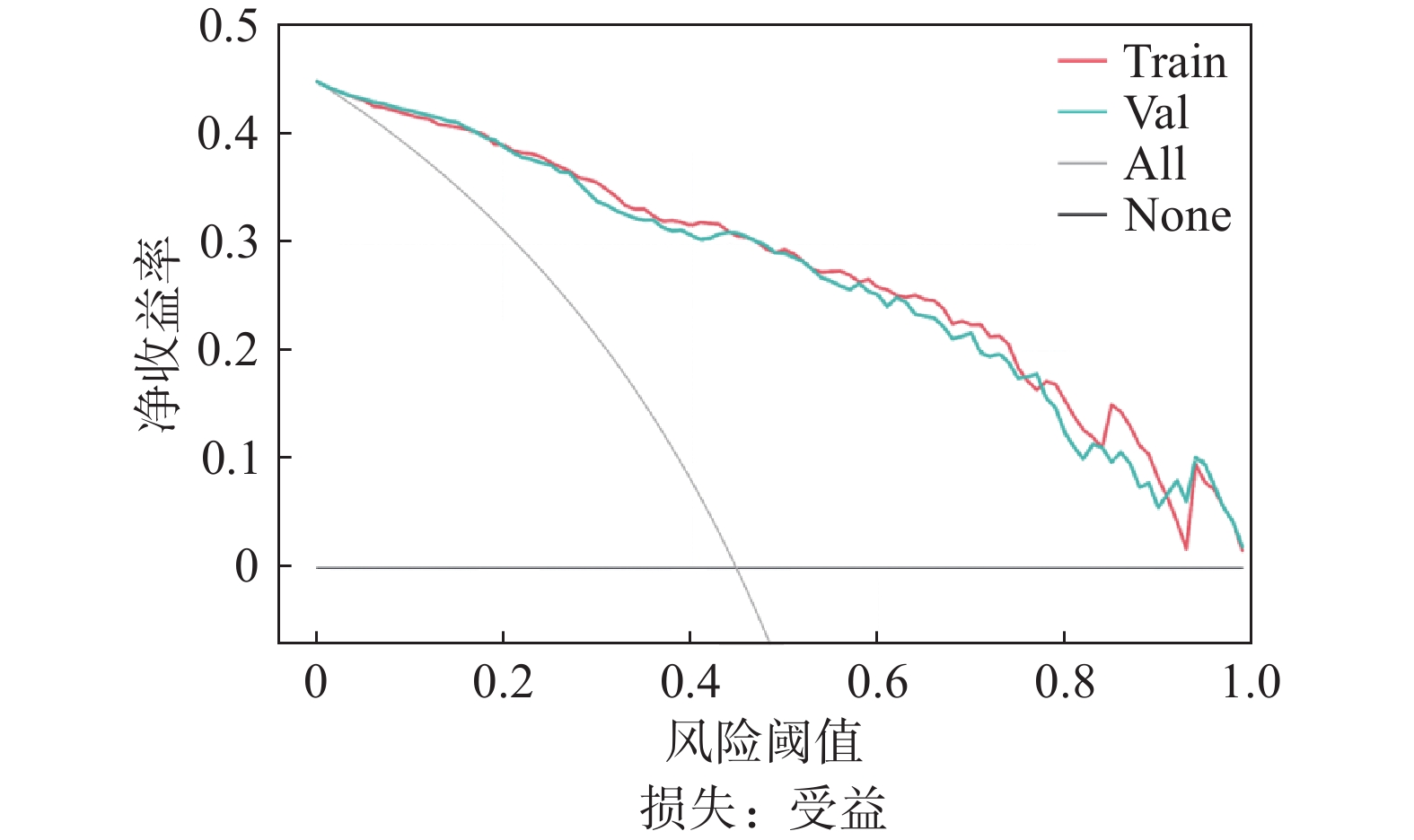
图 2 支持向量机模型的决策分析曲线 Figure 2 The decision analysis curve of support vector machine model 注:红线(Train)和绿线(Val)分别表示模型训练集和验证集分类结节的受益曲线,当阈概率为0.01~0.99时,使用该模型可为肺结节分类带来受益。All:假设都诊断为恶性结节;None:假设都诊断为良性结节。 |
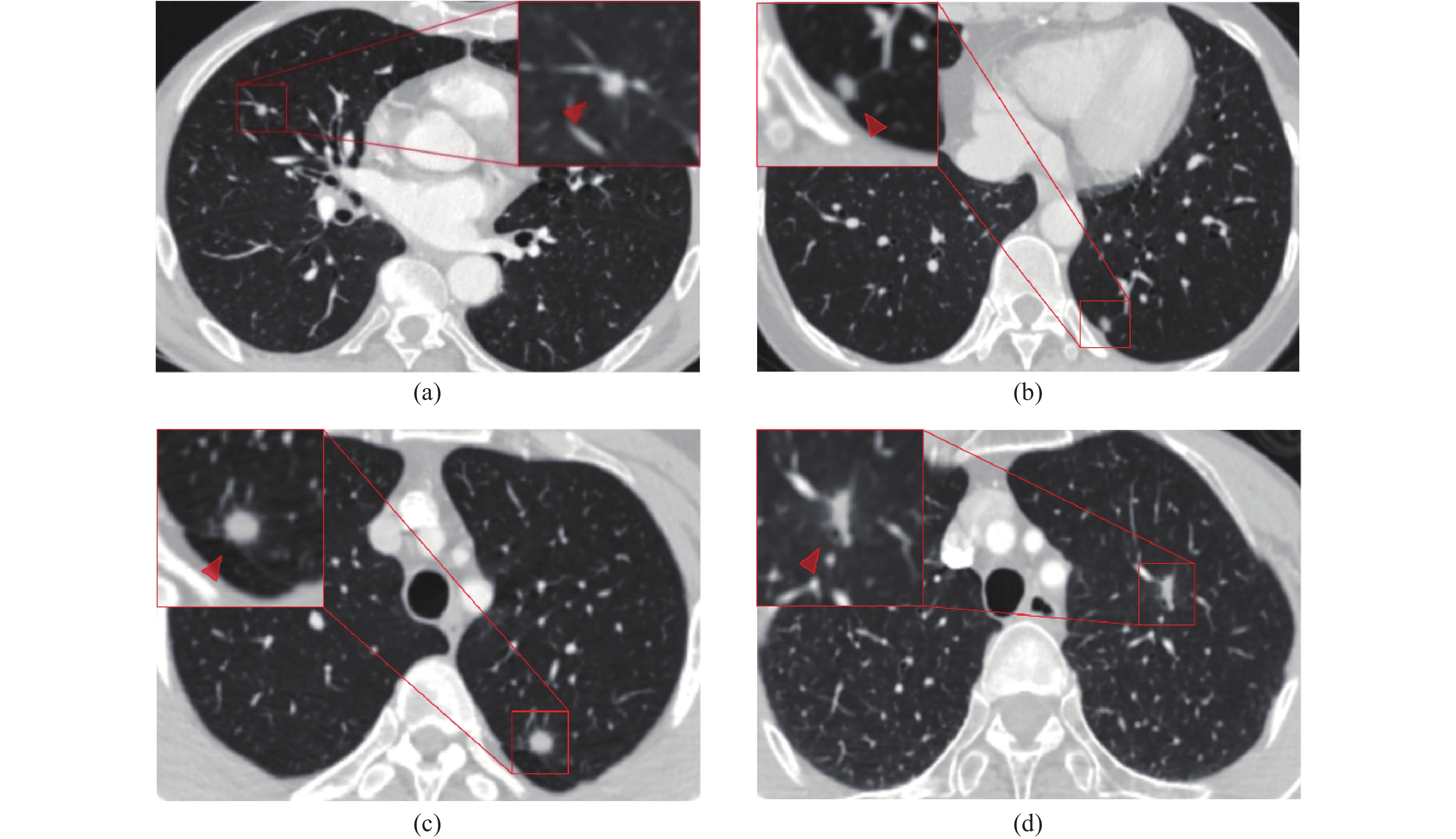
放射科医师诊断为良性结节85例(28.1%),恶性结节106例(35.0%),待定112例(37.0%),其中待定结果中有61例良性,51例恶性。将待定视为错误结果,得到放射科医师的诊断准确率为55.4%,与支持向量机分类器的准确率83.8%相比,差异具有统计学意义(χ2=64.88,P < 0.001)。在医师112例待定结果中,支持向量机分类器保持了80.4%(90/112)的准确率,正确预测了51例良性和39例恶性结节。将医师的待定和恶性结果归为一组,评估了放射科医师对良性结节(良性 vs. 恶性和待定)的诊断准确率为72.3%,与支持向量机的差异具有统计学意义(χ2=13.76,P=0.001)。图3为支持向量机模型和放射科医师对不同亚厘米实性肺结节的诊断示例。
|
图 3 支持向量机模型和放射科医师对肺结节的诊断示例 Figure 3 Examples of nodules diagnosed by support vector machine model and radiologists 注:(a)男性,58岁,结节位于右肺中叶,平均径6.5 mm,医师诊断为待定,模型诊断为恶性。术后病理结果为浸润性腺癌;(b)女性,49岁,结节位于左肺下叶,平均径5.5 mm,医师诊断为待定,模型诊断为恶性。术后病理结果为浸润性腺癌;(c)男性,37岁,结节位于左肺上叶,平均径8.0 mm,医师诊断为待定,模型诊断为良性。术后病理结果为肉芽肿性炎;(d)女性,63岁,结节位于左肺上叶,平均径8.0 mm,医师诊断为待定,模型诊断为恶性。术后病理结果为浸润性腺癌。 |
本研究旨在探讨基于CT的影像组学模型对亚厘米实性肺结节良恶性的诊断价值,通过建立多种常见的影像组学模型,并与临床工作中放射科医师的诊断报告进行对比,研究结果表明影像组学在基线判断亚厘米实性肺结节良恶性方面具有良好的效能,验证集的AUC为0.922(95%CI: 0.893, 0.950),对于诊断经验无法确定性质的肺结节,影像组学有助于减少其诊断的不确定性。
影像组学可以高通量地提取图像特征,对肿瘤异质性进行定量评估[17]。已有研究表明影像组学有助于肺结节的良恶性诊断,Zhang等[18]提出了一种结合CT征象和组学特征的诊断模型来预测5~20 mm实性肺结节的恶性风险,训练集和验证集的AUC分别0.92(95%CI: 0.89, 0.95)和0.85(95%CI: 0.78, 0.91),但该研究未对10 mm以下的小结节进行亚组分析。Chen等[11]纳入了198例亚厘米实性肺结节,将临床特征与影像组学相融合来预测肺结节的恶性风险,得到模型在验证集中的AUC为0.905(95%CI: 0.822, 0.988);Lin等[9]纳入了180例肺结节,建立了基于CT图像的组学模型对良恶性亚厘米实性肺结节进行分类,得到单纯组学模型的测试集AUC为0.877(95%CI: 0.817, 0.924),结合了临床和组学特征的联合模型AUC为0.903 (95%CI: 0.857, 0.944)。以上研究均基于非增强图像,且纳入结节数量较少,本研究的模型建立基于增强CT图像,可挖掘的图像信息更加丰富,同时将结节例数增加至303例,包含了更多病理类型,实现了优于上述研究的诊断准确性。
本研究严格按照临床场景,直接将临床工作中的放射科诊断报告作为放射科医师的诊断,而不是回顾诊断肺结节。因为回顾诊断可能会增加诊断的准确性,造成一定的偏倚。在临床工作中,工作时间较长、疲劳、经验不足等因素都会影响医师对肺结节的判断,所以诊断准确性可能会比仔细回顾病例时要低,也更接近实际情况。在以往的研究中,肺结节被简单地诊断为良性或恶性[17, 19],而在实际的临床实践中,可能存在各种难以确定为良性或恶性的结节。放射科医师有时只能给出相对保守的待定诊断,同时建议患者进行随访。由于结果的不确定性,一方面可能导致不必要的手术诊断,另一方面会造成患者焦虑和心理负担重而进行不必要的手术,因此待定的诊断不应直接排除或视为正确结果,故本研究将待定视为诊断错误是比较严格的。由于给出了待定结果,医师诊断准确率低于最优模型即支持向量机(55.5% vs. 83.8%, P < 0.001)。在所有待定结节中,组学模型实现了80.4%的诊断准确率,AUC为0.904(95%CI: 0.852, 0.956),预测效能依然保持稳定,表明组学模型有望减少医师诊断的不确定性。然而,组学模型仍有一定的误诊率,支持向量机将良性结节误诊为恶性的概率为15.6%,将恶性结节误诊为良性的概率为16.9%,因此组学模型诊断为良性的结节仍然需要后续的影像随诊观察。
本研究存在一定局限性:①本研究为单中心回顾性研究,数据库可能存在一定的偏倚,未来需更大规模、更大样本量的多中心研究来解决这一问题,减少偏倚;②所有结节的分割都是由医师手动勾画,耗时耗力,限制了大规模的应用,后期考虑引入更加智能的方法来勾画ROI;③虽然影像组学模型可以有助于减少待定结节的不确定性,但仍存在一定误诊率,需要进行前瞻性研究来观察模型在实际患者群体中的效果;④本研究仅建立了单纯影像组学模型,患者的临床资料和结节的CT特征对诊断非常具有价值,未来需要将这些信息融入到影像组学模型中,以期进一步提高模型的效能。
综上所述,影像组学模型对亚厘米实性肺结节良恶性诊断具有较高的准确性和应用价值,并在一定程度上帮助医师减少诊断的不确定性,可望为亚厘米实性结节的临床决策提供有效帮助。
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Han BF, Zheng RS, Zeng HM, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53. DOI:10.1016/j.jncc.2024.01.006 |
| [3] |
Goldstraw P, Chansky K, Crowley J, et al. The IASLC lung cancer staging project: Proposals for revision of the TNM stage groupings in the forthcoming (Eighth) edition of the TNM classification for lung cancer[J]. J Thorac Oncol, 2016, 11(1): 39-51. DOI:10.1016/j.jtho.2015.09.009 |
| [4] |
Mcwilliams A, Tammemagi MC, Mayo JR, et al. Probability of cancer in pulmonary nodules detected on first screening CT[J]. N Engl J Med, 2013, 369(10): 910-919. DOI:10.1056/NEJMoa1214726 |
| [5] |
Chu ZG, Zhang Y, Li WJ, et al. Primary solid lung cancerous nodules with different sizes: computed tomography features and their variations[J]. BMC Cancer, 2019, 19(1): 1060. DOI:10.1186/s12885-019-6274-0 |
| [6] |
Ye T, Deng L, Wang SP, et al. Lung adenocarcinomas manifesting as radiological part-solid nodules define a special clinical subtype[J]. J Thorac Oncol, 2019, 14(4): 617-627. DOI:10.1016/j.jtho.2018.12.030 |
| [7] |
Sun K, You AJ, Wang B, et al. Clinical T1aN0M0 lung cancer: differences in clinicopathological patterns and oncological outcomes based on the findings on high-resolution computed tomography[J]. Eur Radiol, 2021, 31(10): 7353-7362. DOI:10.1007/s00330-021-07865-2 |
| [8] |
Hattori A, Matsunaga T, Hayashi T, et al. Prognostic impact of the findings on thin-section computed tomography in patients with subcentimeter non–small cell lung cancer[J]. J Thorac Oncol, 2017, 12(6): 954-962. DOI:10.1016/j.jtho.2017.02.015 |
| [9] |
Lin RY, Zheng YN, Lv FJ, et al. A combined non-enhanced CT radiomics and clinical variable machine learning model for differentiating benign and malignant sub-centimeter pulmonary solid nodules[J]. Med Phys, 2023, 50(5): 2835-2843. DOI:10.1002/mp.16316 |
| [10] |
Liu JN, Qi LL, Wang YW, et al. Diagnostic performance of a deep learning-based method in differentiating malignant from benign subcentimeter ( ≤ 10 mm) solid pulmonary nodules[J]. J Thorac Dis, 2023, 15(10): 5475-5484. DOI:10.21037/jtd-23-985 |
| [11] |
Chen CY, Geng Q, Song GS, et al. A comprehensive nomogram combining CT-based radiomics with clinical features for differentiation of benign and malignant lung subcentimeter solid nodules[J]. Front Oncol, 2023, 13: 1066360. DOI:10.3389/fonc.2023.1066360 |
| [12] |
陈盈秀, 刘浅浅, 姬慧君, 等. MSCT增强扫描用于原发性实性小肠肿瘤诊断研究进展[J]. 中国辐射卫生, 2023, 32(1): 75-80. Chen YX, Liu QQ, Ji HJ, et al. Advances in the diagnosis of primary solid small bowel tumors by contrast-enhanced multislice spiral CT[J]. Chin J Radiol Health, 2023, 32(1): 75-80. DOI:10.13491/j.issn.1004-714X.2023.01.016 |
| [13] |
侯震, 李双双, 闫婧. 影像组学与深度学习在肿瘤放疗中的研究进展[J]. 国际放射医学核医学杂志, 2020, 44(12): 744-749. Hou Z, Li SS, Yan J. Research progress of radiomics and deep learning in tumor radiotherapy[J]. Int J Radiat Med Nucl Med, 2020, 44(12): 744-749. DOI:10.3760/cma.j.cn121381-202004004-00107 |
| [14] |
Zhang JJ, Hao LG, Qi MW, et al. Radiomics nomogram for preoperative differentiation of pulmonary mucinous adenocarcinoma from tuberculoma in solitary pulmonary solid nodules[J]. BMC Cancer, 2023, 23(1): 261. DOI:10.1186/s12885-023-10734-4 |
| [15] |
Zhao WJ, Xiong ZQ, Jiang YN, et al. Radiomics based on enhanced CT for differentiating between pulmonary tuberculosis and pulmonary adenocarcinoma presenting as solid nodules or masses[J]. J Cancer Res Clin Oncol, 2023, 149(7): 3395-3408. DOI:10.1007/s00432-022-04256-y |
| [16] |
Yi L, Peng ZW, Chen ZY, et al. Identification of pulmonary adenocarcinoma and benign lesions in isolated solid lung nodules based on a nomogram of intranodal and perinodal CT radiomic features[J]. Front Oncol, 2022, 12: 924055. DOI:10.3389/fonc.2022.924055 |
| [17] |
Xu QQ, Shan WL, Zhu Y, et al. Prediction efficacy of feature classification of solitary pulmonary nodules based on CT radiomics[J]. Eur J Radiol, 2021, 139: 109667. DOI:10.1016/j.ejrad.2021.109667 |
| [18] |
Zhang CR, Wang Q, Feng H, et al. Computed-tomography-based radiomic nomogram for predicting the risk of indeterminate small (5-20 mm) solid pulmonary nodules[J]. Diagn Interv Radiol, 2023, 29(2): 283-290. DOI:10.4274/dir.2022.22395 |
| [19] |
Huang H, Wu RY, Li Y, et al. Self-supervised transfer learning based on domain adaptation for benign-malignant lung nodule classification on thoracic CT[J]. IEEE J Biomed Health Inform, 2022, 26(8): 3860-3871. DOI:10.1109/JBHI.2022.3171851 |




