胰腺癌的发病率和死亡率在世界范围内仍呈上升趋势。据2022年中国恶性肿瘤发病率及死亡率统计数据显示,在我国胰腺癌发病率占10%,死亡率占8.8%[1],胰腺癌的常规放化疗难以达到满意的治疗效果,治疗形势严峻,急需寻找疗效好的治疗方法。
90Y核素为纯β辐射,最大能量可达2.28 MeV。在软组织中,释放的能量最大穿透距离为11 mm,半衰期短(64.1 h)可使肿瘤在短期内接受较大的剂量。应用最广泛的2款90Y微球产品是SIR-Spheres ®和 TheraSpheres®[2],分别采用树脂微球和玻璃微球负载90Y。90Y玻璃微球直径为20~30 μm,放射活性可达2500 Bq/微球。因玻璃主要成分(Y2O3)含有稳定的89Y,中子轰击后理化性能不变,故90Y玻璃微球具有性能稳定的优势[3]。国际上,基于90Y微球的介入治疗技术在恶性肝癌治疗发挥着重要作用[4-5],这为胰腺癌治疗提供了新的治疗思路。欧美澳等国家已将90Y应用在胰腺癌肝转移灶的治疗中[6],一些国家也正在利用90Y联合化疗药物进行多项胰腺癌治疗的临床研究。掌握90Y微球注入后肿瘤及正常组织内的剂量分布,是验证微球治疗胰腺癌可行性的重要手段。
本文结合患者真实CT图像建立个体体素模型,利用蒙特卡洛方法计算单位活度的90Y玻璃微球给药后在胰腺组织以及周围器官肝、肾脏、脾的吸收剂量,并分析肿瘤体积、给药方式与给药活度的关系,旨在为90Y玻璃微球应用于胰腺癌治疗的临床应用提供重要的参考数据。
1 材料与方法本方法包括3个步骤:首先基于患者真实CT建立体素模型;其次基于蒙特卡洛(MC)方法模拟计算比吸收分数,以ICRP第133号报告[7]发布的SAF数据验证个体体素模型MC计算的准确性;最后利用上述模型及方法计算玻璃微球中90Y在不同分布条件下对胰腺及周围敏感器官的吸收剂量。
1.1 个体化体素模型建立人体体素模型是辐射防护和放射治疗领域的重要工具[8],应用广泛的是ICRP 参考人体素模型[9]。但临床中患者器官质量、位置特征等均与参考人存在一定差异,这将影响剂量计算的准确性,因此针对特定患者需建立个体化模型。
本研究中个体化模型的建立以DICOM格式的腹部CT扫描图像作为输入文件,从CT图像上获取包含像素的图像信息以及将像素值转换为CT值的信息。CT值表征了CT 影像中每个像素对应的物质对X射线的线性平均衰减量。以水的衰减系数作为基准, CT值被定义为人体被测组织与水的线性衰减系数的相对差值,由式1)表示[10]:
| $ {\mathrm{CT}}=\frac{\overline{{\mu }_{x}}-\overline{{\mu }_{w}}}{\overline{{\mu }_{w}}}\times K $ | (1) |
式中,
采用比吸收分数对建立的体素模型MC计算方法进行验证。吸收分数(absorbed fraction,AF)与比吸收分数(specific absorbed fraction,SAF)是内照射剂量计算中的重要参数。AF定义为给定源区域发射的能量在靶区以及自身吸收的分数,表示为:
| $ \phi \left(t\leftarrow s\right)=\frac{{E}_{t}}{{E}_{0}} $ | (2) |
其中,
| $ \mathrm{\Phi }=\frac{\phi (t\leftarrow s)}{{m}_{t}} $ | (3) |
将2)、3)式结合,则有:
| $ \mathrm{\Phi }=\frac{{E}_{t}}{{E}_{0}{m}_{t}}=\frac{{D}_{t}}{{E}_{0}} $ | (4) |
其中,
S因子[
| $ {S}_{w}\left({r}_{T}\leftarrow {r}_{s}\right)={\sum }_{R}{w}_{R}{\sum }_{i}\left[{E}_{R,i}\cdot {Y}_{R,i}\cdot \mathrm{\Phi }\left({r}_{T}\leftarrow {r}_{s},{E}_{R,i}\right)\right] $ | (5) |
其中
| $ {D}_{T,R}=\tilde{A}\cdot {S}_{w}\left({r}_{T}\leftarrow {r}_{s}\right) $ | (6) |
式中,
| $\tilde{A}=\int_0^T A(0) \cdot \exp (-\lambda \cdot t) \mathrm{dt}$ | (7) |
其中,
| $ \tilde{A}=\frac{A\left(0\right)}{\lambda }=\frac{A\left(0\right)\cdot T}{\mathrm{l}\mathrm{n}\left(2\right)}=1.44\cdot T\cdot A\left(0\right) $ | (8) |
则靶区的剂量可以表示为:
| $ {{D}}_{{T},{R}}=1.44\cdot {T}\cdot {A}\left(0\right)\cdot {{S}}_{{w}}\left({{r}}_{{T}}\leftarrow {{r}}_{{s}}\right) $ | (9) |
SAF是计算S因子的关键参数,由计算参数验证后的个体化体素模型MC剂量计算方法,计算玻璃微球中主要核素90Y在胰腺不同分布情况下的体素S 因子,通过式9)得到对应器官的吸收剂量。
2 结 果 2.1 患者个体化体素模型选取中国成年女性患者CT图,数据大小为 512 × 512 × 376,层厚1.2 mm,空间分辨率0.805 mm × 0.805 mm × 1.2 mm。基于医学图像处理软件3D Slicer[11],勾画源靶器官。基于勾画后的CT图像,在 Geant4软件[12]建立单个器官体素模型以获取目标器官位置信息,基于原始图像建立体素模型计算剂量。图1为患者CT横断面勾画以及器官3D示意图。图2为胰腺、肝、肾脏、脾体素模型(用于位置确定)。为提高计算效率,在X和Y维度合并体素,合并后单个体素尺寸为1.6 mm×1.6 mm×1.2 mm。最终建立的体素模型中胰腺、肝、肾脏、脾脏包含体素个数为29716、540093、109549以及64079。
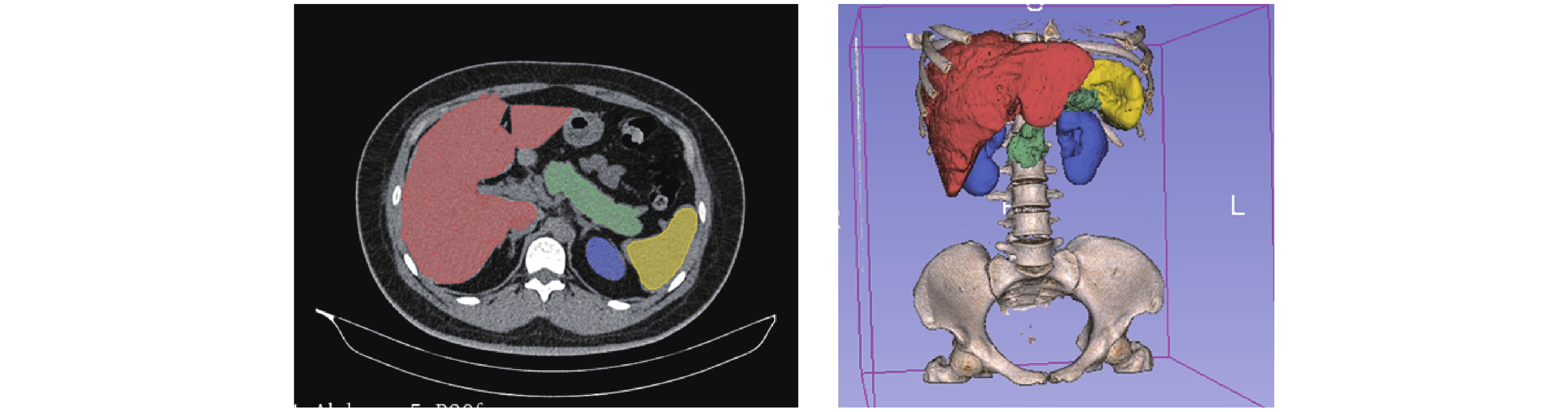
|
图 1 目标器官勾画以及3D示意图 Figure 1 Target organ delineation and 3D schematic diagram |

|
图 2 胰腺、肝、肾脏以及脾的体素模型 Figure 2 Voxel models of the pancreas, liver, kidneys, and spleen |
基于患者个体化体素模型,采用Geant4分别将病人的胰腺、肝、肾脏和脾作为源器官,计算自吸收情况即源器官与靶器官为同一器官时的单能电子的SAF值。电子能量范围为0.01~1 MeV,粒子数设置为2×107个。MC计算考虑器官组织的不均匀性,在计算器官SAF时,首先得到单个体素的SAF值,再通过质量加权得到整个器官的SAF,与ICRP133号报告中给出的参考数据进行对比,结果如图3。
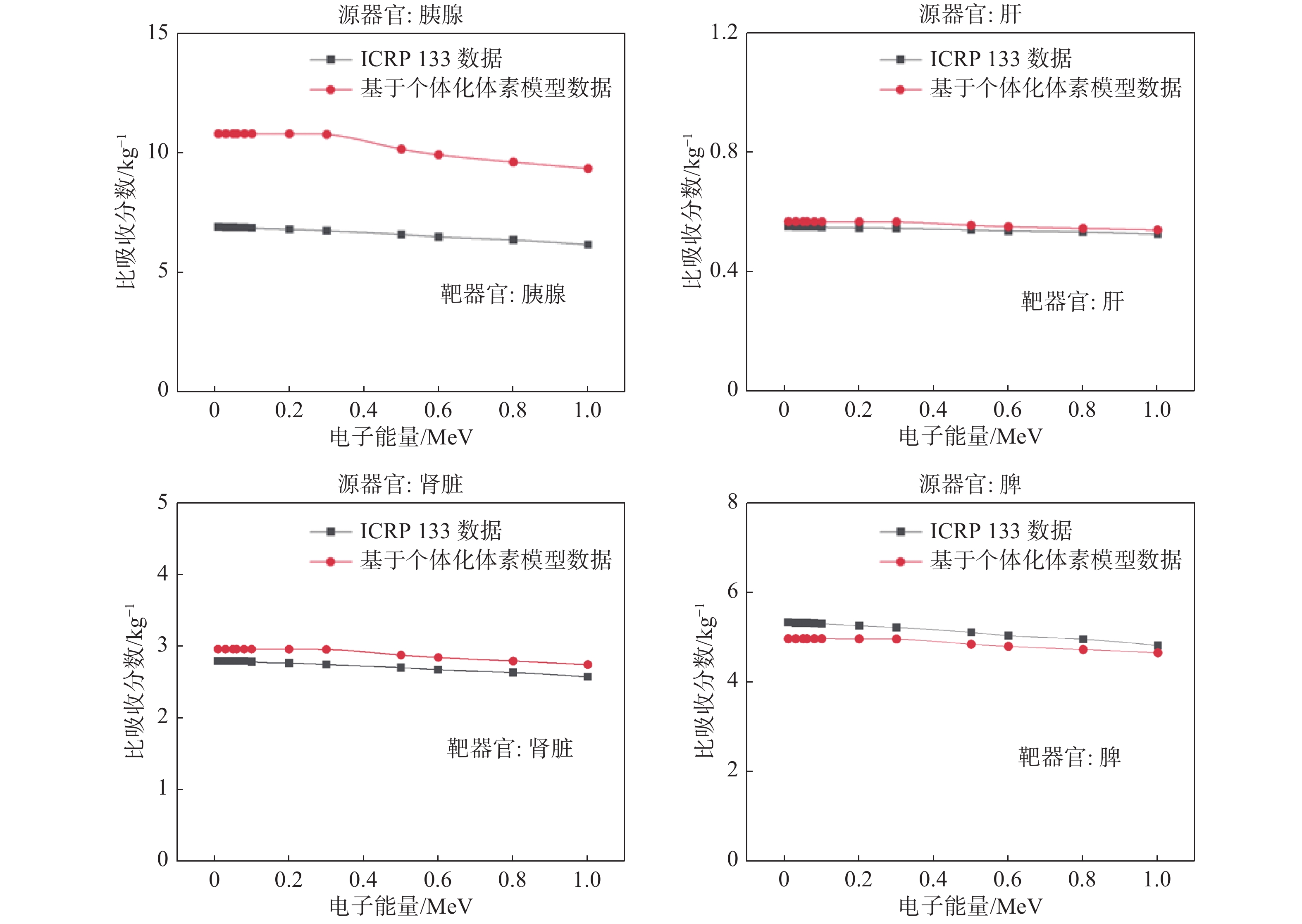
|
图 3 胰腺、肝、肾脏、脾的SAF计算结果比较 Figure 3 Comparison of specific absorbed fractions of the pancreas, liver, kidneys, and spleen |
基于不同人体模型计算电子SAF值时,器官质量是造成结果差异的主要因素 [13-14]。本文所采用的中国女性模型与ICRP133中所采用的参考成年女性模型的器官质量对比如表1,定义器官质量的相对比值R为:
|
|
表 1 2种计算模型的器官质量比较 Table 1 Comparison of organ mass between two calculation models |
| $ R=\frac{{M}_{Ref}}{M} $ | (10) |
|
|
表 2 基于2种计算模型胰腺自吸收情况下的SAFs对比 Table 2 Comparison of specific absorbed fractions under pancreatic self-absorption based on two calculation models |
| $ {\mathrm{\Phi }}_{T}={\mathrm{\Phi }}_{ref}\cdot R $ | (11) |
由此说明本文所建立的MC个体化剂量模拟计算方法的准确性,计算结果可信。
2.3 90Y玻璃微球对敏感器官的剂量估算结果 2.3.1 均匀情况剂量计算90Y微球在胰腺内分布,不区分肿瘤与正常胰腺。90Y能谱数据来自IAEA提供的Isotope Browser 软件,物理过程采用Geant4自带截面库数据,输出结果为单个体素对应吸收剂量,根据源靶器官的体素信息得到器官剂量分布,结果见表3。胰腺吸收剂量为
|
|
表 3 90Y在胰腺内均匀分布时S因子以及周围器官的吸收剂量 Table 3 S-factor and absorbed doses in surrounding organs with 90Y uniformly distributed in the pancreas |
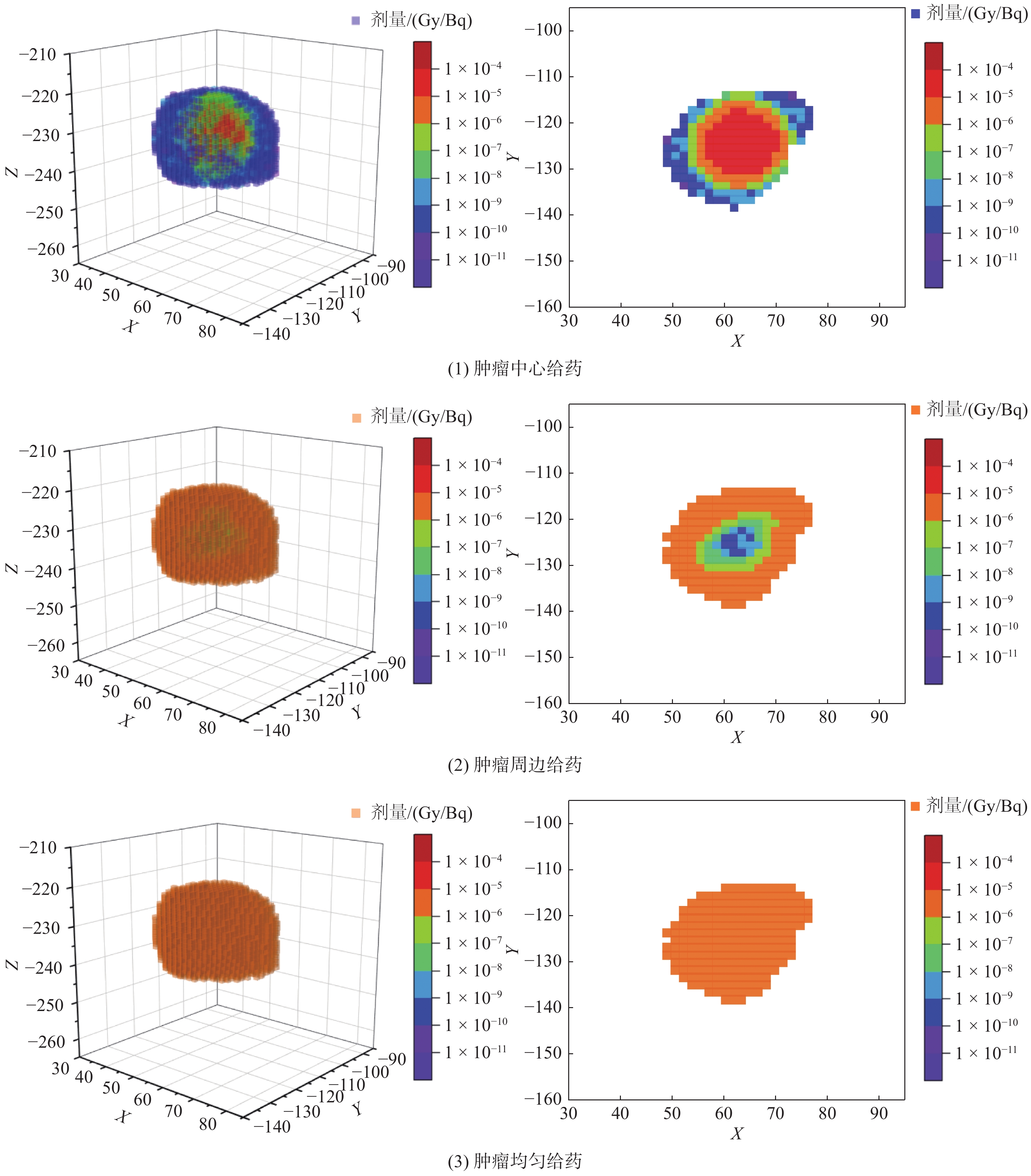
90Y微球在肿瘤内部均匀分布。假设体积为6.08 cm3的肿瘤T1、T2、T3分布在胰尾、胰体和胰头。90Y在3种肿瘤内分布时的器官剂量结果见表4,肿瘤及正常胰腺组织的吸收剂量分布见图4。
|
|
表 4 90Y在肿瘤内分布时器官吸收剂量(Gy/Bq) Table 4 Absorbed doses in organs with 90Y distributed in the tumor |

|
图 4 90Y在肿瘤内分布时胰腺组织内剂量分布情况 Figure 4 Distribution of dose in the pancreas with 90Y distributed in the tumor |
肿瘤内给药时,肿瘤剂量为
放射治疗中,肿瘤体积是影响给药量的一个关键因素。分析90Y微球治疗不同大小肿瘤时的剂量分布情况,探究肿瘤体积与给药活度的相关性。划分不同体积的肿瘤
|
|
表 5 不同体积肿瘤体内剂量分布结果(Gy/Bq) Table 5 Distribution of dose in tumors with different volumes |
核医学治疗中当肿瘤吸收剂量超过120 Gy时,可达到较好的治疗效果[16]。假设处方剂量为120 Gy,微球在肿瘤内部均匀给药时,达到处方剂量时肿瘤体积V与给药活度A的拟合关系见图5。由拟合关系初步推断肿瘤体积与给药活度成二次函数关系,公式如下,相关指数R2=0.9997,
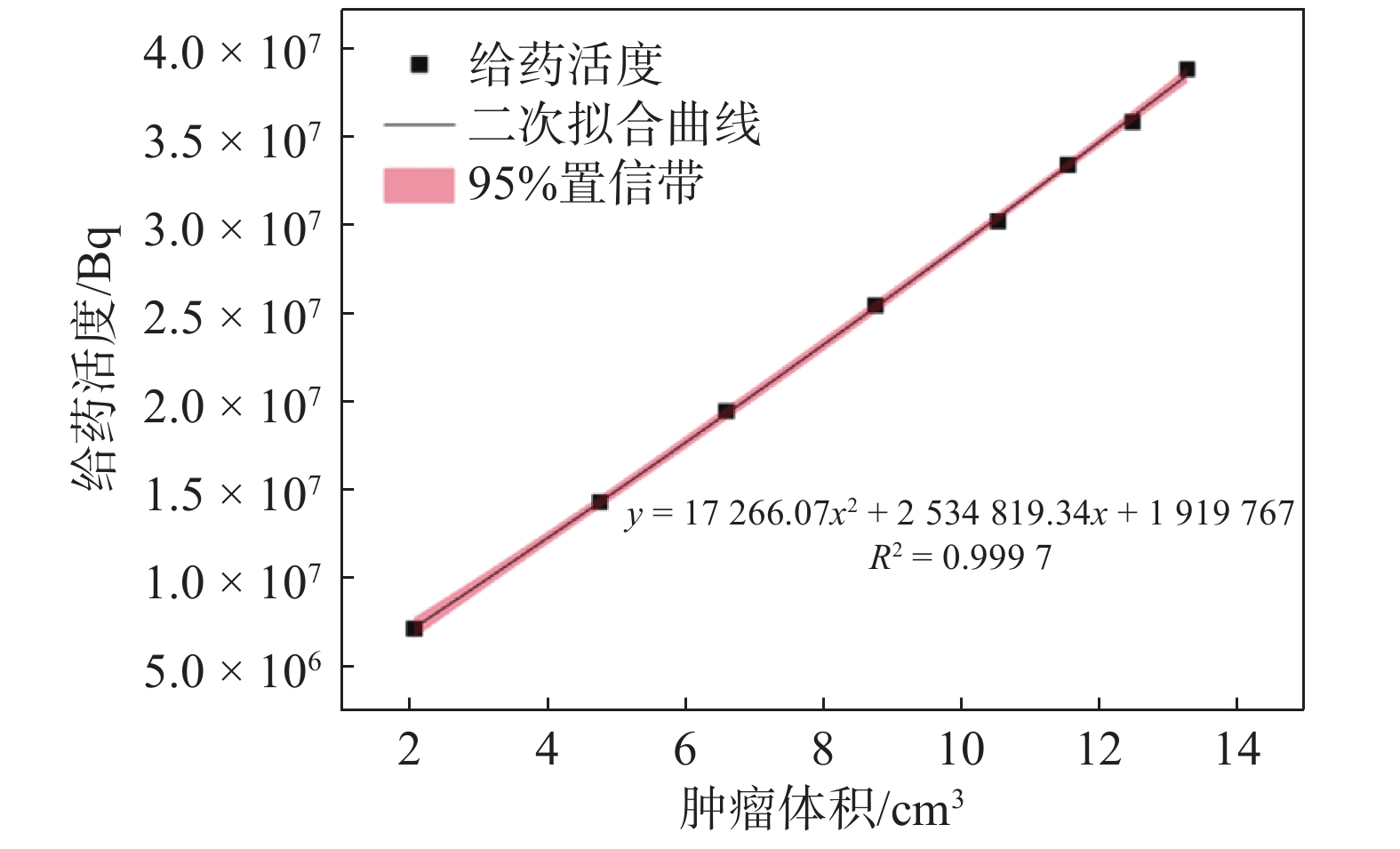
|
图 5 肿瘤体积V与给药活度A拟合曲线图 Figure 5 Fitting curve of tumor volume V and administered activity A |
| $ A=17\;266.07{V}^{2} + 2\;534\;819.34V + 1\;919\;767 $ | (12) |
肿瘤体积越大,肿瘤内平均剂量达到处方剂量所需微球活度越高,说明为有效治疗较大体积的肿瘤,可能需要更高活度的微球。需要注意的是,这只是一个初步的推断,具体关系可能还需要考虑其他因素对治疗效果的影响,如患者的生理状况、药物的代谢和排泄等。
2.4.2 微球给药方式与给药活度的关系90Y微球的分布影响肿瘤与周围器官的吸收剂量,针对不同大小肿瘤(
|
|
表 6 达到处方剂量120 Gy所需给药活度 Table 6 Administered activity required to reach the prescribed dose of 120 Gy |
|
图 6 |
电子SAF计算结果证明本文个体体素模型MC剂量计算的准确性。对90Y玻璃微球不同分布情况下周围敏感器官的吸收剂量进行了研究,结果显示90Y在胰腺均匀分布时,剂量主要贡献给了胰腺,周围器官的吸收剂量低4~5个量级,90Y玻璃微球有望成为胰腺癌治疗手段。当90Y在肿瘤内分布时,剂量主要贡献给了肿瘤,正常胰腺组织吸收剂量比均匀分布情况下减少87.79%,表明在90Y微球治疗中不能简单的假设微球在胰腺内均匀分布来计算给药活度,否则将使正常胰腺接受过高剂量。假设处方剂量120 Gy,通过对肿瘤体积、给药方式与给药活度关系的初步研究表明胰腺肿瘤体积V与给药活度A可拟合成二次函数关系,中心与周边所需给药活度相差20%。若以肿瘤平均剂量达到处方剂量为判定标准,建议考虑肿瘤内部集中给药,减少经济费用的同时降低周围器官的相对损伤。
本研究为90Y玻璃微球应用于胰腺癌介入治疗[17]的临床应用提供重要的参考数据,但存在一定的局限性,如考虑的胰腺肿瘤情况较单一,假设90Y微球在给药位置静置。未来将结合肿瘤实际情况以及临床实验,进一步探讨90Y玻璃微球实际分布情况下的器官剂量。
| [1] |
Zheng RS, Zhang SW, Zeng HM, et al. Cancer incidence and mortality in China, 2016[J]. J Natl Cancer Center, 2022, 2(1): 1-9. DOI:10.1016/j.jncc.2022.02.002 |
| [2] |
高洁, 刘晓明, 周文华, 等. 90Y微球的研发现状与应用研究[J]. 同位素, 2022, 35(3): 189-199. Gao J, Liu XM, Zhou WH, et al. Study on research and development status and application of 90Y microspheres[J]. J Isot, 2022, 35(3): 189-199. DOI:10.7538/tws.2022.35.03.0189 |
| [3] |
王斯妮, 贾中芝, 胡红杰, 等. 钇-90微球的特性、放射栓塞的操作技术及安全防护——钇-90微球放射栓塞系列回顾(一)[J]. 介入放射学杂志, 2017, 26(10): 952-958. Wang SN, Jia ZZ, Hu HJ, et al. Characteristics of yttrium-90 microsphere, techniques and radiation safety of radioembolization procedure. A series review of radioembolization with yttrium-90 microspheres (part I)[J]. J Intervent Radiol, 2017, 26(10): 952-958. DOI:10.3969/j.issn.1008-794X.2017.10.022 |
| [4] |
郑致远, 颜志平. 钇90放射性微球治疗肝脏恶性肿瘤的应用进展[J]. 复旦学报(医学版), 2020, 47(4): 622-627. Zheng ZY, Yan ZP. Application progress of yttrium-90 radiation microspheres in treatment of liver malignancies[J]. Fudan Univ J Med Sci, 2020, 47(4): 622-627. DOI:10.3969/j.issn.1672-8467.2020.04.025 |
| [5] |
赵开通, 白家瑞, 张国建. 90Y微球在肝细胞癌治疗中的临床应用价值及研究进展[J]. 国际放射医学核医学杂志, 2023, 47(7): 435-438. Zhao KT, Bai JR, Zhang GJ. Clinical application value and research progress of 90Y microspheres in the treatment of hepatocellular cancinoma[J]. Int J Radiat Med Nucl Med, 2023, 47(7): 435-438. DOI:10.3760/cma.j.cn121381-202209022-00321 |
| [6] |
Kayaleh R, Krzyston H, Rishi A, et al. Transarterial radioembolization treatment of pancreatic cancer patients with liver-dominant metastatic disease using yttrium-90 glass microspheres: a single-institution retrospective study[J]. J Vasc Interv Radiol, 2020, 31(7): 1060-1068. DOI:10.1016/j.jvir.2019.11.037 |
| [7] |
Bolch WE, Jokisch D, Zankl M, et al. The ICRP computational framework for internal dose assessment for reference adults: specific absorbed fractions[J]. Ann ICRP, 2016, 45(2): 5-73. DOI:10.1177/0146645316661077 |
| [8] |
张震, 武祯, 梁婧. 基于蒙特卡罗模拟的探伤误照器官剂量计算[J]. 中国辐射卫生, 2023, 32(4): 365-371,379. Zhang Z, Wu Z, Liang J. Monte Carlo simulation-based dose calculation for organs under accidental radiation exposure in flaw detection[J]. Chin J Radiol Health, 2023, 32(4): 365-371,379. DOI:10.13491/j.issn.1004-714X.2023.04.001 |
| [9] |
Menzel HG, Clement C, DeLuca P. ICRP Publication 110. Realistic reference phantoms: an ICRP/ICRU joint effort. A report of adult reference computational phantom[J]. Ann ICRP, 2009, 39(2): 1-164. DOI:10.1016/j.icrp.2009.09.001 |
| [10] |
汤晓斌, 陈达, 戴耀东, 等. 用CT值推导人体组织属性参数的方法及改进[J]. 南京航空航天大学学报, 2006, 38(3): 373-377. Tang XB, Chen D, Dai YD, et al. Method for converting CT numbers into mass density and elemental weights of tissue and its improvement[J]. J Nanjing Univ Aeronaut Astronaut, 2006, 38(3): 373-377. |
| [11] |
Fedorov A, Beichel R, Kalpathy-Cramer J, et al. 3D Slicer as an image computing platform for the Quantitative Imaging Network[J]. Magn Reson Imaging, 2012, 30(9): 1323-1341. DOI:10.1016/j.mri.2012.05.001 |
| [12] |
Allison J, Amako K, Apostolakis J, et al. Recent developments in GEANT4[J]. Nucl Instrum Methods Phys Res Sec A:Accel Spectrometers Detect Assoc Equip, 2016, 835: 186-225. DOI:10.1016/j.nima.2016.06.125 |
| [13] |
Zankl M, Schlattl H, Petoussi-Henss N, et al. Electron specific absorbed fractions for the adult male and female ICRP/ICRU reference computational phantoms[J]. Phys Med Biol, 2012, 57(14): 4501-4526. DOI:10.1088/0031-9155/57/14/4501 |
| [14] |
Bhar M, Kadri O, Manai K. Assessment of self- and cross-absorbed SAF values for HDRK-man using GEANT4 code: internal photon and electron emitters[J]. Nucl Sci Tech, 2019, 30(10): 149. DOI:10.1007/s41365-019-0675-2 |
| [15] |
Kesner AL, Carter LM, Ramos JCO, et al. MIRD pamphlet No. 28, Part 1: MIRDcalc—A software tool for medical internal radiation dosimetry[J]. J Nucl Med, 2023, 64(7): 1117-1124. DOI:10.2967/jnumed.122.264225 |
| [16] |
Sofocleous CT, Kamarinos NV. Tumor radiation-absorbed dose: the missing link in radioembolization[J]. Radiology, 2020, 296(3): 685-686. DOI:10.1148/radiol.2020202354 |
| [17] |
中国癌症研究基金会介入医学委员会, 国家放射与治疗临床医学研究中心, 国家介入医学创新联盟(筹). 晚期胰腺癌介入治疗临床操作指南(试行)(第六版)[J]. 临床肝胆病杂志, 2022, 38(6): 1242-1251. Committee of Interventional Medicine, Cancer Foundation of China, National Clinical Research Center for Radiology and Therapy, National Innovation Alliance of Interventional Medicine (Prepared). Clinical practice guidelines for the interventional treatment of advanced pancreatic carcinoma (on trial) (6th edition)[J]. J Clin Hepatol, 2022, 38(6): 1242-1251. DOI:10.3969/j.issn.1001-5256.2022.06.007 |




