近年来,全球男性生育力不断下降被认为是造成社会生育率下降的主要原因之一[1]。如今手机在我们生活中扮演着越来越重要的角色,手机使用过程中发出的射频辐射(radiofrequency radiation, RFR)可能造成多种疾病的发生,包括脑部疾病、癌症和男性生育力降低[2-4]。既往研究表明,手机RFR可导致男性睾丸结构破坏,还可对精子的数量、形态、活力以及与卵细胞的结合能力造成负面影响,从而影响生育力[5]。根据工信部发布信息,2023年我国5G手机用户的数量已达7.14亿,比上年同期增长45.1%,使得我们暴露于5G手机RFR的时间和强度均显著增加。目前关于手机RFR导致生殖损害的证据越来越多,但是多集中在2G~4G频段,且目前未见关于5G手机RFR对雄性生殖能力影响的报道。为了研究5G手机RFR对雄性小鼠生殖能力的影响,我们将小鼠暴露于我国5G通信常用的频段(3.5 GHz和4.9 GHz),观察精子质量、精子线粒体功能、睾丸形态结构和生育力等指标的变化,并通过睾丸基因的甲基化水平初步探讨其作用机制。
1 材料与方法 1.1 动物与分组7~8周龄健康雄性C57BL/6小鼠(购于空军军医大学实验动物中心),体重为(21.5 ± 2.2) g。小鼠饲养于IVC独立送风隔离笼具中,控制饲养环境温度和湿度保持适宜,小鼠可自由进食和饮水,同时饲养室保持各12 h的明暗循环。本研究中所有的动物实验均经空军军医大学(中国西安)动物福利委员会批准(批准号:IACUC—20220123)。经过7 d适应性喂养后,将小鼠随机分为Sham、3.5 GHz RFR组和4.9 GHz RFR组,每组16只,照射结束后,每组随机取6只立刻取材测量相关数据,剩余10只进行合笼实验。
1.2 辐射仪器与暴露参数本实验仪器包括3部分,包括美国是德科技的信号发生器、德国波恩的功放器和中国新佳滕的天线,天线对角长度D为280 mm。小鼠接受辐射暴露的位置距离天线70 cm,以确保小鼠位于辐射的远场区域。根据我国5G手机RFR频段划分,本实验选定3.5 GHz和4.9 GHz两个5G手机信号常用频段进行辐射暴露。小鼠暴露时间为连续暴露42 d,每天1 h,功率密度(power density, PD)为50 W/m2。
1.3 睾丸组织结构睾丸经Bouin’s液固定24 h后,切成两半后放入包埋盒,流水冲洗2 h,用全自动脱水机(LeicaTP1020,德国)脱水,进行石蜡包埋后用旋转切片机(LeicaRM2135,德国)切片,厚度为5 μm。60℃恒温箱内烤片2 h,经过脱蜡、复水后进行苏木精-伊红(hematoxylin-eosin,HE)染色。每个组随机挑选50个生精小管,用ImageJ软件测量其生精小管直径和生精上皮厚度,然后进行统计分析。
1.4 精子质量测定将每组6只小鼠麻醉后心脏取血,然后用生理盐水冲洗残血,取双侧附睾尾,用剪刀在附睾尾底部剪3下,放入提前加入1 mL精子培养液的12孔板中,37℃孵箱孵育30 min,精子充分游离到精子培养液中,然后用400目滤网过滤,得到精子悬液。取20 μL精子悬液加入380 μL精子培养液中(稀释20倍),混匀后移液枪吸取20 μL加入到细胞计数板中,光学显微镜下拍照,用ImageG软件进行精子计数。
取精子悬液20 μL进行涂片,干燥后用提前预冷的丙酮固定20 min,取出室温放置,干燥后伊红染液浸泡染色20 min,流水冲洗,干燥后显微镜下统计精子畸形率。
将过滤后的精子悬液吸取10 μL加入到精子检测板(赛司医疗,北京),使用SAS精子分析系统(赛司医疗,北京)进行精子活力检测。
1.5 线粒体功能测定取600 μL精子悬液进行离心,然后按照线粒体膜电位检测试剂盒(Elabscience,武汉)说明书处理精子样本,用流式细胞仪(贝克曼,美国)进行线粒体膜电位检测;按照三磷酸腺苷(adenosine triphosphate,ATP)含量化学发光法测试盒(Eliabscience,武汉)说明书将睾丸组织研磨,离心后取上清待测。取100 μL配好的工作液加入对应的96孔板板孔中,静置5 min,然后各孔加入100 μL标准品或样品,立刻在化学发光检测仪下读数,将数值带入公式计算ATP含量,并进行统计分析。
1.6 小鼠生育力的测定将手机RFR暴露后的雄鼠(每组10只)和未辐射暴露的雌鼠按照1∶2的比例进行合笼,合笼时间为7 d,每日早晚2次检查阴栓情况。合笼结束后将雌鼠单笼饲养,统计生育率、产仔数、仔鼠死亡率等数据,并进行统计分析。
1.7 睾丸LRGUK基因甲基化水平检测甲基化捕获测序(华美生物公司)原始数据以采用fastp和multiQC(版本:0.19.4)进行全方位质控,使用bismark(版本: v0.19.0)进行甲基化基因组比对,使用qualimap/bedtools/samtools等工具对bam文件进行质量评估,统计测序数据的比对情况和靶标区域的捕获效率,使用methylkit(版本:v1.6.1)工具可以直接读取的基因组水平甲基化扫描文件,然后进行差异分析。
1.8 实时荧光定量PCR和Western blot取睾丸组织约0.05 g,用M5 Universal RNA Mini Kit组织RNA快速提取试剂盒(聚合美,北京)提取睾丸组织RNA,然后用FastKing cDNA第一链合成试剂盒(TIANGEN,北京)逆转录为cDNA,在荧光实时定量PCR仪(Bioneer,韩国)采用RealUniversal 彩色荧光定量预混试剂(TIANGEN,北京)检测LRGUK基因的mRNA表达量(内参基因为GAPDH)。PCR引物列表如表1。
|
|
表 1 基因引物序列 Table 1 Primer sequences |
使用全蛋白提取试剂盒从睾丸组织提取蛋白质样品,用BCA法进行蛋白定量。使用10% SDS-PAGE凝胶将30 μg蛋白进行电泳分离,并湿转到0.45 μm的聚二氟乙烯(polyvinylidene difluoride,PVDF)膜上,室温下0.5%脱脂牛奶封闭2 h后,加入一抗(β-actin,1∶3000,Servicebio,GB15003;LRGUK-1,1∶1000,Affinity,DF16120)4℃摇床孵育过夜,然后二抗(兔抗,1∶5000,壮志,EK020)室温孵育2 h,滴加ECL超敏发光液后使用Universal Hood II电泳成像仪(Bio-Rad,意大利)进行曝光,并使用ImageJ软件进行灰度分析。
1.9 统计学分析数据以平均值 ± 标准差(Mean ± SD)表示,数据使用GraphPad Prism 8.2软件进行统计分析和作图。其中,生育率和仔鼠死亡率使用卡方检验,LRGUK基因mRNA及蛋白相对表达量进行两独立样本t检验;其余数据使用one-way ANOVA分析。P < 0.05认为差异有统计学意义。
2 结 果 2.1 5G手机RFR连续暴露42 d对小鼠睾丸组织结构的影响与Sham组相比,3.5 GHz RFR组和4.9 GHz RFR组小鼠睾丸内各级生精细胞形态结构无明显变化,生精小管直径和生精上皮厚度均无显著差异(P > 0.05,图1)。提示5G手机RFR连续暴露42 d对小鼠睾丸组织结构无明显影响。

|
图 1 5G手机RFR连续暴露 42 d 对小鼠睾丸形态结构的影响 Figure 1 Effects of continuous exposure to 5G mobile phone radiofrequency radiation for 42 days on the morphological structure of mouse testes 注:(A)睾丸组织HE染色;(B)生精小管直径;(C)生精上皮厚度。数据表示为Mean ± SD,n = 3 ,bar = 100 μm。 |
与Sham组相比,3.5 GHz RFR组和4.9 GHz RFR组小鼠的精子畸形率升高、活力降低,差异均有统计学意义(P < 0.05,图2B,图2C),但是精子数量无显著差异(P > 0.05,图2A)。提示5G手机RFR连续暴露42 d可造成鼠精子质量降低。

|
图 2 5G手机RFR连续暴露42 d对小鼠精子质量的影响 Figure 2 Effects of continuous exposure to 5G mobile phone radiofrequency radiation for 42 days on sperm quality in mice 注:(A)精子数量;(B)精子畸形率;(C)精子活力。数据表示为Mean ± SD,n = 5,6(*P < 0.05)。 |
与Sham组相比,3.5 GHz RFR组和4.9 GHz RFR组小鼠精子线粒体膜电位和睾丸ATP含量均无明显变化(P > 0.05,图3)。提示5G手机RFR连续暴露42 d对小鼠精子线粒体功能无明显影响。

|
图 3 5G手机RFR连续暴露42 d 对小鼠精子线粒体功能的影响 Figure 3 Effects of continuous exposure to 5G mobile phone radiofrequency radiation for 42 days on mitochondrial function of mouse sperm 注:(A)流式细胞技术测精子膜电位代表图片;(B)线粒体膜电位;(C)法学发光法检测睾丸组织ATP含量。数据表示为Mean ± SD,n = 6。 |
与Sham组相比,3.5 GHz RFR组和4.9 GHz RFR组小鼠生育率、产仔数和仔鼠死亡率均无显著差异(P > 0.05,图4)。提示5G手机RFR连续暴露42 d对生育力无明显影响。

|
图 4 5G手机RFR连续暴露42 d对小鼠生育力的影响 Figure 4 Effects of continuous exposure to 5G mobile phone radiofrequency radiation for 42 days on mouse fertility 注:(A)合笼雌鼠生育率;(B)产仔数;(C)仔鼠存活率;(D)仔鼠死亡及存活数量。n = 10。 |
与Sham组相比,4.9 GHz RFR组小鼠睾丸内LRGUK基因的甲基化水平显著升高(P < 0.05,图5A),mRNA水平和蛋白水平均显著降低(P < 0.05,图5B、C和D)。提示5G手机RFR连续暴露42 d可导致小鼠睾丸内LRGUK基因的甲基化水平升高,并且影响其转录和翻译水平。
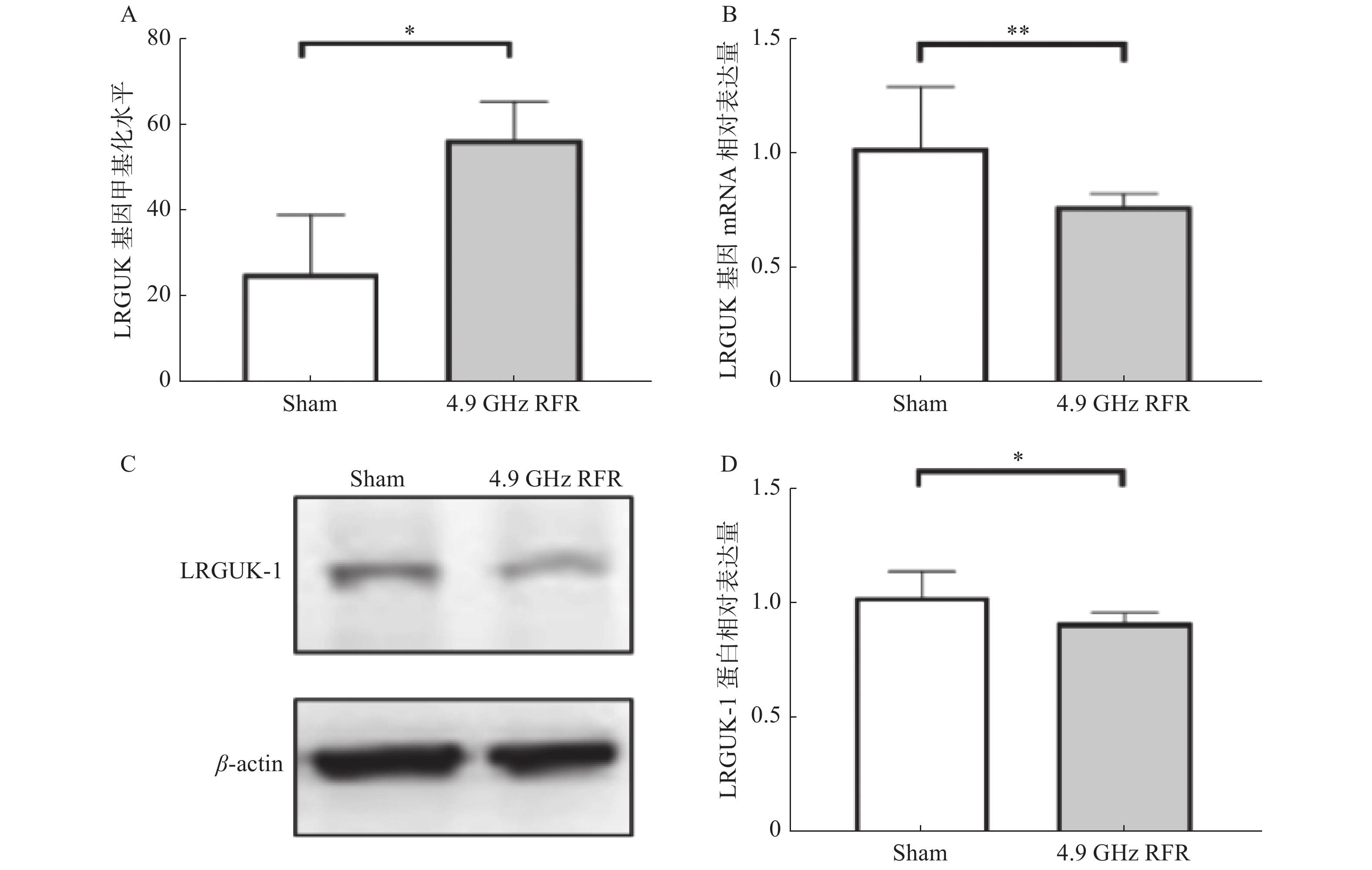
|
图 5 5G手机辐射连续暴露 42 d 对亲代睾丸LRGUK基因甲基化水平以及mRNA和蛋白相对表达量的影响 Figure 5 Effects of continuous exposure to 5G mobile phone radiofrequency radiation for 42 days on the methylation level of LRGUK gene and the relative expression of its mRNA and protein in parental testes 注:(A)LRGUK基因甲基化水平;(B)qRT-PCR半定量结果;(C~D) Western Blot代表条带及半定量结果。数据表示为Mean ± SD,n = 6(*P < 0.05,**P < 0.01)。 |
多种原因会导致男性不育的发病率增加,包括先天性的双侧输精管缺失等先天性因素和睾丸外伤、泌尿生殖系统感染等获得性因素,以及吸烟、喝酒和环境暴露等特发性危险因素[6]。既往研究表明,手机RFR可能通过影响精子数量、精子形态、精子活力和激素水平,从而影响雄性的生育力[1, 5]。目前5G手机应用越来越广泛,与2G~4G基站的扇区天线相比,5G基站的mMIMO天线可以产生高增益的窄波束,波束具有很强的指向性,使基站发射的射频功率在用户的方向上更加集中[7]。5G手机RFR具有更高的频率和更大的功率密度,这也引起了人们对于其安全性的担忧,因此本文主要关注5G手机RFR对雄性生殖能力的影响。
结构是功能的基础。有研究表明,手机RFR会导致睾丸形态结构发生变化[8],比如生精小管内生殖细胞显著丧失,生精上皮厚度降低[9-10]。本实验中,我们首先验证了5G手机RFR连续暴露42 d是否会造成小鼠睾丸的形态结构发生变化。通过小鼠睾丸组织HE染色,我们发现各组小鼠睾丸形态结构无明显变化。这与Oh等[11]的研究结果一致。手机RFR暴露对睾丸形态结构的影响目前仍存在不一致性,这可能与手机RFR的暴露时间与强度不同相关。
Levine等[12]研究发现,1973—2011年,男性精子质量下降了50%~60%,而精子质量降低与手机使用关系密切[13]。世卫组织建议将常规精液分析作为评估男性生育力的第一步[6]。因此我们通过精子数量、精子畸形率、精子活力等指标评估小鼠的精子质量。结果发现,2个辐射暴露组的精子数量无明显变化,但是精子畸形率均显著升高,精子活力均显著降低。这与Shokri等[14]的研究结果一致,他们将Wistar大鼠连续2个月暴露于2.45 GHz RFR(1 h/d),发现大鼠精子活力降低,精子浓度降低,精子畸形率升高。Shahin等[9]将瑞士白化雄性小鼠持续120 d暴露于1800 MHz手机RFR(3 h/d),发现小鼠精子数量减少,精子死亡率增加。越来越多的证据表明,手机RFR会导致精子质量下降。
精子运动所需能量主要来自线粒体通过氧化磷酸化产生ATP[15],所以粒体功能和线粒体膜电位正常与精子活力密切相关[16]。为了验证本实验中精子活力下降是否与精子线粒体功能相关,我们又做了精子的线粒体膜电位检测和睾丸组织的ATP含量检测。结果发现3组数据均无统计学差异,提示5G手机RFR连续暴露42 d对小鼠精子线粒体功能无明显影响。本实验中精子活力下降的机制是否与精子线粒体功能有关还需要进一步验证。有研究表明,精子畸形会导致精子运动功能障碍,从而降低精子活力[17]。本实验中,5G手机RFR暴露42 d可导致精子畸形率的升高,而这也可能是精子活力降低的原因之一。
精子质量降低可能会导致雄性生育力降低[18]。本研究中5G手机RFR暴露42 d造成精子质量降低,是否会影响小鼠的生育力呢?我们按照雌雄比2∶1进行了合笼实验,发现小鼠的生育力并未受到明显影响,这与Yan等[19-20]的研究结果一致。本研究中5G手机RFR暴露42 d导致小鼠精子质量降低,尚未引起生育力的改变,延长暴露时间或检测时间对生育力的影响有待进一步研究。
据报道,睾丸中异常的DNA甲基化状态已被证明会影响正常的男性生殖功能[21]。研究发现,LRGUK基因有3个转录子,分别是LRGUK-1、LRGUK-2和LRGUK-3,其中长度为93kDa的LRGUK-1在精子顶体附着、精子头部成形和精子尾部的轴丝生成等发育过程中有重要作用[22],因此LRGUK基因异常可引起精子畸形率的升高和精子活力的降低[17]。因此,我们推测5G手机RFR可能会引起睾丸内LRGUK基因甲基化水平的改变从而造成小鼠精子活力降低,畸形率升高。为了验证这个观点,我们做了睾丸基因甲基化水平的检测,发现LRGUK基因甲基化水平明显升高,并且其mRNA和蛋白水平显著降低,提示LRGUK基因甲基化水平的升高,影响了其转录和翻译功能,而这可能是5G手机RFR暴露导致小鼠精子活力下降,畸形率升高的原因。
综上,5G手机RFR(3.5 GHz和4.9 GHz)暴露42 d对小鼠生育力无明显影响,但可导致小鼠精子活力下降,畸形率升高。这可能与5G手机RFR影响睾丸内LRGUK基因的甲基化水平有关。
| [1] |
Leisegang K, Dutta S. Do lifestyle practices impede male fertility?[J]. Andrologia, 2021, 53(1): e13595. DOI:10.1111/and.13595 |
| [2] |
Negi P, Singh R. Association between reproductive health and nonionizing radiation exposure[J]. Electromagn Biol Med, 2021, 40(1): 92-102. DOI:10.1080/15368378.2021.1874973 |
| [3] |
杜丹, 尚梦娟, 林加金, 等. 微波辐射对学习记忆及海马内神经递质的影响[J]. 中国辐射卫生, 2023, 32(2): 209-215. Du D, Shang MJ, Lin JJ, et al. Effects of microwave radiation on learning and memory and neurotrans-mitters in the hippocampus[J]. Chin J Radiol Health, 2023, 32(2): 209-215. DOI:10.13491/j.issn.1004-714X.2023.02.023 |
| [4] |
Falcioni L, Bua L, Tibaldi E, et al. Report of final results regarding brain and heart tumors in Sprague-Dawley rats exposed from prenatal life until natural death to mobile phone radiofrequency field representative of a 1.8 GHz GSM base station environmental emission[J]. Environ Res, 2018, 165: 496-503. DOI:10.1016/j.envres.2018.01.037 |
| [5] |
张芸怡, 贾泽涵, 宇文斌, 等. 射频电磁辐射及其物理参数对雄性生殖系统影响的研究进展[J]. 环境与职业医学, 2023, 40(8): 972-980. Zhang YY, Jia ZH, Yu WB, et al. Research progress on effects of radio frequency radiation and its physical parameters on male reproductive system[J]. J Environ Occup Med, 2023, 40(8): 972-980. DOI:10.11836/JEOM23026 |
| [6] |
Agarwal A, Baskaran S, Parekh N, et al. Male infertility[J]. Lancet, 2021, 397(10271): 319-333. DOI:10.1016/S0140-6736(20)32667-2 |
| [7] |
罗森文, 鲁娜, 王华刚, 等. 5G(Sub 6G)移动通信基站电磁辐射初探[J]. 广东通信技术, 2021, 41(10): 60-63. Luo SW, Lu N, Wang HG, et al. Preliminary exploration of electromagnetic radiation from 5G (Sub 6G) mobile communication base stations[J]. Guangdong Commun Technol, 2021, 41(10): 60-63. DOI:10.3969/j.issn.1006-6403.2021.10.015 |
| [8] |
王篪, 何俊, 张丽. 长期微波暴露健康危害的研究进展[J]. 中国辐射卫生, 2022, 31(5): 639-644. Wang C, He J, Zhang L. Recent advances in health hazards of long-term exposure to microwave radiation[J]. Chin J Radiol Health, 2022, 31(5): 639-644. DOI:10.13491/j.issn.1004-714X.2022.05.023 |
| [9] |
Shahin S, Singh SP, Chaturvedi CM. 1800 MHz mobile phone irradiation induced oxidative and nitrosative stress leads to p53 dependent Bax mediated testicular apoptosis in mice, Mus musculus[J]. J Cell Physiol, 2018, 233(9): 7253-7267. DOI:10.1002/jcp.26558 |
| [10] |
Yu G, Tang ZP, Chen H, et al. Long-term exposure to 4G smartphone radiofrequency electromagnetic radiation diminished male reproductive potential by directly disrupting Spock3–MMP2-BTB axis in the testes of adult rats[J]. Sci Total Environ, 2020, 698: 133860. DOI:10.1016/j.scitotenv.2019.133860 |
| [11] |
Oh JJ, Byun SS, Lee SE, et al. Effect of Electromagnetic Waves from Mobile Phones on Spermatogenesis in the Era of 4G-LTE[J]. BioMed Res Int, 2018, 2018: 1801798. DOI:10.1155/2018/1801798 |
| [12] |
Levine H, Jørgensen N, Martino-Andrade A, et al. Temporal trends in sperm count: a systematic review and meta-regression analysis[J]. Hum Reprod Update, 2017, 23(6): 646-659. DOI:10.1093/humupd/dmx022 |
| [13] |
Kim S, Han D, Ryu J, et al. Effects of mobile phone usage on sperm quality-No time-dependent relationship on usage: A systematic review and updated meta-analysis[J]. Environ Res, 2021, 202: 111784. DOI:10.1016/j.envres.2021.111784 |
| [14] |
Shokri S, Soltani A, Kazemi M, et al. Effects of Wi-Fi (2.45 GHz) exposure on apoptosis, sperm parameters and testicular histomorphometry in rats: a time course study[J]. Cell J, 2015, 17(2): 322-331. DOI:10.22074/cellj.2016.3740 |
| [15] |
Park YJ, Pang MG. Mitochondrial functionality in male fertility: from spermatogenesis to fertilization[J]. Antioxidants (Basel), 2021, 10(1): 98. DOI:10.3390/antiox10010098 |
| [16] |
Durairajanayagam D, Singh D, Agarwal A, et al. Causes and consequences of sperm mitochondrial dysfunction[J]. Andrologia, 2021, 53(1): e13666. DOI:10.1111/and.13666 |
| [17] |
Liu Y, DeBoer K, de Kretser DM, et al. LRGUK-1 is required for basal body and manchette function during spermatogenesis and male fertility[J]. PLoS Genet, 2015, 11(3): e1005090. DOI:10.1371/journal.pgen.1005090 |
| [18] |
Li J, Nan BR, Xu ZH, et al. Arsenic exposure caused male infertility indicated by testis and sperm metabolic dysfunction in SD rats[J]. Sci Total Environ, 2023, 904: 166838. DOI:10.1016/j.scitotenv.2023.166838 |
| [19] |
Yan S, Ju Y, Dong J, et al. Paternal radiofrequency electromagnetic radiation exposure causes sex-specific differences in body weight trajectory and glucose metabolism in offspring mice[J]. Front Public Health, 2022, 10: 872198. DOI:10.3389/fpubh.2022.872198 |
| [20] |
Houston BJ, Nixon B, Mcewan KE, et al. Whole-body exposures to radiofrequency-electromagnetic energy can cause DNA damage in mouse spermatozoa via an oxidative mechanism[J]. Sci Rep, 2019, 9(1): 17478. DOI:10.1038/s41598-019-53983-9 |
| [21] |
Han XJP, Huang QY. Environmental pollutants exposure and male reproductive toxicity: The role of epigenetic modifications[J]. Toxicology, 2021, 456: 152780. DOI:10.1016/j.tox.2021.152780 |
| [22] |
Okuda H, Deboer K, O'Connor AE, et al. LRGUK1 is part of a multiprotein complex required for manchette function and male fertility[J]. FASEB J, 2017, 31(3): 1141-1152. DOI:10.1096/fj.201600909R |




