科技及医学的迅猛发展使得电离辐射的应用日益广泛。电离辐射通过能量沉积和细胞内水辐解后产生的大量活性氧自由基导致DNA损伤、遗传不稳定性和细胞死亡[1]。通常认为,电离辐射引起的细胞死亡方式主要为细胞凋亡(apoptosis)和坏死(necrosis)。随着研究的不断深入,研究者发现电离辐射不仅能诱导细胞衰老(cellular senescence)、有丝分裂灾难(mitotic catastrophe),也会使细胞发生焦亡(pyroptosis)、程序性坏死(necroptosis)、铁死亡(ferroptosis)、自噬性细胞死亡(autophagic cell death)和巨泡式细胞死亡(methuosis)等[2]。辐射诱导细胞死亡的特点如图1所示。低剂量辐射可诱导兴奋效应、适应性反应及超敏感性等对机体有益的效应[3]。但在临床上,肿瘤的放射治疗采用的都是高剂量电离辐射。癌细胞对放射线的抵抗,及高剂量电离辐射对正常细胞的辐射损伤是限制肿瘤放疗效果的两大障碍。因此,探索辐射诱发的细胞死亡方式和相关分子机制具有重要意义,新的细胞死亡方式的发现可以为肿瘤放疗增敏和辐射防护药物的开发提供新的靶点。本文就电离辐射诱导的细胞死亡方式及基于细胞死亡进行放疗增敏和辐射防护的研究进行了梳理和总结。

|
图 1 辐射诱导的不同细胞死亡方式比较示意图 Figure 1 Patterns of cell death induced by radiation |
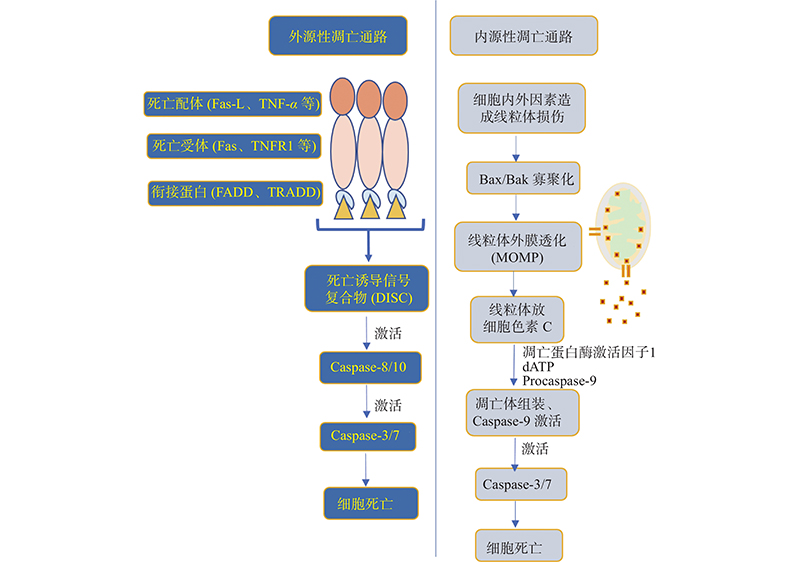
细胞凋亡被认为是辐射导致细胞死亡的主要方式。凋亡通过2种途径发生:Caspase-8和Caspase-10启动,细胞膜上死亡受体介导的“外源性途径”;以及Caspase-9启动,线粒体介导的“内源性途径”,如图2所示。这两种途径最终均引起Caspases激活并分解蛋白质和细胞骨架,导致细胞死亡。
|
图 2 细胞凋亡的2种途径 Figure 2 Two pathways of apoptosis 注:外源性凋亡通路:死亡配体和受体结合后,招募衔接蛋白和Procaspase-8/10组成DISC,DISC使Caspases-8/10激活,启动外源性凋亡。内源性凋亡通路:凋亡刺激因子引起线粒体外膜透化(MOMP)并释放细胞色素C,随后凋亡体组装,激活Caspase-9启动内源性凋亡。 |
作为一种贯穿性损伤因子,电离辐射可在无Fas-L等配体存在的状况下直接作用于细胞表面的死亡受体,从而激活外源性凋亡信号通路。另外,电离辐射诱导的DNA损伤会启动细胞的修复机制,损伤修复失败后,激活的p53诱导促凋亡因子Bax、Noxa、Puma的转录,使线粒体外膜透化,从而促进内源性凋亡。虽然电离辐射可诱导细胞发生内源性和外源性凋亡,但研究表明,哺乳动物以内源性途径为主[4],因此电离辐射诱导细胞凋亡的研究主要集中在内源性途径。内源性凋亡途径受Bcl-2蛋白家族中促凋亡(Bax、Bad、Bim等)和抗凋亡蛋白(Bcl-2、Bcl-xl)的共同调控。因此,以抗凋亡蛋白为靶点,开发调控内源性凋亡通路的小分子抑制剂,能够达到辐射防护的目的。例如,Marek等[5]筛选得到的化合物3e通过与Bcl-2蛋白发生相互作用,干扰内源性细胞凋亡通路,从而减少辐射造成的造血干细胞损伤。Bing等[6]发现酸性人参多糖可通过p53和Bcl-2家族成员调控的内源性途径抑制细胞凋亡,减轻小鼠小肠的辐射损伤,是一种潜在的防护药物。
在放疗增敏方面,研究发现沉默信息调节因子(Sirt3)对修复线粒体DNA损伤、保护线粒体完整性等方面具有重要作用。Cheng等[7]发现γ-射线照射人胶质母细胞瘤细胞LN229后,与正常表达Sirt3的细胞相比,Sirt3敲低/沉默的细胞表现出现更为严重的线粒体DNA氧化损伤和功能障碍,并增加了凋亡细胞的数量。同样,Cao等[8]发现Sirt3过表达的癌细胞表现出明显的辐射抗性,而Sirt3的缺乏促进了γ-射线诱导的A549细胞凋亡和G2/M期阻滞。因此,Sirt3是进行放射增敏调控的潜在靶点。
2 细胞焦亡细胞焦亡又称为快速裂解性死亡,是一种促炎形式的调节性细胞死亡方式,于1992年在病原体感染的髓系细胞中发现[9]。细胞焦亡通常与具有打孔效应的Gasdermins蛋白家族相关。迄今为止,共发现4条焦亡通路:依赖炎性小体的典型(主要由Caspase-1参与)和非典型途径[10],Caspase-3介导的非炎性小体依赖途径和颗粒酶蛋白酶介导途径[11- 12]。如图3所示,在典型焦亡通路中,多种病原或非病原刺激因子通过病原体相关分子模式(PAMPs)或损伤相关分子模式(DAMPs)激活炎性小体(如黑色素瘤2(AIM2)和核苷酸结合寡聚化结构域样受体(NLR)家族)后激活Caspase-1介导的焦亡。

|
图 3 细胞焦亡的4种途径 Figure 3 Four pathways of pyroptosis 注:典型通路:Caspase-1被炎症小体激活后剪切Gasdermin-D产生具有打孔活性的N-末端结构域,同时促进IL-1β,IL-18的成熟。非典型通路:Caspases-4/5/11被脂多糖(LPS)直接激活后剪切Gasdermin-D产生具有打孔活性的N-末端结构域。Caspase-3介导通路:Caspase-3通过剪切Gasdermin-E介导的焦亡。颗粒蛋白酶介导通路:颗粒酶A通过剪切Gasdermin-B介导焦亡。 |
细胞焦亡也是电离辐射诱导的一种重要的细胞死亡方式。由于造血干细胞、肠上皮细胞和血管内皮细胞更新速度快,复制率高,它们均具有较高的辐射敏感性。因此,电离辐射会对骨髓造血、胃肠道等多个系统造成损伤,损伤程度取决于辐照剂量和时间。越来越多证据表明,炎症小体在辐射诱导的细胞和组织损伤中至关重要。Hu等[13]研究发现,辐射诱导的严重DNA损伤(即DNA双链断裂)可以激活AIM2,导致骨髓细胞和肠上皮细胞发生Caspase-1介导的焦亡。Smith等[14]发现 ≥ 7.5 Gy剂量的γ-辐射会激活NLRP-1和NLRP-3炎症小体,进而诱导内皮细胞发生Caspase-1介导的细胞焦亡。Li等[15]探讨了对香豆酸对辐射所致肠道损伤的保护作用,发现对香豆酸抑制了Caspase-1、NLRP3和AIM2表达,通过阻断焦亡通路减轻了辐射对肠上皮细胞的损伤。因此,通过调控AIM2和NLRP3等炎性小体,抑制Caspase-1依赖的细胞焦亡或能预防/减轻电离辐射导致的器官损伤。
电离辐射以剂量和时间依赖性方式通过Caspase-3/Gasdermin-E或Caspase-1/Gasdermin-D通路介导肿瘤细胞焦亡,而焦亡过程可激活抗肿瘤免疫进一步杀伤癌细胞。例如,在高表达Gasdermin-E的肺癌、肝癌、乳腺癌和神经胶质瘤细胞中,辐射诱导其发生Caspase-3介导的焦亡通过增强树突状细胞的抗原呈递有效地促进CD8+T淋巴细胞的浸润,从而增强辐照后的肿瘤免疫治疗效果[16]。此外,辐射可增强Caspase-3的活性,通过Caspase-3/Gasdermin-E途径介导的焦亡过程激活NK细胞的抗肿瘤免疫作用,从而增强结直肠癌细胞的放射敏感性[17]。因此,若增加癌细胞中Gasdermin-E的表达,同时下调其在正常组织中的表达,可实现肿瘤辐射增敏并减轻正常组织的辐射损伤。以上研究表明,辐射敏感性和辐射造成的多器官损伤与细胞焦亡通路密切相关,因此调控炎性小体和细胞焦亡相关通路可作为减轻辐射损伤或增强肿瘤放疗增敏效果的有效策略。
3 程序性坏死坏死性凋亡,即程序性坏死,是依赖于受体相互作用蛋白激酶1(RIPK1)和受体相互作用蛋白激酶3(RIPK3),以及RIPK3底物混合谱系激酶结构域样蛋白(MLKL)磷酸化调控的一种细胞死亡方式[18]。正常情况下,肿瘤坏死因子-α通过激活Caspase-8信号转导通路诱导细胞凋亡,但Caspase活性受抑制时,由于部分上游分子重叠,肿瘤坏死因子-α转而激活程序性坏死通路,故Caspase-8是凋亡和程序性坏死的关键分子开关[19]。
电离辐射诱导的程序性坏死与癌细胞遗传背景和辐射剂量有关。Caspase-8可响应低剂量(12 Gy)辐射诱导细胞凋亡而抑制坏死。在高剂量(60 Gy)X-射线辐射且Caspase-8的活性降低时,会形成RIP1/RIP3坏死体复合物II,启动程序性坏死途径[20]。抑制细胞程序性坏死或敲除相关基因能预防/缓解辐射造成的损伤。Xu等[21]发现Nrf2通过抑制RIP1/RIP3/MLKL依赖的坏死性凋亡途径减轻辐射诱导的直肠损伤,表明Nrf2是防护辐射诱导的直肠损伤的潜在靶点。Ding等[22]研究发现藏红花素对辐射引起肺损伤具有防护作用,其原因是抑制了程序性坏死基因Tnfrsf10b的转录,该研究为预防放射性肺损伤提供了新的策略。
在放疗增敏方面,研究发现Caspase-8敲低后,靶向程序性坏死途径的模拟物可增强头颈部鳞状癌放疗敏感性[23]。Wang等[24]发现经10 Gy X-射线照射后,人结直肠癌细胞系(HT29和SW480)通过MLKL/JNK/IL-8通路发生了程序性坏死,因此,该通路可作为阻断肿瘤再增殖和提高放疗疗效的潜在靶点。
4 铁死亡2012年,Stockwell等人提出了一种新的细胞死亡方式--铁死亡。铁死亡是一种由脂质过氧化积累引起的铁依赖的细胞死亡方式[25]。铁死亡的细胞通常会出现坏死样形态学,超微结构水平表现为线粒体肿胀或皱缩变小、膜密度增高、线粒体嵴减少/消失和线粒体外膜破裂。
大量证据表明,电离辐射可诱导正常细胞和癌细胞发生铁死亡,其机理与水辐解引起的自由基增加和铁积累导致膜脂质过氧化相关[26]。由于人体内约70%的铁元素存在于血红蛋白的亚铁血红素中,辐射引起的出血会导致血细胞被巨噬细胞吞噬消化,使得血红素中铁释放、蓄积。铁积累会进一步导致出血器官中的细胞发生铁死亡[27]。研究表明,血红素具有增强肺癌细胞铁死亡和促进正常肺细胞存活的双重作用[28],但尚未对血红素联合电离辐射治疗癌症的效果和对肺组织的保护作用进行全面的体内研究。
在放疗增敏方面,铁死亡诱导剂可作为潜在的放疗增敏剂。Lei等[29]发现抑制SLC7A11(一种氨基酸转运蛋白)的铁死亡诱导剂对p53突变或缺失的肿瘤和患者来源的异种移植瘤具有显著的放射增敏作用,因此,他们建议放疗联合铁死亡诱导剂和来治疗p53突变的癌症。Feng等[30]发现Nrf2通过促进SLC7A11的过表达来抑制铁死亡,从而提高食管鳞状细胞癌辐射抗性。因此,阻断Nrf2/SLC7A11/铁死亡通路或能提高癌细胞放射敏感性。综上,辐射诱导的铁死亡为辐射损伤防护和癌症放疗增敏提供了新的靶点。
5 自噬性细胞死亡自噬性细胞死亡是由溶酶体所介导的Ⅱ型程序性细胞死亡方式。在自噬时,双膜小泡包裹细胞质形成自噬小体,与溶酶体融合后降解,以维持细胞分解代谢平衡和对应激、毒物和缺氧等刺激做出反应。
自噬机制可对放射线造成的DNA损伤进行修复,同时清理受损的线粒体和错误折叠的蛋白质,因此癌细胞自噬会降低放射治疗效果,但过度的自噬可引起自发性程序性死亡,即ACD。在肿瘤细胞中,与电离辐射相关自噬信号传导通路有磷脂酰肌醇-3-激酶-蛋白激酶B-mTOR信号通路(PI3K-Akt-mTOR)和丝裂原活化蛋白激酶(MAPK),MAPK包括c-Jun氨基末端激酶(JNK)和细胞外信号调节激酶(ERK)。许多研究试图通过自噬来改善肿瘤放疗的效果,目前可通过沉默自噬相关基因或使用药物干预自噬形成过程和自噬相关通路来促进/抑制自噬。抑制ACD可以增强癌细胞的放射敏感性。如,为研究血管内皮生长因子(VEGF)调节ACD和影响鼻咽癌的放射敏感性的机制,Chen等[31]发现VEGF基因敲除延缓了照射后鼻咽癌细胞(CNE-2R和5-8F)的DNA损伤修复,并通过激活mTOR通路降低鼻咽癌细胞的自噬水平,从而增加了鼻咽癌细胞的放射敏感性。Beclin-1是酵母自噬相关基因6(Atg6)的哺乳动物直系同源物,在诱导自噬中起核心作用。c-Jun是AP-1转录因子家族成员,其磷酸化可上调自噬相关蛋白Beclin-1的表达。研究人员发现敲低c-Jun后,通过激活PI3K/AKT/mTOR信号通路抑制自噬,可提高鼻咽癌细胞(CEN-2R)的辐射敏感性[32]。然而,有文献报道了与之相矛盾的实验结果,认为促进ACD可以增强肿瘤放射敏感性。Chen等发现提高Beclin-1磷酸化水平后,通过抑制mTOR通路促进ACD,增强了X-射线对前列腺癌细胞(DU-145和PC3)的杀伤作用[33]。雷帕霉素(mTOR抑制剂)通过诱导肺癌细胞(A549)自噬,增强了其辐射敏感性[34]。上述研究表明,ACD是提高某些肿瘤放疗敏感性的重要策略,但抑制或诱导ACD能够增强放疗敏感的研究均有报道,这可能与癌细胞系及基因谱不同有关。
6 巨泡式细胞死亡2008年,Overmeyer等[35]将胶质母细胞瘤中Ras过度活化诱导细胞质液泡积累导致的细胞死亡命名为巨泡式细胞死亡。细胞通过胞饮作用形成大量的液泡,最终胀裂而死亡[36]。
最近,Adjemian等[2]对X射线照射后的几种细胞系进行K-Ras测序,发现具有K-Ras突变的细胞系(CT26和MUCC),辐射后巨泡式细胞死亡显著增加;而没有K-Ras突变的细胞系(MCA205和71-7)辐射后只观察到少量空泡。因此,该细胞死亡主要与K-Ras突变有关。由于癌症中Ras的突变较为普遍,而目前有关电离辐射和肿瘤巨泡式细胞死亡关系的文献比较匮乏。因此,需要进一步探究巨泡式细胞死亡在肿瘤放射治疗中的具体机制和应用潜力。
7 展 望当下,超过50%的恶性肿瘤患者在治疗过程中会接受放射治疗。但电离辐射用于肿瘤放射治疗始终存在放疗抵抗和剂量限制两大问题。因此,研究人员一直致力于研发肿瘤放疗增敏剂和高效低毒的辐射防护药物。临床使用的小分子放疗增敏剂为甘氨双唑钠,主要用于头颈癌、食管癌和肺癌等实体肿瘤的放射增敏。辐射防护药物方面,目前只有氨磷汀应用于临床,作为放射治疗或化疗的辅助药物,降低治疗对正常细胞的毒性。但甘氨双唑钠和氨磷汀均具有小分子药物代谢快、无靶向的缺点。现有的药物远远未能满足临床需求,亟须研发更多安全有效的放疗增敏剂和辐射防护药物。为了克服小分子药物的缺陷,研究者们将目光投向了纳米材料领域。值得期待的是,已有2种纳米放疗增敏剂(NBTXR3和AGuIX)获批进入临床试验(NCT04862455,NCT03818386),有望成为上市药物辅助肿瘤放疗。
成功研制临床可使用的放疗增敏或辐射防护药物虽然任重道远,但辐射诱导的细胞死亡途径的发现将有助于相关药物的研发。首先,细胞死亡的诱导剂/抑制剂本身具有成为肿瘤放疗增敏剂或辐射防护剂的潜力。其次,细胞死亡信号通路上的关键蛋白可作为药物的作用靶点,不同细胞死亡通路为药物的研发提供了更多的靶点,增加了药物发现机率。2022年3月,Tsvetkov等[37]报道了一种新的细胞死亡方式---铜死亡,该细胞死亡方式是否与辐射相关,还需进一步研究。本文综述了辐射诱发的6种细胞死亡方式及其相关分子机制,梳理了与辐射防护药物和肿瘤放疗增敏剂的研发相关的通路和靶点,以期为该领域研究者提供新的思路。
志谢 感谢中国医学科学院医学与健康科技创新工程(2021-I2M-1-042)对本研究的资助
| [1] |
Averbeck D, Rodriguez-Lafrasse C. Role of mitochondria in radiation responses: epigenetic, metabolic, and signaling impacts[J]. Int J Mol Sci, 2021, 22(20): 11047. DOI:10.3390/ijms222011047 |
| [2] |
Adjemian S, Oltean T, Martens S, et al. Ionizing radiation results in a mixture of cellular outcomes including mitotic catastrophe, senescence, methuosis, and iron-dependent cell death[J]. Cell Death Dis, 2020, 11(11): 1003. DOI:10.1038/s41419-020-03209-y |
| [3] |
魏新锋, 王蕊, 衣峻萱, 等. 低剂量辐射生物效应的研究进展[J]. 中国辐射卫生, 2022, 31(1): 113-118,128. Wei XF, Wang R, Yi JX, et al. Research progress in biological effects of low-dose radiation[J]. Chin J Radiol Health, 2022, 31(1): 113-118,128. DOI:10.13491/j.issn.1004-714X.2022.01.020 |
| [4] |
Cao XB, Wen PB, Fu YF, et al. Radiation induces apoptosis primarily through the intrinsic pathway in mammalian cells[J]. Cell Signal, 2019, 62: 109337. DOI:10.1016/j.cellsig.2019.06.002 |
| [5] |
Marek J, Tichy A, Havelek R, et al. A novel class of small molecule inhibitors with radioprotective properties[J]. Eur J Med Chem, 2020, 187: 111606. DOI:10.1016/j.ejmech.2019.111606 |
| [6] |
Bing SJ, Kim MJ, Ahn G, et al. Acidic polysaccharide of Panax ginseng regulates the mitochondria/caspase-dependent apoptotic pathway in radiation-induced damage to the jejunum in mice
[J]. Acta Histochem, 2014, 116(3): 514-521. DOI:10.1016/j.acthis.2013.11.012 |
| [7] |
Cheng Y, Ren X, Gowda ASP, et al. Interaction of Sirt3 with OGG1 contributes to repair of mitochondrial DNA and protects from apoptotic cell death under oxidative stress[J]. Cell Death Dis, 2013, 4(7): e731. DOI:10.1038/cddis.2013.254 |
| [8] |
Cao K, Chen YY, Zhao SY, et al. Sirt3 promoted DNA damage repair and radioresistance through ATM-Chk2 in non-small cell lung cancer cells[J]. J Cancer, 2021, 12(18): 5464-5472. DOI:10.7150/jca.53173 |
| [9] |
Zychlinsky A, Prevost MC, Sansonetti PJ. Shigella flexneri induces apoptosis in infected macrophages
[J]. Nature, 1992, 358(6382): 167-169. DOI:10.1038/358167a0 |
| [10] |
Xiang HL, Zhu F, Xu ZF, et al. Role of inflammasomes in kidney diseases via both canonical and non-canonical pathways[J]. Front Cell Dev Biol, 2020, 8: 106. DOI:10.3389/fcell.2020.00106 |
| [11] |
Zhou ZW, He HB, Wang K, et al. Granzyme A from cytotoxic lymphocytes cleaves GSDMB to trigger pyroptosis in target cells[J]. Science, 2020, 368(6494): eaaz7548. DOI:10.1126/science.aaz7548 |
| [12] |
Wang YP, Gao WQ, Shi XY, et al. Chemotherapy drugs induce pyroptosis through caspase-3 cleavage of a gasdermin[J]. Nature, 2017, 547(7661): 99-103. DOI:10.1038/nature22393 |
| [13] |
Hu B, Jin CC, Li HB, et al. The DNA-sensing AIM2 inflammasome controls radiation-induced cell death and tissue injury[J]. Science, 2016, 354(6313): 765-768. DOI:10.1126/science.aaf7532 |
| [14] |
Smith AO, Ju W, Adzraku SY, et al. Gamma radiation induce inflammasome signaling and pyroptosis in microvascular endothelial cells[J]. J Inflamm Res, 2021, 14: 3277-3288. DOI:10.2147/JIR.S318812 |
| [15] |
Li YH, He Q, Chen YZ, et al. p-Coumaric acid ameliorates ionizing radiation-induced intestinal injury through modulation of oxidative stress and pyroptosis
[J]. Life Sci, 2021, 278: 119546. DOI:10.1016/j.lfs.2021.119546 |
| [16] |
Cao W, Chen GD, Wu LJ, et al. Ionizing radiation triggers the antitumor immunity by inducing gasdermin E-mediated pyroptosis in tumor cells[J]. Int J Radiat Oncol Biol Phys, 2023, 115(2): 440-452. DOI:10.1016/j.ijrobp.2022.07.1841 |
| [17] |
Tan G, Lin CJ, Huang CY, et al. Radiosensitivity of colorectal cancer and radiation-induced gut damages are regulated by gasdermin E[J]. Cancer Lett, 2022, 529: 1-10. DOI:10.1016/j.canlet.2021.12.034 |
| [18] |
Murphy JM, Czabotar PE, Hildebrand JM, et al. The pseudokinase MLKL mediates necroptosis via a molecular switch mechanism[J]. Immunity, 2013, 39(3): 443-453. DOI:10.1016/j.immuni.2013.06.018 |
| [19] |
Fritsch M, Günther SD, Schwarzer R, et al. Caspase-8 is the molecular switch for apoptosis, necroptosis and pyroptosis[J]. Nature, 2019, 575(7784): 683-687. DOI:10.1038/s41586-019-1770-6 |
| [20] |
Das A, McDonald DG, Dixon-Mah YN, et al. RIP1 and RIP3 complex regulates radiation-induced programmed necrosis in glioblastoma[J]. Tumor Biol, 2016, 37(6): 7525-7534. DOI:10.1007/s13277-015-4621-6 |
| [21] |
Xu YQ, Tu WZ, Sun D, et al. Nrf2 alleviates radiation-induced rectal injury by inhibiting of necroptosis[J]. Biochem Biophys Res Commun, 2021, 554: 49-55. DOI:10.1016/j.bbrc.2021.03.004 |
| [22] |
Ding Y, Ma L, He LM, et al. A strategy for attenuation of acute radiation-induced lung injury using crocetin from gardenia fruit[J]. Biomed Pharmacother, 2022, 149: 112899. DOI:10.1016/j.biopha.2022.112899 |
| [23] |
Uzunparmak B, Gao M, Lindemann A, et al. Caspase-8 loss radiosensitizes head and neck squamous cell carcinoma to SMAC mimetic-induced necroptosis[J]. JCI Insight, 2020, 5(23): e139837. DOI:10.1172/jci.insight.139837 |
| [24] |
Wang YW, Zhao MH, He SJ, et al. Necroptosis regulates tumor repopulation after radiotherapy via RIP1/RIP3/MLKL/JNK/IL8 pathway[J]. J Exp Clin Cancer Res, 2019, 38(1): 461. DOI:10.1186/s13046-019-1423-5 |
| [25] |
Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [26] |
Ye LF, Chaudhary KR, Zandkarimi F, et al. Radiation-induced lipid peroxidation triggers ferroptosis and synergizes with ferroptosis inducers[J]. ACS Chem Biol, 2020, 15(2): 469-484. DOI:10.1021/acschembio.9b00939 |
| [27] |
Zhang X, Liu H, Xing X, et al. Ionizing radiation induces ferroptosis in splenic lymphocytes of mice[J]. Int J Radiat Res, 2021, 19(1): 99-111. DOI:10.29252/ijrr.19.1.99 |
| [28] |
Almahi WA, Yu KN, Mohammed F, et al. Hemin enhances radiosensitivity of lung cancer cells through ferroptosis[J]. Exp Cell Res, 2022, 410(1): 112946. DOI:10.1016/j.yexcr.2021.112946 |
| [29] |
Lei G, Zhang YL, Hong T, et al. Ferroptosis as a mechanism to mediate p53 function in tumor radiosensitivity[J]. Oncogene, 2021, 40(20): 3533-3547. DOI:10.1038/s41388-021-01790-w |
| [30] |
Feng L, Zhao KK, Sun LC, et al. SLC7A11 regulated by NRF2 modulates esophageal squamous cell carcinoma radiosensitivity by inhibiting ferroptosis[J]. J Transl Med, 2021, 19(1): 367. DOI:10.1186/s12967-021-03042-7 |
| [31] |
Chen L, Lin GX, Chen KH, et al. VEGF knockdown enhances radiosensitivity of nasopharyngeal carcinoma by inhibiting autophagy through the activation of mTOR pathway[J]. Sci Rep, 2020, 10(1): 16328. DOI:10.1038/s41598-020-73310-x |
| [32] |
Sun YC, Chen KH, Lin GX, et al. Silencing c-Jun inhibits autophagy and abrogates radioresistance in nasopharyngeal carcinoma by activating the PI3K/AKT/mTOR pathway[J]. Ann Transl Med, 2021, 9(13): 1085. DOI:10.21037/atm-21-2563 |
| [33] |
Chen CX, Wang KZ, Wang Q, et al. LncRNA HULC mediates radioresistance via autophagy in prostate cancer cells[J]. Braz J Med Biol Res, 2018, 51(6): e7080. DOI:10.1590/1414-431x20187080 |
| [34] |
Li Y, Liu F, Wang Y, et al. Rapamycin-induced autophagy sensitizes A549 cells to radiation associated with DNA damage repair inhibition[J]. Thorac Cancer, 2016, 7(4): 379-386. DOI:10.1111/1759-7714.12332 |
| [35] |
Overmeyer JH, Kaul A, Johnson EE, et al. Active ras triggers death in glioblastoma cells through hyperstimulation of macropinocytosis[J]. Mol Cancer Res, 2008, 6(6): 965-977. DOI:10.1158/1541-7786.MCR-07-2036 |
| [36] |
Bhanot H, Young AM, Overmeyer JH, et al. Induction of nonapoptotic cell death by activated Ras requires inverse regulation of Rac1 and Arf6[J]. Mol Cancer Res, 2010, 8(10): 1358-1374. DOI:10.1158/1541-7786.MCR-10-0090 |
| [37] |
Tsvetkov P, Coy S, Petrova B, et al. Copper induces cell death by targeting lipoylated TCA cycle proteins[J]. Science, 2022, 375(6586): 1254-1261. DOI:10.1126/science.abf0529 |




