2015年,世界卫生组织癌症分类指南进行了更新,明确了肺肿瘤的新分类。根据新的分类标准,腺癌被分非粘液腺癌和腺癌变异型。同时,提出用“浸润性粘液腺癌(invasive mucinous lung adenocarcinoma, IMA)”一词来取代先前命名的粘液性细支气管肺泡腺癌[1]。根据该报告,IMA占所有原发性肺癌的0.2%,占所有肺腺癌的 < 2% ~ 10% [2],因此被认为是一种相对罕见的组织学亚型。由于发病率低,IMA的临床病理以及预后尚不清楚,且存在争议,部分研究认为其预后整体差于非粘液性肺腺癌[3-4],且早期即可发生气道播散[5-6],因此早期发现和诊断对实现局部控制尤为重要。笔者通过分析孤立结节型IMA患者的人口统计学特征和CT特征并建立预测模型,及早对孤立结节型IMA做出诊断或预测,以便有助于临床对其制定最佳的治疗策略。
1 资料与方法 1.1 一般资料收集我院2017年1月—2019年12月经临床手术病理证实为IA期IMA 53例患者共53个病灶,另外收集IA期孤立结节型NIMA 141例患者共141个病灶作为对照。
1.2 检查方法检查设备采用美国GE公司Discover 750HD能谱CT以及LightSpeed VCT。患者取仰卧位,扫描范围从胸廓入口至膈底,扫描层厚为0.625 mm × 64,图像重建:层间距为1.25 mm及5 mm,层厚为1.25 mm及5 mm,管电压 80~120 kV,管电流200~280 mA。90.72%(176/194)患者行CT增强扫描,经高压注射器快速静脉团注,延迟30 s左右开始扫描,剂量为1.5 ml/kg。
1.3 图像分析CT观察指标包括病灶的最长直径、病灶的形状(球形或类球形、明显不规则形)、瘤肺界面(清晰、模糊),毛刺,分叶,内部特征(支气管充气征或空泡征),血管异常改变(血管集束征、CT肿瘤微血管征)、胸膜牵拉。图像分析由2名具有10年以上胸部影像诊断经验的医师综合分析并得到一致意见。
1.4 统计学分析数据分析采用SPSS 26软件。采用 K-S检验评价连续变量是否服从正态分布。正态分布变量采用非配对 t 检验,非正态分布变量采用方差分析及Mann-Whitney U 检验。组间CT特征差异采用卡方或连续矫正卡方检验或 Fisher 确切概率法比较。单因素分析中差异显著的因素继续行多因素logistic 回归分析,得出主要影响因素及其回归系数,通过使用风险评分模型(risk score)计算各主要影响因素的风险总分,最后绘制受试者工作特征曲线 (ROC) 来评估预测效能,以P < 0.05为有统计学意义。
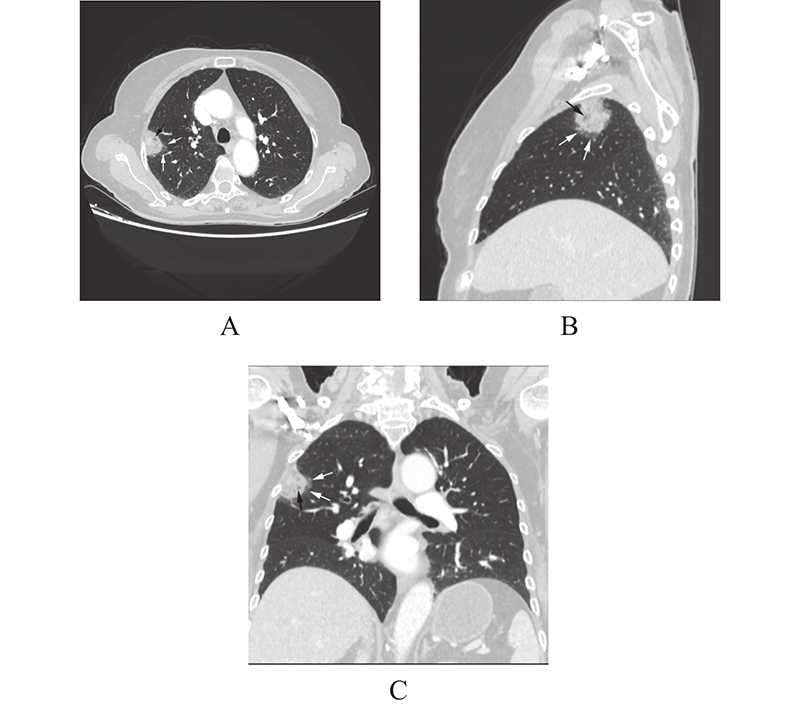
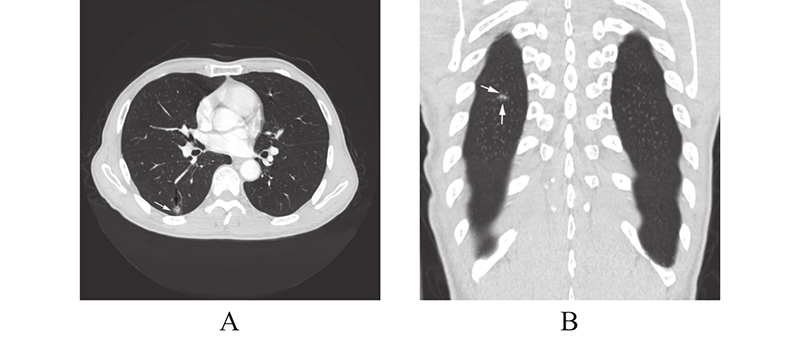
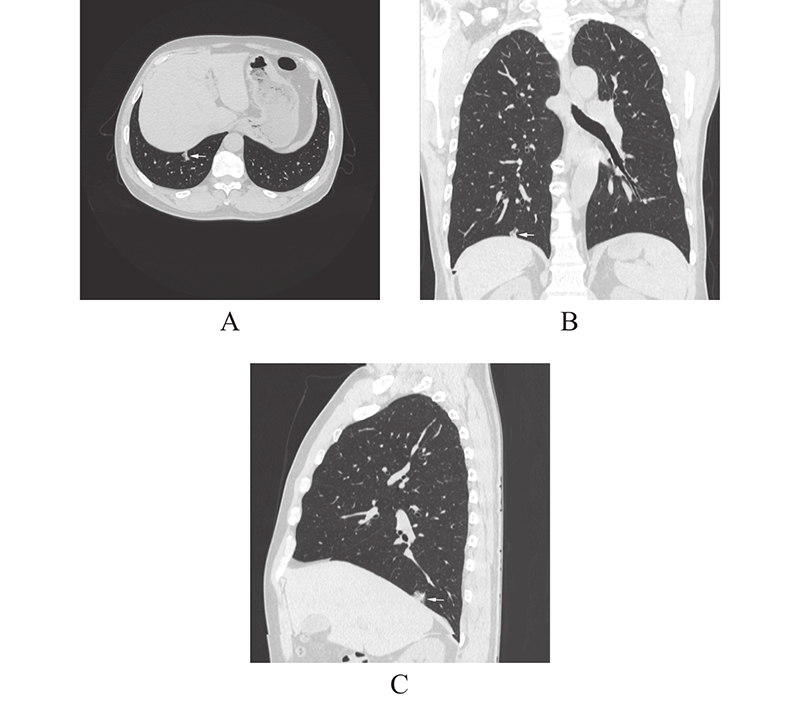
2 结 果单因素分析2组在年龄上差异显著,IMA组年龄更大(P < 0.05);CT特征上2组在结节最长直径、瘤肺界面、分叶、毛刺、支气管充气征或空泡征、血管异常改变差异有统计学意义( P < 0.05),IMA直径相对较大,瘤肺界面模糊较多( 图1,白箭),空泡征(图1,黑箭)或支气管充气征(图2,白箭)出现率较高,分叶和毛刺出现率相对较高,且IMA毛刺更长、较软(图2,白箭),血管异常改变出现相对偏少;2组在结节形态、胸膜牵拉方面差异无统计学意义(P > 0.05),但IMA不规则外形要多于NIMA(15.09% vs. 9.92%)(图3,表1)。多因素logistic回归分析IMA的独立影响因素结果(见表2)。预测模型的建立:risk score模型表述为:RA(risk score all) = 3.041 * 瘤肺界面 + 1.964 * 支气管充气征或空泡征 + 1.437*毛刺 − 1.919 * 血管异常改变 − 1.240。
|
图 1 女,73岁,周围结节型浸润性粘液腺癌CT征象 Figure 1 73-year-old woman with CT signs of peripheral invasive mucinous lung adenocarcinoma 注:女,73岁,CT示右上肺尖段外带胸膜下实性结节,瘤肺界面模糊(白箭),内部结构疏松,见多发小“空泡“(黑箭);病理:周围结节性粘液腺癌(IMA)。 |
|
图 2 男,67岁,周围结节型浸润性粘液腺癌CT征象 Figure 2 67-year-old man with CT signs of peripheral invasive mucinous lung adenocarcinoma 注:男,67,CT右下肺背段部分实性结节,形态偏不规则,边缘见“红毛丹”样毛刺(白箭),较长且软,中心见支气管充气征(黑箭);病理:IMA。 |
|
图 3 男,59岁,周围结节型浸润性粘液腺癌CT征象 Figure 3 59-year-old man with CT signs of peripheral invasive mucinous lung adenocarcinoma 注:男,59岁,CT示右下肺后基底段部分实性结节,实性成分为主,形态明显不规则,且边缘较平直。病理:IMA。 |
|
|
表 1 单因素分析IMA与NIMA组在人口统计学及CT特征上的差异 Table 1 Differences in demographics and CT features between the IMA and NIMA groups by univariable analysis |
|
|
表 2 多因素logistic回归分析IMA的独立影响因素结果 Table 2 Independent factors influencing IMA by multivariable logistic regression analysis |
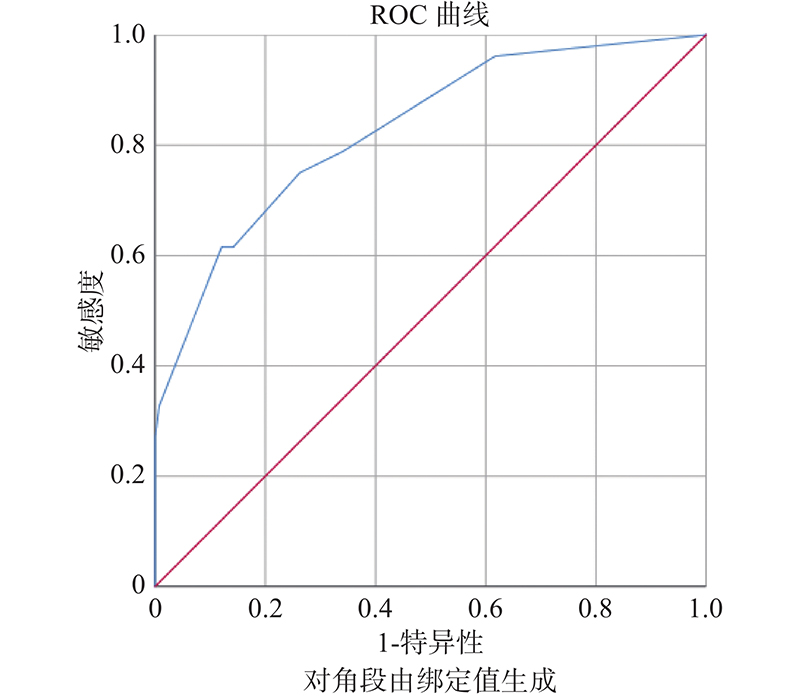
预测效能的评估 将计算出的194名研究对象风险总分绘制ROC曲线(图4),曲线(蓝色)下的面积为0.829(P < 0.05)。
|
图 4 ROC曲线评判模型的预测效能(蓝色) Figure 4 Prediction model performance by receiver operating characteristic curve (blue line) |
2015年世界卫生组织(WHO)明确浸润性粘液腺癌(IMA)属于肺腺癌的变异型,发生率低,病理上由杯状或高柱状上皮组成,具有丰富的胞浆内粘蛋白和均匀一致的位于基底部的细胞核[7-8];IMA中EGFR突变的发生率低于非粘液性浸润性肺腺癌(NIMA),KRAS突变发生率高于NIMA[9],早期即有近距离播散能力,后期可以向更远的肺实质内播散;关于IMA的预后,既往研究存在争议,部分研究显示其预后整体较NIMA差。由于EGFR突变率低,那么针对EGFR的化疗药物则不太可能起到很好效果,部分学者研究发现大多数晚期IMA患者化疗(非TKI、以铂类为基础)亦并不能改善OS[10],对于临床Ⅰ期IMA患者,仍建议手术切除[11];此外由于较高(50% ~ 70%)的气道播散率,对全身静脉化疗有抵抗力,部分学者提出针对呼吸道治疗可能有效[5]。B7-H4在IMA中表达,因此被认为是免疫治疗的靶点[12]。由于IMA与NIMA在临床、病理以及免疫、遗传上包括治疗方法上有如此大的差异,因此通过影像学研究及早认识、筛选出IMA以便制定最佳的治疗策略显得尤为重要。
大多数研究根据CT表现将IMA分为肺炎性和孤立结节型。对于肺炎性IMA,混合实变影、支气管充气或空泡征以及CT血管造影征是其特征性的CT表现,病理上是由大量的粘蛋白与肿瘤浸润的混合[5,13],而对于孤立结节型的IMA临床病理特征以及CT征象,却很少有报道。Miyata[14]等报告了一系列经手术切除的粘液型AIS/MIA,发现它们的特征是实性和部分实性的结节类型、伴有小叶边界和轮廓模糊的磨玻璃影,病理学认为是充满肺泡腔的粘蛋白、渗出的巨噬细胞和肿瘤细胞的浸润组成,而少有胸膜凹陷、棘状突起以及血管异常改变。而IMA会不会保持这些特征尚不清楚。
笔者通过单因素分析发现孤立结节型IMA和NIMA两组在年龄、结节的最长直径、瘤肺界面、分叶、毛刺、支气管充气征或空泡征、血管异常改变间差异有统计学意义(P < 0.05);而在性别、结节形态、胸膜牵拉、增强CT值相对值方面差异无统计学意义( P > 0.05);多因素logistic回归显示瘤肺界面模糊、支气管充气征或空泡征、毛刺、血管异常改变为主要影响因素。笔者经过研究发现24.53%(13/53)的IMA瘤肺界面模糊,而此征象在NIMA的发生率仅有2.3%(3/141),两者差异显著,模糊的瘤肺界面在病理上是由于结节边缘外溢的粘液以及巨噬细胞沿肺泡间隔、肺泡孔流动而移动,播散到远离结节的区域,境界模糊且欠规则。而NIMA的磨玻璃影,境界相对较清晰且规则,一般为正常肺泡上皮部分被肿瘤细胞替代而肺泡腔未被完全填充的影像征象。此征象虽然发生率偏低,但确是鉴别IMA与其他类型IA期肺癌的重要CT特征之一。笔者研究发现支气管充气征或空泡征在IMA发生率为64.15%(34/53)明显高于NIMA中的24.11%(34/141),差异具有统计学意义。据报道孤立结节型IMA极易出现空腔病变(支气管充气征或空泡征) [15-17];病理上支气管充气征或空泡征的形成原因有以下几个方面:1、粘液池中的粘液通过与之相连的支气管排出。2、肿瘤沿着终末气道浸润性生长并分泌粘液,堵塞气道形成呼吸活瓣效应,气体易进难出,导致肺泡过度充气后破裂而形成的腔隙。3、正常的肺泡腔组成的无瘤区。4、肿瘤中含有的水解酶分解破坏正常的肺泡间质弹力纤维而形成的腔隙。除此以外笔者通过单因素分析发现在分叶、毛刺以及血管异常改变上2组差异显著,这些常发生于孤立结节或肿块型肺癌的可靠CT特征亦是诊断IMA的有用的形态学指标[13];但笔者研究发现毛刺征在IMA与NIMA表现有所差异,前者部分表现更长且软,类似水果“红毛丹”,推测其形成原因 :1、IMA的肿瘤细胞胞浆内含多量的粘蛋白。2、肿瘤细胞沿着肺泡间质浸润时还包含有丰富的细胞外粘液。3、新生的肿瘤血管。除了瘤肺界面模糊外,不规则的结节外形亦是引起IA期肺腺癌误诊的重要原因之一[17],有研究报道早期IMA误诊率为35%[14]。且虽统计学差异不显著,但本组IMA不规则外形要多于NIMA(15.09% vs. 9.92%),对边缘模糊、形态偏不规则的结节,务必短期抗炎治疗后复查CT,并建议参照笔者既往发表的关于IA期肺腺癌的检查技术以及阅片规范的建议[17]。由此笔者得出结论:孤立结节型IMA维持了粘液性AIS/MIA的CT特征,如模糊的瘤肺界面,以及支气管充气征或空泡征,但由于浸润成分的出现和增加,与AIS及MIA不同的是,IMA亦表现出孤立结节或肿块型IA的分叶、毛刺、血管异常改变的CT征象,且与NIMA间差异显著(P < 0.05)。受试者工作曲线(ROC)用来评估Risk score(风险评分)预测模型的曲线下的面积达到为0.829( P < 0.05),提示该模型预测效能良好,可以尝试在人群中实际应用。
总之,与NIMA相比,IA期周围型孤立结节型IMA年龄更大,CT上更多表现出模糊的瘤肺界面以及支气管充气征或空泡征;毛刺较长且软。基于瘤肺界面、支气管充气征或空泡征、毛刺、血管异常改变为主要影响因素而建立的risk score预测模型对IMA具有良好的的预测效果。
| [1] |
Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization classification of lung tumors: impact of genetic, clinical and radiologic advances since the 2004 classification[J]. J Thorac Oncol, 2015, 10(9): 1243-1260. DOI:10.1097/JTO.0000000000000630 |
| [2] |
Moon SW, Choi SY, Moon MH, et al. Effect of invasive mucinous adenocarcinoma on lung cancer-specific survival after surgical resection: A population-based study[J]. J Thorac Dis, 2018, 10(6): 3595-3608. DOI:10.21037/jtd.2018.06.09 |
| [3] |
Dacic S. Pros: the present classification of mucinous adenocarcinomas of the lung[J]. Transl Lung Cancer Res, 2017, 6(2): 230-233. DOI:10.21037/tlcr.2017.04.11 |
| [4] |
Lee HY, Cha MJ, Lee KS, et al. Prognosis in resected invasive mucinous adenocarcinomas of the lung: related factors and comparison with resected nonmucinous adenocarcinomas[J]. J Thorac Oncol, 2016, 11(7): 1064-1073. DOI:10.1016/j.jtho.2016.03.011 |
| [5] |
Watanabe H, Saito H, Yokose T, et al. Relation between thin-section computed tomography and clinical findings of mucinous adenocarcinoma[J]. Ann Thorac Surg, 2015, 99(3): 975-981. DOI:10.1016/j.athoracsur.2014.10.065 |
| [6] |
Lee MA, Kang J, Lee HY, et al. Spread Through Air Spaces (STAS) in invasive mucinous adenocarcinoma of the lung: Incidence, prognostic impact, and prediction based on clinicoradiologic factors[J]. Thorac Cancer, 2020, 11(11): 3145-3154. DOI:10.1111/1759-7714.13632 |
| [7] |
Cha YJ, Shim HS, et al. Biology of invasive mucinous adenocarcinoma of the lung[J]. Transl Lung Cancer Res, 2017, 6(5): 508-512. DOI:10.21037/tlcr.2017.06.10 |
| [8] |
Shimizu K, Okita R, Saisho S, et al. Clinicopathological and immunohistochemical features of lung invasive mucinous adenocarcinoma based on computed tomography findings[J]. OncoTargets Ther, 2016, 28(10): 153-163. DOI:10.2147/OTT.S121059 |
| [9] |
王泽国, 郁万江, 娄和南, 等. 周围型肺腺癌表皮生长因子受体基因突变与CT上磨玻璃成分含量、病理的相关性[J]. 实用放射学杂志, 2019, 35(1): 40-43,54. Wang ZG, Yu WJ, Lou HN, et al. Epidermal growth factor receptor mutation in peripheral lung adenocarcinoma: relationship with quantitative CT analysis of ground-glass opacity and histologic subtypes[J]. J Pract Radiol, 2019, 35(1): 40-43,54. DOI:10.3969/j.issn.1002-1671.2019.01.010 |
| [10] |
Cha YJ, Kim HR, Lee HJ, et al. Clinical course of stage IV invasive mucinous adenocarcinoma of the lung[J]. Lung Cancer, 2016, 102: 82-88. DOI:10.1016/j.lungcan.2016.11.004 |
| [11] |
Wang YD, Liu JC, Huang CC, et al. Development and validation of a nomogram for predicting survival of pulmonary invasive mucinous adenocarcinoma based on Surveillance, Epidemiology, and End Results (SEER) database[J]. BMC Cancer, 2021, 21(1): 148. DOI:10.1186/s12885-021-07811-x |
| [12] |
Guo MZ, Tomoshige K, Meister M, et al. Gene signature driving invasive mucinous adenocarcinoma of the lung[J]. EMBO Mol Med, 2017, 9(4): 462-481. DOI:10.15252/emmm.201606711 |
| [13] |
Miyamoto A, Kurosaki A, Fujii T, et al. HRCT features of surgically resected invasive mucinous adenocarcinoma associated with interstitial pneumonia[J]. Respirology, 2017, 22(4): 735-743. DOI:10.1111/resp.12947 |
| [14] |
Miyata N, Endo M, Nakajima T, et al. High-resolution computed tomography findings of early mucinous adenocarcinomas and their pathologic characteristics in 22 surgically resected cases[J]. Eur J Radiol, 2015, 84(5): 993-997. DOI:10.1016/j.ejrad.2015.01.014 |
| [15] |
王康, 李铭, 周翔, 等. 孤立结节型肺黏液腺癌的CT表现与病理对照研究[J]. 临床放射学杂志, 2020, 39(9): 1768-1772. Wang K, Li M, Zhou X, et al. Solitary nodule pulmonary mucinous adenocarcinoma-comparison of CT findings and pathology[J]. J Clin Radiol, 2020, 39(9): 1768-1772. DOI:10.13437/j.cnki.jcr.2020.09.020 |
| [16] |
聂凯, 于红, 刘士远, 等. 原发性肺浸润性黏液腺癌CT征象及病理特点[J]. 实用放射学杂志, 2018, 34(9): 1335-1338,1380. Nie K, Yu H, Liu SY, et al. CT and pathological features of primary pulmonary invasive mucinous adenocarcinoma[J]. J Pract Radiol, 2018, 34(9): 1335-1338,1380. DOI:10.3969/j.issn.1002-1671.2018.09.007 |
| [17] |
张磊, 谢超, 沈文荣. IA期肺腺癌的CT表现分型及其临床意义[J]. 临床放射学杂志, 2019, 38(9): 1653-1657. Zhang L, Xie C, Shen WR. Explore CT Classification and clinical significance for stage IA lung adenocarcinoma[J]. J Clin Radiol, 2019, 38(9): 1653-1657. DOI:10.13437/j.cnki.jcr.2019.09.018 |




