2. 同济大学附属第一妇婴保健院设备科,上海 200092
2. Department of Medical Equipment, Shanghai First Maternity and Infant Hospital, School of Medicine, Tongji University, Shanghai 200092, China
医疗照射已成为全世界最大的人工电离辐射来源(占95%以上),而计算机体层摄影(Computed Tomography, CT)检查占据了医疗照射所致人群年累计剂量的61.6%[1]。同时,人们接受CT检查的频次较高且有逐年增长的趋势。我国上海市2016年CT检查的年频度估算值为304人次/千人口,占年总频度的24.79%,是2007年的2.74倍[2-3]。欧美国家CT检查的数量也在增长[4],美国2016年CT检查的数量增加了25%(约8 400万)[5]。CT的使用频率不断增加直接导致了放射检查所致集体剂量持续增加[6]。美国2016年CT扫描所致集体有效剂量占放射学成像总剂量由2006年的50%提升到63%[5]。在德国,由于CT检查次数的增加,人均有效剂量从2007年到2016年增加了约50%[7]。
与此同时,CT检查等诊断性低剂量辐射照射引发的生物学效应也引起了人们的关注,越来越多的流行病学研究支持低剂量电离辐射会带来额外的癌症风险[8-9]。Hong JY等[10]报道了接受过CT扫描的个体的总体癌症发病率高于未接受过CT扫描的个体(发病率比例为 1.54[95%CI,1.45~1.63];P < 0.001)。同时,对于非癌症类疾病,相对低剂量的辐射会增加晶状体混浊、白内障和心血管疾病等的发病率 [5, 11]。
器官剂量,即单位质量的组织、器官因暴露于射线照射而吸收的辐射能量,该参数被认为是量化辐射剂量和评估风险的最有意义的指标[12]。首先,器官剂量可用于回顾性评估:作为辐射流行病学研究的一部分,评估辐射诱发的风险需要受检者器官剂量的数据作为依据;其次,器官剂量还可用于前瞻性评估:通过不同扫描方案的比较,做到满足所需影像质量的同时尽量降低辐射剂量[13],为践行受检者防护最优化提供科学数据。但是器官剂量在扫描记录和CT影像中很难直接获得。目前评价器官剂量的方法有:剂量转换系数、蒙特卡罗模拟、剂量计算软件、物理模体测量和直接测量人体剂量等。本文系统分析了CT所致受检者器官剂量测量方法与估算方法的研究进展及其发展趋势。
1 器官剂量的测量 1.1 基于物理模体测量器官剂量近五十年来,辐射防护、医学影像领域的物理模体研究呈指数增长[14]。仿真人物理模体通常拥有人口平均的解剖参数,和真实的人体在体型、组织分布、器官构成、器官密度上相似(图1)。它们通常由多种组织等效材料组成,并在待测量的器官上留出微小的空腔,以放置探测器。热释光剂量计(Thermoluminescent Dosimeters,TLD)和光释光剂量计常被用于测量模体中的点吸收剂量,因为它们灵敏性很高,并且具有比较好的线性,在能量响应和非线性响应上均能满足相关国家标准技术要求的规定[15]。近年来也有研究用金属氧化物半导体场效应晶体管(Metal Oxide Silicon Field Effect Transistor,MOSFET)测量模体内的点剂量[16]。

|
图 1 ATOM物理模体(左)和物理模体探测器孔位与断面图(右) Figure 1 ATOM phantoms (left) and holes for dosimeter placement showed in the physical phantom and transverse axial plane (right) |
传统的物理模体价格相对昂贵,且难以仿真解剖结构复杂的部位[17-18]。另外,这些模体通常是代表某一个群体,无法做到个体化。3D打印技术在医学应用上也得到了探索[19-21](图2),与传统的模体制造技术相比,3D打印能在更短的时间、更少的人力成本下实现更复杂的几何结构加工,这使得快速构建个性化患者模体成为可能[22]。目前有多项研究投入到辐射防护领域3D打印材料的开发中,但可用的材料仍然非常有限[19, 23-24]。

|
图 2 肝脏建模图(a)、3D打印的肝模体照片(b)和3D模体的CT影像 (c)[22] Figure 2 Constructed liver model (a), photo of 3D printed liver phantom (b), and CT image of 3D printed liver phantom (c) |
综上所述,使用物理模体配合剂量计可以实现器官剂量的测量,而规格相同的物理模体也便于不同实验室之间开展比较研究。但临床上的患者体型不一,使用的扫描参数也各有不同,故没有任何一个物理模体可以用来准确测量患者剂量。3D打印技术虽有望实现个体化器官剂量的测量,但受组织等效材料及价格的限制,目前多应用于剂量验证。
1.2 人体器官剂量的直接测量虽然无法将剂量计直接置入人体器官中进行在体器官剂量的测量,但在无创的条件下可以实现体表器官的剂量测量,例如皮肤、晶状体、甲状腺、乳房和外生殖器。还可以在患者接受肠镜检查的同时使用TLD测量直肠的剂量[25]。
捐赠的遗体也可以用作CT的剂量学测定,尸体的辐射衰减特性与活体几乎相同,并且不受部位的限制。目前该方面的文献较少,主要是用于研究实际测量与蒙卡结果的剂量对比[26],或者推算出剂量方程来计算患者的个体化器官剂量。
2 器官剂量的估算 2.1 剂量转换系数目前用于描述CT辐射输出的主要指标是CT剂量指数(CT Dose Index, CTDI)。CTDI引申的物理量包括加权CT剂量指数(CTDIw),容积CT剂量指数(CTDIvol)以及剂量长度乘积(Dose-Length Product, DLP)。这些表征量能够反映CT机的辐射输出以及医生的扫描参数选择[27],但并不能给出辐射在患者体内的分布情况。有研究报道,CTDIvol与器官剂量的平均差值为28.3%~39.1%[28]。为此,美国医学物理师协会(The American Association of Physicists in Medicine, AAPM)提出了体型特异性扫描剂量 (Size-Specific Dose Estimate, SSDE)[29]。将CTDIvol与基于患者身体体型(即前后径、左右径、有效直径)的体型特异性系数相乘,以得到对患者剂量的估计值。AAPM220号报告又引入了等效水直径(water equivalent diameter, WED)作为患者的体型参数,修正了SSDE的计算方法。但是,SSDE仅能代表的是均匀衰减的患者,仍然没有反映组织成分和患者解剖结构。另外,SSDE也没有将扫描长度纳入考虑范围。
综上所述,CTDIvol、DLP和SSDE并不能代表患者器官中真实的剂量沉积。为了将这些参数转化为患者剂量,一些学者开始研究患者特异的、不依赖于扫描参数和CT装置的剂量转换系数。我国发布了GB/T 16137—2021国家标准,给出了由CTDIvol计算器官剂量的转换系数[30]。有研究显示,CTDIvol归一化的器官剂量(h因子)和DLP归一化的有效剂量(k因子)与人体直径呈指数关系,并且不依赖于扫描参数和CT装置。器官O的h因子为:
| $ h_{{\rm{O}}}=\exp ({\text{α}}{\rm{d}}_{{\rm{avg}}} + {\text{β}}) $ |
其中,davg为扫描范围内患者横截面的平均直径,α、β为拟合参数。从控制台获取到扫描的CTDIvol后,与hO相乘即可得到器官剂量。
k因子的计算,也是同理建立k因子与患者直径的关系。已有研究建立了多种扫描协议下的转换因子。转换因子不仅取决于扫描部位、管电压、管电流,还受患者BMI影响[31]。基于BMI和基于患者体型的k因子和h因子已经生成,以提供更合理的剂量估计值[13, 31-32]。
Yang Y等[33]发现CTDIvol归一化的器官剂量与患者大小呈负相关,因此建立了一种个体化器官剂量计算方法,可用CTDIvol结合WED来估算胸部ATCM 扫描的肺、心脏和乳腺的剂量。
在CT扫描中,利用患者的体型参数和转换因子能获得器官剂量的近似值。但是,该方法对于头部的器官,以及部分位于扫描区域外的器官拟合效果较差。
2.2 蒙特卡罗模拟蒙卡(Monte Carlo, MC)算法是一种通过模拟X射线的每个光子与人体组织的相互作用来计算器官剂量的方法,在医学领域被认为是计算个体化器官剂量的金标准[5]。蒙卡模拟的过程通常分为4步:1)蒙卡代码需要输入X射线束的能谱、滤过和几何参数的数据;2)建立数字化模体。对患者进行扫描后得到DICOM文件。将文件导入3D DOCTOR®、3DSlicer®等器官分割软件,勾画出器官或组织,形成分割文件。将分割文件体素化(图3),赋予其密度、化学组成;3)获取扫描的信息,例如管电压、管电流、扫描范围、准直宽度和螺距等等;4)蒙特卡罗拟输出的结果为相对值,需要结合CT扫描的技术参数,才能计算出受检者的器官剂量。通常使用实验和模拟得到的CTDI相比,得到转换因子。
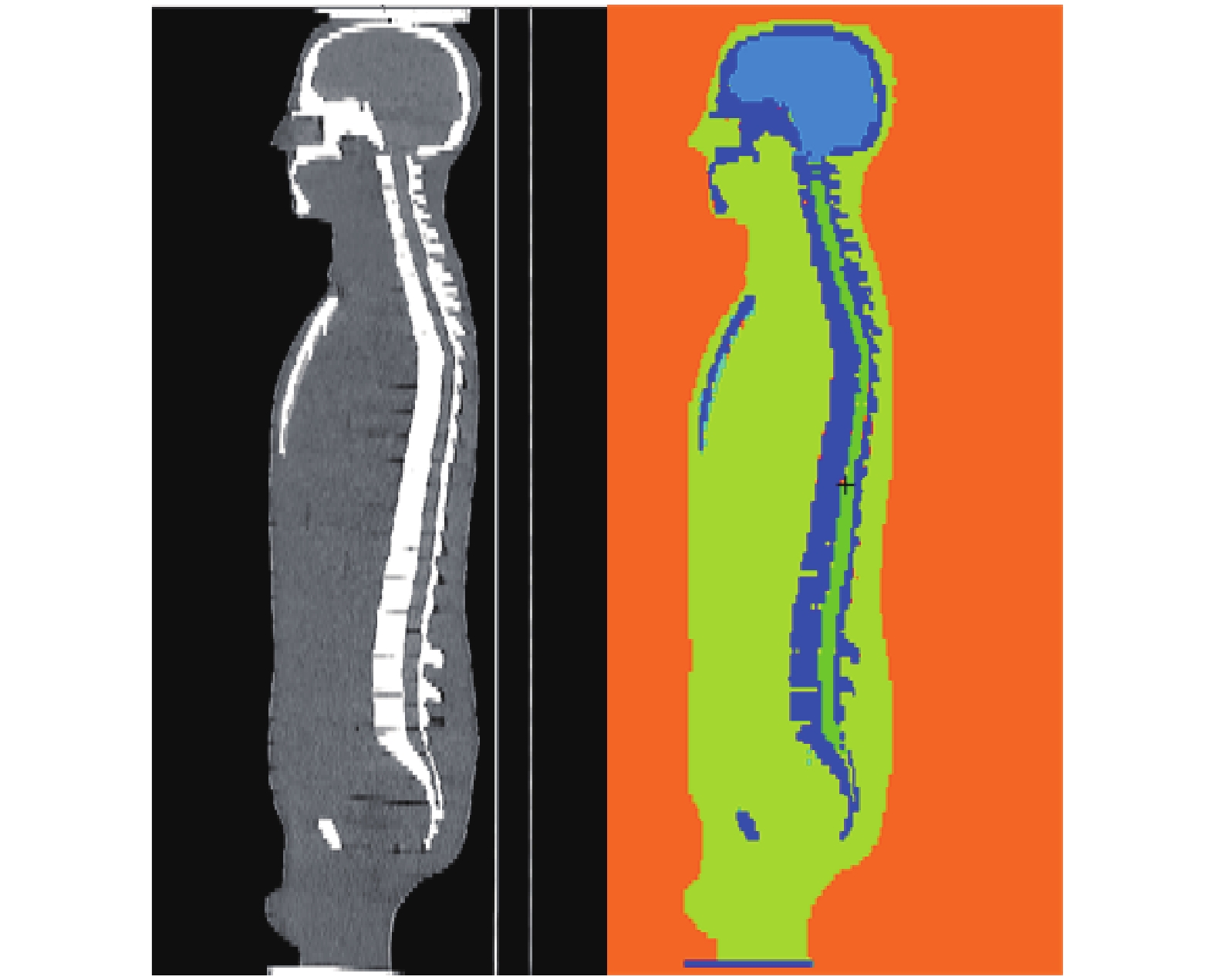
|
图 3 ATOM物理模体CT扫描影像(左)和数字化的ATOM体素模型(右) Figure 3 CT image of ATOM phantom(left) and voxel model of ATOM phantom(right) |
更进一步,MC模拟可以得到人体内每一个特定体素的吸收剂量。CT扫描后,采用阈值分割的方法,根据图像的CT值来定义每个像素的材料(如空气、肺、软组织、脂肪和骨骼等)。在模拟过程中,沉积的能量被积累和保存在具有相同编号体素中。使用该方法,所有体素的剂量可以形成一个三维的剂量分布图。配准后,剂量信息能够在扫描影像上显示出来(图4)。

|
图 4 腹部CT影像(左)和剂量图(右) Figure 4 Abdominal CT image(left) and dose map(right) |
近年来,一些基于图像计算单元(graphics computing units, GPUs)的蒙卡算法被开发,这能极大提高蒙卡计算的效率。Liu等[34]报道了基于GPU的MC代码,比通用MC代码MCNPX快42倍。Chen等[35]报道了用于胸部CT的GPU代码比单线程CPU代码快55倍。XU等[36]开发了基于蒙卡的ARCHER计算平台,性能对比结果表明,使用GPU和Intel协处理器等硬件加速器可以显著提高速度。此外,有研究使用深度学习卷积神经网络从病人的CT影像分割多个器官,与GPU加速的MC剂量计算平行运行。这种方法结合了2种技术,能快速地计算出器官剂量,满足临床上对效率和准确性的要求[36]。
蒙卡模拟得到的器官剂量精度较高,且能做到个体化。但传统的蒙卡模拟需构建CT装置和受检者的模型,费时费力。基于GPU和神经网络的蒙卡仿真可显著提高模拟计算的效率。但是,蒙卡模拟还需要很高的计算性能、高度专业化的编程技术,因此,该方法难以被临床放射技术人员所掌握,通常用于科学研究中。
2.3 剂量计算软件计算软件大多是基于MC模拟得到的辐射剂量数据库。在剂量计算软件中输入所需的扫描参数后(表1),软件提供患者的器官剂量信息。CT剂量软件通常由数字化人体模型、CT装置模型、器官剂量数据库等多个结构组成,各个平台的计算方法都不尽相同[12, 37]。
|
|
表 1 各种扫描软件所需的输入参数 Table 1 Input parameters needed by different soft wares |
每个软件都会内置多个数字模体。有的软件使用最基础的程式化模体,例如ImPACT、WinDose和ImpactDose。这种模体很难逼真地描述复杂的人体结构[18]。体素化模体的出现,是因为CT和磁共振成像等技术使得人们能够以三维形式看到身体内部结构,并用多种数字格式存储影像。有的计算软件采用了这种体素化模体,如CT-Expo和NCICT。我国清华大学研究团队建立了体素化的中国参考人男性模体、女性模体[38]以及1岁儿童模体[39],并将基于上述模体的蒙卡模拟计算数据集成于一个基于web的剂量评估软件中[40]。但由于以体素格式调整解剖信息的效率极低,因此能够灵活调整形状的非均匀有理B样条(non-uniform rational B-spline, NURBS)或多边形网格形式的BREP(boundary representation)模体成为器官剂量计算的最新研究工具。现在也有一些软件使用这类模体[14],如VirtualDose和DoseWatch。
CT装置的参数通常从CT制造商那里获得。为了准确地计算CT装置独特的射束特征对器官剂量的影响,应该对所模拟的CT装置详细的源项参数进行单独的建模。但也有研究显示,当器官剂量被该CT装置的CTDIvol归一化后,受CT装置影响较小(变异系数5%以内),该方法已广泛应用于现有的大多数CT剂量计算软件。
大多数CT剂量计算软件都采用预先计算的器官剂量数据库来执行快速剂量计算。为了建立器官剂量数据库,需要进行大量的蒙特卡罗计算[12]。已有文献发表了从物理模体测量或蒙特卡罗模拟中获得的归一化剂量数据[41-42]。
调制管电流的获取可以从CT影像DICOM的头文件中读取,也可以在未进行扫描前进行前瞻性预测。前瞻性预测的算法是从数字模体或定位片中计算X射线穿过人体到达探测器的辐射衰减量,以计算调制管电流[43-44]。DoseWatch、ImpactDose和NCICT2.0均采用了上述前瞻性算法来预测自动管电流。
Cristina等[37]对比了CT-Expo、NCICT、NCICTX和Virtual Dose计算的器官剂量,发现由于各个软件之间的计算方式不同,使用不同的软件计算出的器官剂量的差异是显著的。另外,对于目前常用的管电流调制技术,能考虑到管电流调制信息的软件并不多,特别是对于角度调制,由于无法通过DICOM文件获取角度调制的管电流信息,因此目前CT计算软件难以较为准确的计算包含角度调制的自动管电流CT扫描所致受检者的剂量。所以,计算软件给出的只是一个近似的剂量,并非个体化剂量。
3 总结与展望CT扫描所致受检者器官剂量的测量包括利用物理模体测量和人体表面直接测量。测量得出的器官剂量结果可靠,但难以大规模开展系统性研究。利用表征CT辐射输出的CTDI和DLP等进行器官剂量的估算最为简便,但误差较大,无法做到受检者个性化剂量评估。蒙特卡罗模拟是估计病人器官剂量的金标准,但费时费力,且需要高计算机性能和专业化的编程技术。CT扫描剂量计算软件大多是能满足一部分临床要求。但一些扫描时的真实数据难以完全获取、利用,因此也难以做到个体化剂量评估。
尽管利用人工智能方法估算CT器官剂量的研究很少,但是他们的研究结果让人们看到了这一方向的巨大前景。基于人工智能的影像分割,与GPU加速的蒙特卡罗剂量计算平行运行,即可实现个性化器官剂量的计算又大大减小模拟计算的时间代价。通过搭建软件平台将上述功能封装,不需要专业的编程技能,即可实现基于CT图像实时计算个体化的器官剂量。
另一方面,CT用于采集数据的探测器本身便带有辐射剂量的信息。因此,利用CT探测器的信号中的衰减信息,也可重建出受检者的器官剂量。理论上,多道CT探测器采集到的多个投影角度的人体对X射线的衰减数据,可反映受检者的体型、扫描覆盖范围等信息。通过建立不同体型患者的器官剂量与射线衰减的映射关系,以及获取每个角度CT管电流的输出后,可以更为准确地计算出受检者的器官剂量。可见基于探测器信号的逆向计算受检者器官剂量,可以利用更为丰富的CT扫描信息,因此计算结果更为准确。
| [1] |
United Nations Scientific Committee on the Effects of Atomic Radiation. Sources, effects and risks of ionizing radiation[R]. New York: United Nations, 2022.
|
| [2] |
Yao J, Gao LF, Qian AJ, et al. Survey on frequency of medical X-ray diagnosis in Shanghai[J]. Chin J Radiol Med Prot, 2019, 39(5): 370-375. DOI:10.3760/cma.j.issn.0254-5098.2019.05.009 |
| [3] |
高林峰, 姚杰, 郑钧正, 等. 上海市2007年X射线诊断的医疗照射应用频率及其分布[J]. 环境与职业医学, 2009, 26(6): 532-536. Gao LF, Yao J, Zheng JZ, et al. Frequency levels and distribution of medical exposure of diagnostic X-ray procedures in 2007 in Shanghai[J]. J Environ Occup Med, 2009, 26(6): 532-536. DOI:10.13213/j.cnki.jeom.2009.06.029 |
| [4] |
Mettler FA Jr, Mahesh M, Bhargavan-Chatfield M, et al. Patient exposure from radiologic and nuclear medicine procedures in the United States: procedure volume and effective dose for the period 2006-2016[J]. Radiology, 2020, 295(2): 418-427. DOI:10.1148/radiol.2020192256 |
| [5] |
Damilakis J. CT dosimetry: what has been achieved and what remains to be done[J]. Invest Radiol, 2021, 56(1): 62-68. DOI:10.1097/rli.0000000000000727 |
| [6] |
Abalo KD, Rage E, Leuraud K, et al. Correction to: early life ionizing radiation exposure and cancer risks: systematic review and meta-analysis[J]. Pediatr Radiol, 2021, 51(1): 157-158. DOI:10.1007/s00247-020-04883-y |
| [7] |
Bundesamt für Strahlenschutz. X-ray diagnostics: frequency and radiation exposure of the German population[EB/OL]. (2022-04-14). https://www.bfs.de/EN/topics/ion/medicine/diagnostics/x-rays/frequency-exposure.html.
|
| [8] |
陈湃韩, 陈慧峰, 邹剑明. 低剂量电离辐射长期接触健康效应研究进展[J]. 中国辐射卫生, 2022, 31(1): 99-104. Chen PH, Chen HF, Zou JM. Research progress in health effects of long-term exposure to low-dose ionizing radiation[J]. Chin J Radiol Health, 2022, 31(1): 99-104. DOI:10.13491/j.issn.1004-714X.2022.01.018 |
| [9] |
de Gonzalez AB, Daniels RD, Cardis E, et al. Epidemiological studies of low-dose ionizing radiation and cancer: rationale and framework for the monograph and overview of eligible studies[J]. J Natl Cancer Inst Monogr, 2020, 2020(56): 97-113. DOI:10.1093/jncimonographs/lgaa009 |
| [10] |
Hong JY, Han K, Jung JH, et al. Association of exposure to diagnostic low-dose ionizing radiation with risk of cancer among youths in South Korea[J]. JAMA Network Open, 2019, 2(9): e1910584. DOI:10.1001/jamanetworkopen.2019.10584 |
| [11] |
高宇, 苏垠平, 孙全富. 低剂量电离辐射致眼晶状体混浊机制及遗传易感性研究现状[J]. 中国辐射卫生, 2022, 31(1): 124-128. Gao Y, Su YP, Sun QF. A research review of mechanism and genetic susceptibility of lens opacity induced by low-dose ionizing radiation[J]. Chin J Radiol Health, 2022, 31(1): 124-128. DOI:10.13491/j.issn.1004-714X.2022.01.022 |
| [12] |
Lee C. A review of organ dose calculation tools for patients undergoing computed tomography scans[J]. J Radiat Prot Res, 2021, 46(4): 151-159. DOI:10.14407/jrpr.2021.00136 |
| [13] |
Gao YM, Mahmood U, Liu TY, et al. Patient-specific organ and effective dose estimates in adult oncologic CT[J]. Am J Roentgenol, 2020, 214(4): 738-746. DOI:10.2214/ajr.19.21197 |
| [14] |
Xu XG. An exponential growth of computational phantom research in radiation protection, imaging, and radiotherapy: a review of the fifty-year history[J]. Phys Med Biol, 2014, 59(18): R233-R302. DOI:10.1088/0031-9155/59/18/r233 |
| [15] |
潘秋秋, 黄丽华, 冯丫娟, 等. 光致光与热释光剂量计部分性能比较[J]. 中国辐射卫生, 2019, 28(3): 318-320. Pan QQ, Huang LH, Feng YJ, et al. The comparison of partial performance between OSL dosemeter and TLD dosemeter[J]. Chin J Radiol Health, 2019, 28(3): 318-320. DOI:10.13491/j.issn.1004-714X.2019.03.027 |
| [16] |
Yang Y, Zhuo WH, Chen B, et al. A new phantom developed to test the ATCM performance of chest CT scanners[J]. J Radiol Prot, 2021, 41(2): 349-359. DOI:10.1088/1361-6498/abf900 |
| [17] |
Filippou V, Tsoumpas C. Recent advances on the development of phantoms using 3D printing for imaging with CT, MRI, PET, SPECT, and ultrasound[J]. Med Phys, 2018, 45(9): e740-e760. DOI:10.1002/mp.13058 |
| [18] |
Liu HK, Gu JW, Caracappa PF, et al. Comparison of two types of adult phantoms in terms of organ doses from diagnostic CT procedures[J]. Phys Med Biol, 2010, 55(5): 1441-1451. DOI:10.1088/0031-9155/55/5/012 |
| [19] |
Alssabbagh M, Tajuddin AA, Manap MBA, et al. Evaluation of nine 3D printing materials as tissue equivalent materials in terms of mass attenuation coefficient and mass density[J]. Int J Adv Appl Sci, 2017, 4(9): 168-173. DOI:10.21833/ijaas.2017.09.024 |
| [20] |
Lee DY, Jo YI, Yang SH. Development of breast phantoms using a 3D printer and glandular dose evaluation[J]. J Appl Clin Med Phys, 2021, 22(10): 270-277. DOI:10.1002/acm2.13408 |
| [21] |
Hazelaar C, Van Eijnatten M, Dahele M, et al. Using 3D printing techniques to create an anthropomorphic thorax phantom for medical imaging purposes[J]. Med Phys, 2018, 45(1): 92-100. DOI:10.1002/mp.12644 |
| [22] |
Leng S, Chen BY, Vrieze T, et al. Construction of realistic phantoms from patient images and a commercial three-dimensional printer[J]. J Med Imaging (Bellingham), 2016, 3(3): 033501. DOI:10.1117/1.JMI.3.3.033501 |
| [23] |
Gallas RR, Hünemohr N, Runz A, et al. An anthropomorphic multimodality (CT/MRI) head phantom prototype for end-to-end tests in ion radiotherapy[J]. Z Med Phys, 2015, 25(4): 391-399. DOI:10.1016/j.zemedi.2015.05.003 |
| [24] |
Saotome K, Matsushita A, Matsumoto K, et al. A brain phantom for motion-corrected PROPELLER showing image contrast and construction similar to those of in vivo MRI[J]. Magn Reson Imaging, 2017, 36: 32-39. DOI:10.1016/j.mri.2016.10.003 |
| [25] |
Mueller JW, Vining DJ, Jones AK, et al. JOURNAL CLUB: in vivo CT dosimetry during CT colonography[J]. Am J Roentgenol, 2014, 202(4): 703-710. DOI:10.2214/ajr.13.11092 |
| [26] |
Lopez-Rendon X, Stratis A, Zhang G, et al. Peak skin and eye lens radiation dose from brain perfusion CT: CTDIvol and Monte Carlo based estimations
[J]. Eur J Radiol, 2020, 126: 108950. DOI:10.1016/j.ejrad.2020.108950 |
| [27] |
刘海宽, 卓维海, 郑钧正. X射线诊断所致受检者辐射剂量的表征与评估研究进展[J]. 中国医学物理学杂志, 2008, 25(2): 547-551,566. Liu HK, Zhuo WH, Zheng JZ. Progress on characterizing and evaluating radiation doses to examinees from X-ray diagnosis[J]. Chin J Med Phys, 2008, 25(2): 547-551,566. |
| [28] |
Tian XY, Li X, Segars WP, et al. Dose coefficients in pediatric and adult abdominopelvic CT based on 100 patient models[J]. Phys Med Biol, 2013, 58(24): 8755-8768. DOI:10.1088/0031-9155/58/24/8755 |
| [29] |
American Association of Physicists in Medicine. Size-specific dose estimates (SSDE) in pediatric and adult body CT examinations[R]. Alexandria: AAPM, 2011.
|
| [30] |
国家市场监督管理总局, 国家标准化管理委员会. GB/T 16137—2021 X射线诊断中受检者器官剂量的估算方法[S]. 北京: 中国标准出版社, 2021. State Administration for Market Regulation, Standardization Administration. GB/T 16137—2021 Methods for estimation of examinee's organ doses in X-ray diagnosis[S]. Beijing: Standards Press of China, 2021. |
| [31] |
Liang BH, Gao YM, Chen Z, et al. Evaluation of effective dose from CT scans for overweight and obese adult patients using the virtualdose software[J]. Radiat Prot Dosimetry, 2017, 174(2): 216-225. DOI:10.1093/rpd/ncw119 |
| [32] |
Li X, Samei E, Williams CH, et al. Effects of protocol and obesity on dose conversion factors in adult body CT[J]. Med Phys, 2012, 39(11): 6550-6571. DOI:10.1118/1.4754584 |
| [33] |
Yang Y, Zhuo WH, Zhao YY, et al. Estimating specific patient organ dose for chest CT examinations with Monte Carlo method[J]. Appl Sci-Basel, 2021, 11(19): 8961. DOI:10.3390/app11198961 |
| [34] |
Liu TY, Ding A, Xu X. MO-F-213CD-01: GPU-based Monte Carlo methods for accelerating radiographic and CT imaging dose calculations: feasibility and scalability[J]. Med Phys, 2012, 39(6): 3876. DOI:10.1118/1.4735826 |
| [35] |
Chen W, Kolditz D, Beister M, et al. Fast on-site Monte Carlo tool for dose calculations in CT applications[J]. Med Phys, 2012, 39(6): 2985-2996. DOI:10.1118/1.4711748 |
| [36] |
Peng Z, Fang X, Yan PK, et al. A method of rapid quantification of patient-specific organ doses for CT using deep-learning-based multi-organ segmentation and GPU-accelerated Monte Carlo dose computing[J]. Med Phys, 2020, 47(6): 2526-2536. DOI:10.1002/mp.14131 |
| [37] |
De Mattia C, Campanaro F, Rottoli F, et al. Patient organ and effective dose estimation in CT: comparison of four software applications[J]. Eur Radiol Exp, 2020, 4(1): 14. DOI:10.1186/s41747-019-0130-5 |
| [38] |
潘羽晞, 邱睿, 刘立业, 等. 辐射防护用中国参考人体素模型建立、应用及最新进展[J]. 辐射防护, 2014, 34(4): 199-205. Pan YX, Qiu R, Liu LY, et al. Chinese reference human voxel phantoms for radiation protection: development, application and recent progress[J]. Radiat Prot, 2014, 34(4): 199-205. |
| [39] |
王栋, 邱睿, 潘羽晞, 等. 基于物理体模CT图像的1岁儿童体素体模构建[J]. 原子能科学技术, 2016, 50(4): 757-762. Wang D, Qiu R, Pan YX, et al. Construction of 1-year-old child voxel phantom based on CT image of physical phantom[J]. At Energy Sci Technol, 2016, 50(4): 757-762. DOI:10.7538/yzk.2016.50.04.0757 |
| [40] |
任丽, 邱睿, 武祯, 等. 基于中国参考人的典型CT扫描患者剂量模拟与分析[J]. 中华放射医学与防护杂志, 2018, 38(12): 942-948. Ren L, Qiu R, Wu Z, et al. Simulation and analysis of CT examination doses to typical patients based on Chinese reference human phantoms[J]. Chin J Radiol Med Prot, 2018, 38(12): 942-948. DOI:10.3760/cma.j.issn.0254-5098.2018.12.011 |
| [41] |
Mazonakis M, Tzedakis A, Damilakis J, et al. Thyroid dose from common head and neck CT examinations in children: is there an excess risk for thyroid cancer induction[J]. Eur Radiol, 2007, 17(5): 1352-1357. DOI:10.1007/s00330-006-0417-9 |
| [42] |
Tzedakis A, Damilakis J, Perisinakis K, et al. The effect of Z overscanning on patient effective dose from multidetector helical computed tomography examinations[J]. Med Phys, 2005, 32(6): 1621-1629. DOI:10.1118/1.1924309 |
| [43] |
Li X, Segars WP, Samei E. The impact on CT dose of the variability in tube current modulation technology: a theoretical investigation[J]. Phys Med Biol, 2014, 59(16): 4525-4548. DOI:10.1088/0031-9155/59/16/4525 |
| [44] |
Mcmillan K, Bostani M, Cagnon CH, et al. Estimating patient dose from CT exams that use automatic exposure control: development and validation of methods to accurately estimate tube current values[J]. Med Phys, 2017, 44(8): 4262-4275. DOI:10.1002/mp.12314 |




