2. 军事科学院军事医学研究院辐射医学研究所,北京市放射生物学重点实验室,北京 100850;
3. 河北大学生命科学学院,河北 保定 071002
2. Institute of Radiation Medicine, Academy of Military Medicine, Academy of Military Sciences, Beijing Key Laboratory of Radiobiology, Beijing 100850 China;
3. College of Life Sciences, Hebei University, Baoding 071002 China
放射治疗是胸部恶性肿瘤的主要治疗手段,在接受放射治疗的患者中,有10%~30%会出现放射性肺损伤(主要包括放射性肺炎、放射性肺纤维化两阶段)[1-2]。放射性肺损伤发病机制复杂[3],目前认为其发病机制涉及肺组织中多种驻留细胞、被招募的免疫细胞以及多种细胞因子[4]。
北京市放射生物学重点实验室利用60Co γ射线单次20 Gy胸部照射小鼠建立的放射性肺纤维化实验动物模型,对调节性T淋巴细胞(Treg)、转化生长因子(TGF)等介导放射性肺纤维化的作用与损伤机制进行了系统研究[5-6],进一步对放射性肺纤维化早期免疫反应及机制研究时发现,60Co γ射线单次20 Gy胸部照射C57BL/6小鼠后15 d内,肺组织中炎性反应明显异常,主要表现在T细胞及其亚群呈现不同时相的增高或降低[7-8]。已证实,T细胞活化是增殖、分化为效应细胞和细胞因子表达的先决条件,依赖多种转录因子和共表达分子,其中最基本的是抗原呈递细胞(如DC细胞)上的抗原肽-MHC复合体特异性识别并结合T细胞受体(TCR),并在抗原提呈细胞表面产生共刺激信号,如CD80、CD86等[9-10]。为探明放射性肺损伤早期炎性反应及细胞免疫机制,本研究通过小鼠肺上皮细胞、骨髓DC细胞和脾脏T细胞共培养模拟肺部微环境中辐射损伤细胞的抗原提呈反应过程,检测照射的肺上皮细胞对DC和T细胞的影响,探索DC细胞的抗原提呈及其对T细胞的活化作用与机制,为放射性肺损伤的防治新措施研究提供实验依据。
1 材料与方法 1.1 实验材料RPMI 1640培养基、胎牛血清(美国Gibco公司),CD11C-APC-Cy7抗体、H-2Kb-Alexa 647抗体、I-A/I-E-FITC抗体、CD80-PerCP-Cy5.5抗体、CD86-PE-Cy7抗体、CD3e-FITC抗体、CD4-PE-Cy7抗体、CD8α-PerCP抗体、CD16/32抗体、CD28-PE抗体、CD152-APC抗体、红细胞裂解液(美国BD公司),CD69-BV421抗体(美国Biolegend公司),Annexin V-FITC/PI凋亡试剂盒(北京索莱宝公司),钴源(60Co,英国维瑞斯公司),流式细胞仪(BD FACS Calibur,美国BD公司)。
1.2 实验动物与饲养SPF级雄性C57BL/6小鼠,6~8周龄、体重(20 ± 2)g,购于北京维通利华生物科技有限公司[动物许可证号:SCXK(京)2021-0006],饲养于军事科学院军事医学研究院实验动物中心,饲养环境:温度:22~26℃,相对湿度:50%~70%,每12 h明暗交替照明。
1.3 实验细胞与培养小鼠肺上皮细胞(MLE-12)购自ATCC,细胞为本实验室所存。MLE-12细胞用RPMI 1640完全培养基(含10%血清)进行培养,置37℃,5% CO2的恒温细胞培养箱中培养。当细胞密度达到80%~90%时,用0.25%的胰酶消化,按照实验要求细胞数进行接种或传代。将接种后MLE-12细胞随机分为对照组、照射组。
1.4 细胞照射利用军事医学研究院辐射医学研究所钴源辐照装置进行60Co γ射线照射。将细胞置于照射室,与放射源距离3 m处,照射剂量率67.45 cGy/min,分别照射2∶58、5∶56、8∶54、11∶52(min:s),即照射剂量为2 Gy、4 Gy、6 Gy、8 Gy,同时对照组进行假照射。照射后各组更换新培养液继续培养。
1.5 小鼠骨髓DC细胞制备及诱导分化小鼠安乐死后,取出两侧胫骨和股骨,酒精浸泡2 min,用RPMI 1640培养基冲洗干净,剪去两端骨骺,用RPMI 1640培养基冲洗骨髓腔2~3次,合并冲洗液,过200目筛网后,离心(1 500 rpm/min,5 min),收集细胞,用含GM-CSF、IL-4的RPMI 1640培养基培养,3 d后换液1次,7 d后进行共培养实验。
1.6 小鼠脾脏T淋巴细胞制备小鼠安乐死后,取出小鼠脾脏,置于尼龙布袋,用涂布棒轻柔碾碎制成单细胞悬液,经200目过筛后离心(1 500 rpm/min,5 min),收集细胞加入红细胞裂解液,3 min后离心(1 500 rpm/min,5 min),用PBS溶液洗2~3次,培养30 min去掉贴壁的巨噬细胞等,上层液离心(1 500 rpm/min,5 min),收集细胞(T淋巴细胞)用于共培养。
1.7 细胞共培养照射后的MLE-12细胞调整至4×105/mL,分别与2×105/mL的DC细胞和/或1×106/mL脾淋巴细胞置于细胞培养箱中的摇床(40 rpm/min)上共培养,48 h 后进行DC细胞和/或T细胞活化指标检测。
1.8 细胞凋亡检测将受试细胞浓度调整为(5~10)×105/mL,取100 μL,加入5 μL Annexin V/FITC抗体,混匀,室温避光孵育,5 min后加入5 μL碘化丙啶溶液和400 μL PBS,混匀后上流式细胞仪检测。
1.9 DC细胞、T细胞表面标志分子检测共培养细胞离心(1 500 rpm/min,5 min)去上清,加入CD16/32抗体,室温孵育 15 min后,分别加入不同的细胞表面标志分子检测抗体,室温孵育30 min。其中用于DC细胞表面标志分子检测的抗体包括CD11C-APC-Cy7、H-2Kb-Alexa 647、I-A/I-E-FITC、CD80-PerCP-Cy5.5、CD86-PE-Cy7等,用于T细胞表面标志分子检测的抗体包括CD3e-FITC、CD4-PE-Cy7、CD8α-PerCP、CD69-BV421等。抗体标记的细胞经PBS洗涤2~3次后,进行固定(2%多聚甲醛,30 min),最后用PBS清洗干净后上流式细胞仪检测。
1.10 统计学分析采用SPSS 22.0软件进行统计学分析,实验数据符合正态分布,组间比较采用方差分析(方差齐),检验水准α = 0.05。
2 结 果 2.1 60Co γ射线对MLE-12细胞的凋亡影响60Co γ射线(剂量分别为0 Gy、2 Gy、4 Gy、6 Gy、8 Gy)照射MLE-12细胞,48 h 后细胞凋亡检测结果见图1。照射后细胞凋亡率显著增高(P < 0.01),并呈现明显剂量反应关系,表明照射对MLE-12有明显损伤作用。

|
图 1 不同剂量60Co γ射线诱发小鼠肺上皮细胞(MLE-12)凋亡(n = 3) Figure 1 Apoptosis of MLE-12 cells induced by different doses of 60Co γ-rays (n = 3) 注:A为流式细胞术检测细胞凋亡的代表性散点图;B为细胞凋亡率的剂量-效应曲线;**与假照射对照细胞比较,P < 0.01 |
60Co γ射线(剂量分别为0 Gy、2 Gy、4 Gy、6 Gy、8 Gy)照射的MLE-12细胞与DC细胞共培养48 h后,分别检测DC细胞共刺激因子CD80、CD86和抗原提呈相关分子MHCI、MHCII的表达,结果如图2,其中各点数据为照射细胞与假照射对照细胞测定结果的比值,除MHCI外,照射的MLE-12细胞可诱发DC细胞MHCII、CD80及CD86表达量明显增高(P < 0.05),并呈现明显的剂量效应关系,表明照射损伤细胞对DC细胞抗原提呈能力有明显刺激作用。

|
图 2 60Co γ射线照射的MLE-12对DC活化功能的影响(n = 3) Figure 2 Activation of dendritic cells in the presence of MLE-12 cells irradiated with60Co γ-rays (n = 3) 注:与假照射对照细胞比较:*, P < 0.05;**,P < 0.01 |
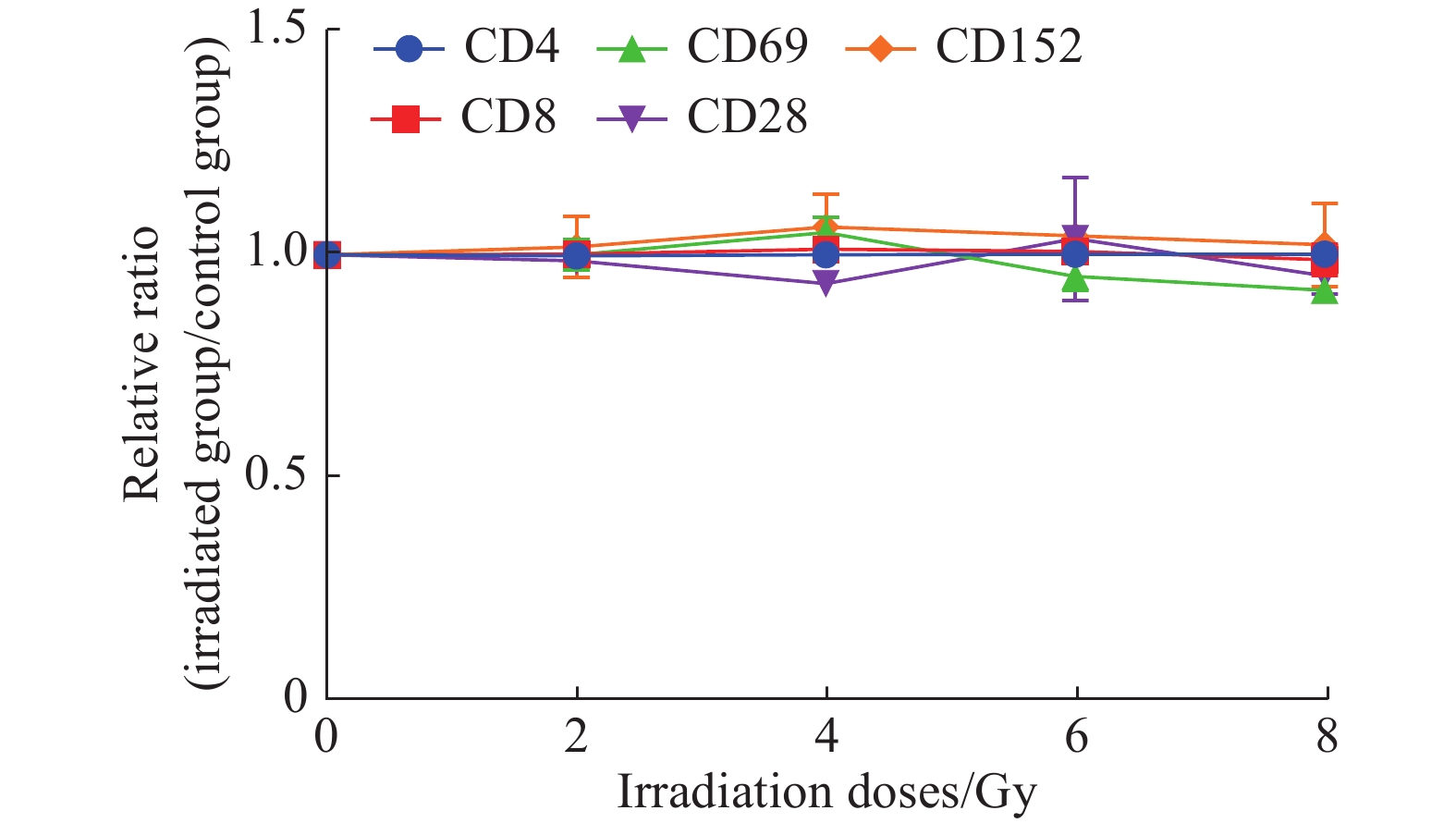
60Co γ射线(剂量分别为0 Gy、2 Gy、4 Gy、6 Gy、8 Gy)照射的MLE-12细胞与脾淋巴细胞共培养48 h,分别检测T细胞表面活化相关分子CD69、CD28、C152表达水平及其CD4+和CD8+亚群细胞数量,结果见表1。将不同剂量照射的MLE-12细胞测量数据换算为与假照射(0 Gy)细胞的比值,结果如图3。所有观测指标均无明显变化,表明辐射损伤的肺上皮细胞对T细胞无直接活化作用。
|
|
表 1 不同剂量60Co γ射线照射的MLE-12对T细胞及其亚群的活化作用(
|
|
图 3 不同剂量60Co γ射线照射的MLE-12对T细胞及其亚群的活化作用(
|
将6 Gy 60Co γ射线照射的MLE-12细胞与DC细胞、脾淋巴细胞共培养,模拟肺部照射后的微环境,观察辐射损伤肺上皮细胞对DC细胞和T细胞活化的影响,通过与上述两细胞培养结果比较,阐明DC细胞在介导辐射损伤细胞的抗原提呈及T细胞活化中的作用与机制。
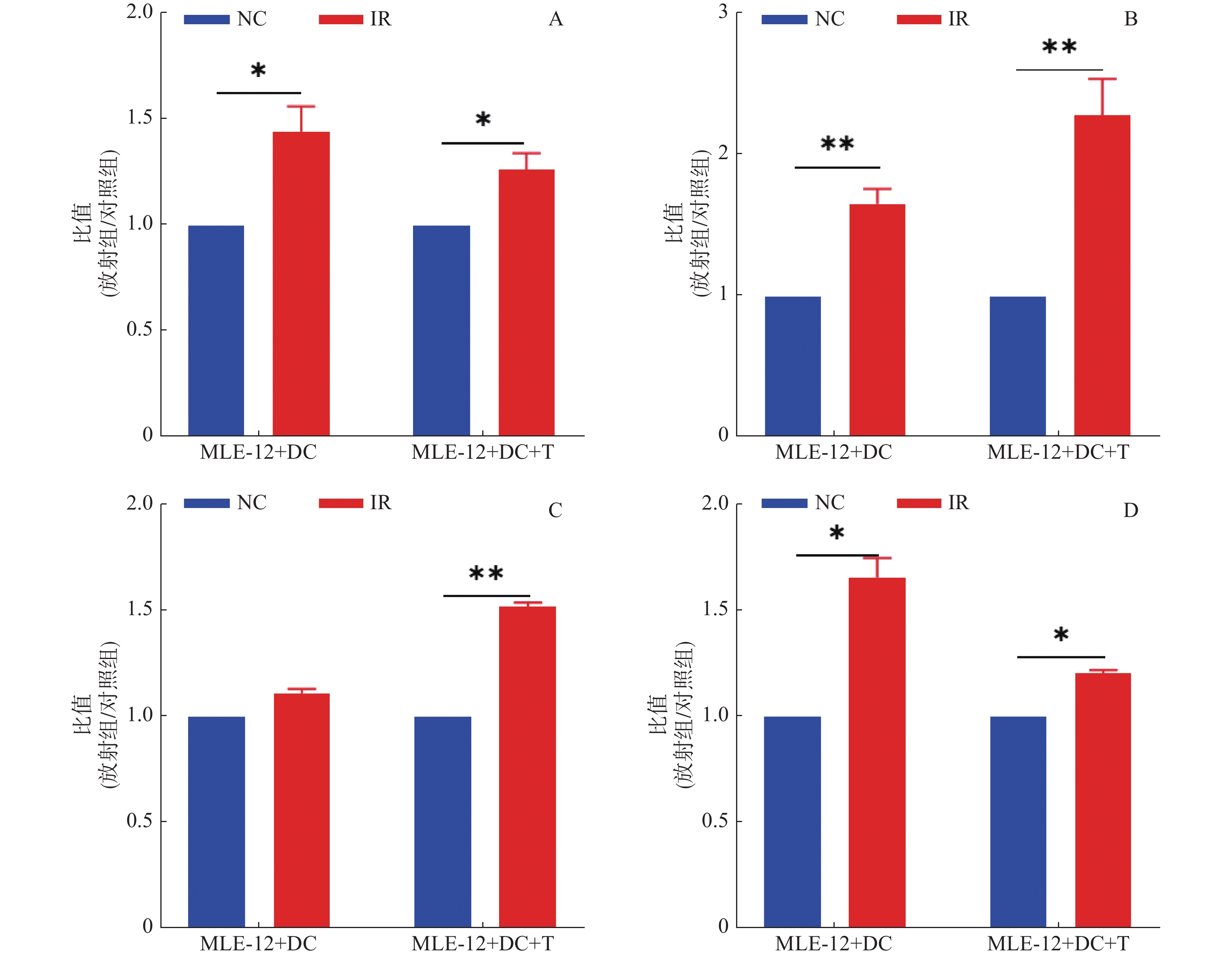
2.4.1 DC细胞功能6 Gy60Co γ射线照射的MLE-12细胞与DC细胞、脾淋巴细胞共培养48 h后,分别检测DC细胞共刺激因子CD80、CD86和抗原提呈相关分子MHCI、MHCII的表达,并与同条件下MLE-12细胞(6 Gy照射)和DC细胞两细胞培养(48 h)结果比较,结果见表2。将两细胞和三细胞共培养条件下照射组DC细胞的测量数据换算为与假照射(0 Gy)细胞的比值,结果如图4。与照射损伤的MLE-12细胞单独作用DC细胞导致MHCII、CD80及CD86增高的结果不同,在T细胞存在下,DC细胞出现CD86和MHCI的特异性表达增高(P < 0.01),表明其在介导辐射损伤抗原提呈及T细胞活化方面可能发挥重要作用。
|
|
表 2 细胞存在和不存在情况下60Co γ射线照射(6 Gy)的MLE-12对DC活化功能的影响(
|
|
图 4 T细胞存在和不存在情况下60Co γ射线照射(6 Gy)的MLE-12对DC活化功能影响的比较(n = 3) Figure 4 Effects of 60Co γ (6 Gy)-irradiated MLE-12 cells on the activation of dendritic cells in the presence and absence of T cells (n = 3) 注:A为DC表面共刺激分子CD80;B为DC表面共刺激分子CD86;C为DC表面抗原提呈相关分子MHC I;D为DC表面抗原提呈相关分子 MHC II;与对照组相比,*:P < 0.05;**: P < 0.01 |
6 Gy 60Co γ射线照射的MLE-12细胞与DC细胞、脾淋巴细胞共培养48h后,分别检测T细胞表面活化相关分子CD69、CD28、C152表达及其CD4+和CD8+亚群数量,结果见表3。与照射损伤的MLE-12细胞单独作用对T淋巴细胞无直接活化作用的结果不同,DC细胞存在时,CD4+和CD8+亚群细胞数均明显增高(P < 0.01),CD69和CD28表达也明显增加( P < 0.05),T细胞处于明显活化状态,提示辐射损伤细胞对T细胞有间接活化作用,其中DC的抗原提呈可能起关键作用。
|
|
表 3 DC介导下60Co γ射线照射(6 Gy)的MLE-12对T细胞及其亚群的活化作用(
|
免疫应答在放射性肺损伤中起着重要作用,其中以T淋巴细胞介导的免疫反应为主[11],而抗原提呈是T细胞激活的关键[12]。树突状细胞是一种专职性抗原提呈细胞,能够激活初始T细胞,启动适应性免疫[13]。研究表明放射治疗可以增加DC成熟和抗原提呈能力从而增强抗肿瘤免疫作用[14],但相关作用及机制并不清楚。本研究通过小鼠肺上皮细胞、骨髓DC细胞和脾脏T细胞共培养模拟肺部微环境中辐射损伤细胞的抗原提呈反应过程,检测照射的肺上皮细胞对DC和T细胞的影响,探索DC细胞的抗原提呈及其对T细胞的活化作用与机制,结果发现,60Co γ射线照射的MLE-12细胞对T细胞无直接活化作用,但在DC细胞存在时,T细胞CD69和CD28表达增加,CD4+和CD8+亚群细胞数均明显高于对照组,同时DC细胞出现CD86和MHCI特异性高表达,表明T细胞处于明显活化状态,而其中DC的抗原提呈起关键作用。提示辐射损伤细胞可刺激DC细胞抗原提呈功能,并对T细胞进行活化。
DC捕获抗原后,通过表达CD80/86等趋化受体,分泌细胞因子和趋化因子,将抗原呈递给抗原特异性T细胞[15],其中组织相容性复合分子(MHC)具有启动幼稚T细胞的独特能力,被认为是参与抗原提呈和T细胞激活的关键分子。有研究表明,炎症刺激后,DC成熟,导致CD86表达增加和更高水平的抗原刺激[16],与本研究发现照射后的MLE-12细胞可导致DC表面出现CD86的特异性表达增高一致。此外,DC可通过MHC分子递呈特异性抗原,有研究表明,CD4+T细胞可与DC表面MHC Ⅱ结合后作用于CD8+T细胞[17],表明DC实现呈递抗原可通过MHC Ⅱ类进行交叉呈递,放射治疗在刺激免疫原性较差的组织时也可增加MHC I并呈递相关抗原,进而产生更强大的免疫反应[18-19]。本研究结果发现,MLE-12与DC、脾淋巴细胞共培养,DC细胞出现MHCI的特异性高表达,T细胞亚群,特别是CD8+细胞数明显增高,提示辐射损伤细胞可能主要通过刺激DC细胞特异性提呈活化CD8+T细胞。
TCR与抗原/MHC蛋白结合时,必须同时结合T细胞表面的CD28/CD152与抗原提呈细胞上的协同刺激分子CD80/CD86,以避免T细胞失能,并为T细胞激活提供必要信号[20]。CD69为T细胞活化后最早表达的分子[21],CD28和CD152在T细胞刺激中具有关键而相反的作用,但它们共有2种配体,即CD80、CD86,CD28可增强T细胞活化,但CD152的功能并未完全探明,主要认为其可能提供抑制信号[22]。研究表明,CD28与炎症介质、凋亡相关蛋白、免疫抑制和肿瘤发生相关,CD28缺乏可对肺损伤起保护作用,可能与PI3K/Akt/FoxO1信号通路有关[23]。本研究发现辐射损伤细胞可通过DC促进T细胞表面CD69和CD28表达增加,表明DC可促进T细胞活化增殖,提示抑制CD28表达可能对辐射引起的损伤起保护作用,具体机制需进一步研究。
综上所述,本研究通过细胞共培养,发现辐射损伤肺上皮细胞促进DC成熟并增强其抗原提呈能力,并阐明DC主要通过CD86、MHC I途径活化T细胞。本研究为放射性肺损伤的免疫机制研究提供了实验线索,并证实所建立的三细胞共培养体系能较好模拟照射后肺部的抗原提呈过程,为放射性肺损伤机制研究提供了新的研究手段。
| [1] |
Beach TA, Groves AM, Williams JP, et al. Modeling radiation-induced lung injury: lessons learned from whole thorax irradiation[J]. Int J Radiat Biol, 2020, 96(1): 129-144. DOI:10.1080/09553002.2018.1532619 |
| [2] |
Xia CC, Shi WY, Zhang YY, et al. Prevention and treatment of radiation-induced lung injury[J]. Future Med Chem, 2020, 12(23): 2161-2173. DOI:10.4155/fmc-2019-0162 |
| [3] |
陈家祯, 王玉, 王存良, 等. 放射性肺损伤发病机制及分子靶向治疗研究进展[J]. 中国辐射卫生, 2021, 30(3): 377-380,390. Chen JZ, Wang Y, Wang CL, et al. Research progress on pathogenesis and molecular targeted therapy of radiation-induced lung injury[J]. Chin J Radiol Health, 2021, 30(3): 377-380,390. DOI:10.13491/j.issn.1004-714X.2021.03.023 |
| [4] |
Weichselbaum RR, Liang H, Deng LF, et al. Radiotherapy and immunotherapy: a beneficial liaison[J]. Nat Rev Clin Oncol, 2017, 14(6): 365-379. DOI:10.1038/nrclinonc.2016.211 |
| [5] |
Xiong SS, Pan XJ, Xu L, et al. Regulatory T cells promote β-catenin-mediated epithelium-to-mesenchyme transition during radiation-induced pulmonary fibrosis[J]. Int J Radiat Oncol Biol Phys, 2015, 93(2): 425-435. DOI:10.1016/j.ijrobp.2015.05.043 |
| [6] |
Xu L, Xiong SS, Guo RF, et al. Transforming growth factor β3 attenuates the development of radiation-induced pulmonary fibrosis in mice by decreasing fibrocyte recruitment and regulating IFN-γ/IL-4 balance[J]. Immunol Lett, 2014, 162(1): 27-33. DOI:10.1016/j.imlet.2014.06.010 |
| [7] |
孙泽文, 梁鑫, 郗停停, 等. 辐射诱导树突状细胞促进Treg分化及肺上皮间充质转化[J]. 军事医学, 2018, 42(7): 502-506. Sun ZW, Liang X, Xi TT, et al. Radiation activates Tregs through dendritic cells and promotes lung epithelial-mesenchymal transition[J]. Mil Med Sci, 2018, 42(7): 502-506. DOI:10.7644/j.issn.1674-9960.2018.07.006 |
| [8] |
郗停停, 耿爽, 孙泽文, 等. γ射线胸部照射小鼠早期肺组织的免疫细胞反应[J]. 国际放射医学核医学杂志, 2020, 44(5): 286-290. Xi TT, Geng S, Sun ZW, et al. Early response of immune-related T cells in the lung tissue of mice exposed to gamma rays in the chest[J]. Int J Radiati Med Nucl Med, 2020, 44(5): 286-290. DOI:10.3760/cma.j.cn121381-202003038-00025 |
| [9] |
Simeoni L, Bogeski I. Redox regulation of T-cell receptor signaling[J]. Biol Chem, 2015, 396(5): 555-569. DOI:10.1515/hsz-2014-0312 |
| [10] |
Courtney AH, Lo WL, Weiss A. TCR signaling: mechanisms of initiation and propagation[J]. Trends Biochem Sci, 2018, 43(2): 108-123. DOI:10.1016/j.tibs.2017.11.008 |
| [11] |
Lee Y, Auh SL, Wang YG, et al. Therapeutic effects of ablative radiation on local tumor require CD8+ T cells: changing strategies for cancer treatment
[J]. Blood, 2009, 114(3): 589-595. DOI:10.1182/blood-2009-02-206870 |
| [12] |
Santin AD, Hermonat PL, Ravaggi A, et al. Effects of retinoic acid combined with irradiation on the expression of major histocompatibility complex molecules and adhesion/costimulation molecules ICAM-1 in human cervical cancer[J]. Gynecol Oncol, 1998, 70(2): 195-201. DOI:10.1006/gyno.1998.5060 |
| [13] |
Geurtsvankessel CH, Willart MAM, Van Rijt LS, et al. Clearance of influenza virus from the lung depends on migratory langerin+CD11b− but not plasmacytoid dendritic cells
[J]. J Exp Med, 2008, 205(7): 1621-1634. DOI:10.1084/jem.20071365 |
| [14] |
Shahabi V, Postow MA, Tuck D, et al. Immune-priming of the tumor microenvironment by radiotherapy: rationale for combination with immunotherapy to improve anticancer efficacy[J]. Am J Clin Oncol, 2015, 38(1): 90-97. DOI:10.1097/COC.0b013e3182868ec8 |
| [15] |
Balan S, Saxena M, Bhardwaj N. Dendritic cell subsets and locations[J]. Int Rev Cell Mol Biol, 2019, 348: 1-68. DOI:10.1016/bs.ircmb.2019.07.004 |
| [16] |
Sansom DM, Manzotti CN, Zheng Y. What's the difference between CD80 and CD86?[J]. Trends Immunol, 2003, 24(6): 313-318. DOI:10.1016/s1471-4906(03)00111-x |
| [17] |
Huff WX, Kwon JH, Henriquez M, et al. The evolving role of CD8+CD28- immunosenescent T cells in cancer immunology
[J]. Int J Mol Sci, 2019, 20(11): 2810. DOI:10.3390/ijms20112810 |
| [18] |
Karam SD, Raben D. Radioimmunotherapy for the treatment of head and neck cancer[J]. Lancet Oncol, 2019, 20(8): e404-e416. DOI:10.1016/S1470-2045(19)30306-7 |
| [19] |
Hatfield P, Merrick A, Harrington K, et al. Radiation-induced cell death and dendritic cells: potential for cancer immunotherapy[J]. Clin Oncol, 2005, 17(1): 1-11. DOI:10.1016/j.clon.2004.06.014 |
| [20] |
Van Coillie S, Wiernicki B, Xu J. Molecular and cellular functions of CTLA-4[J]. Adv Exp Med Biol, 2020, 1248: 7-32. DOI:10.1007/978-981-15-3266-5_2 |
| [21] |
Cibrián D, Sánchez-Madrid F. CD69: from activation marker to metabolic gatekeeper[J]. Eur J Immunol, 2017, 47(6): 946-953. DOI:10.1002/eji.201646837 |
| [22] |
Silveira DA, Ribeiro FM, Simão ÉM, et al. Expression of genes and pathways associated with the B7-CD28 superfamily in response to irradiation of blood cells using 137Cs
[J]. Int J Radiat Biol, 2021, 97(2): 149-155. DOI:10.1080/09553002.2021.1857454 |
| [23] |
Liu YN, Tong CC, Xu Y, et al. CD28 deficiency ameliorates blast exposure-induced lung inflammation, oxidative stress, apoptosis, and T cell accumulation in the lungs via the PI3K/Akt/FoxO1 signaling pathway[J]. Oxid Med Cell Longev, 2019, 2019: 4848560. DOI:10.1155/2019/4848560 |




