2. 徐州市肿瘤医院放疗科,江苏 徐州 221005
2. Department of Radiotherapy, Xuzhou Cancer Hospital , Xuzhou 221005 China
放射治疗是治疗恶性肿瘤三大手段(手术、化疗、放射治疗)之一[1]。调强放射治疗(Intensity Modulated Radiotherapy,IMRT)已成为现代放射治疗的主流技术[2-3]。国际辐射单位与测量委员会(International Commission on Radiation Units and Measurements, ICRU)关于放射治疗剂量学标准的报告中,明确规定了从放射治疗设备的输出剂量到患者吸收剂量的测量方法与标准,以及放射治疗的治疗评估标准等[4]。剂量验证是通过技术手段收集医用直线加速器(Linear Accelerator, LA)实际出束时的机器跳数(MU)、MLC位置等数据,与放射治疗计划系统(Treatment Planning System, TPS)的物理参数进行比较,通过专用软件分析两者误差值,以判断是否可为患者实施此放疗计划[5-6]。目前常用的剂量验证模体有均匀模体(水箱、固体水模),非均匀模体(仿真模体等);由于固体水是与水密度相等的一种固体物质,且是平整、规则的,而人体是由各种密度不同的器官组成,外形也是凹凸不规则[7],治疗计划系统中要考虑密度修正,TMR修正、曲面修正等。因此使用非均匀模体测量治疗计划剂量更接近临床应用,是一种综合性的测量方法[8]。本文通过对自制非均匀模体的实验研究,以求自制的非均匀模体可达到临床应用的精度要求。
1 材料与方法 1.1 样本选取与一般资料选取本科室2022年实施动态调强放疗的肺癌患者,采用单纯随机抽样方法选取10例,其中男7例,女3例,年龄55~74岁,年龄中位数66岁。参考ICRU83号报告[9]由副主任以上医师勾画并确认原发肿瘤区(GTV)、转移淋巴结肿瘤区(GTVnd)、亚临床病灶及高危淋巴引流区(CTV)和正常组织,根据上述靶区外扩0.5 cm得到计划靶区(PTV)。
1.2 设备与软件配置Monaco5.11 TPS,160片0.5 cm厚度多叶光栅的Axesse型医用直线加速器(医科达,瑞典);配置1527个二极管,探测器间距7.07 mm的二维半导体探测器阵列(MapCheck2,Sun Nuclear,美国);UNIDOSE剂量仪;SNC Patient分析软件(Sun Nuclear,美国);PTW的RW3固体水,80 cm大孔径定位CT(Philips, 荷兰)和自制的非均匀模体(20 cm × 20 cm × 10 cm)。
1.3 模体制作具体实施步骤①将石蜡熔化(熔点62°),倒入有机玻璃盒内;②将石蜡与石膏按质量10∶3配比,熔化成混合物凝固后制作出骨组织模型;③将石蜡与聚乙烯泡沫粉末按质量4∶10配比,熔化成混合物凝固后制作出等效肺部模型;④上述材料依次浇铸后,放入聚乙烯泡沫板(尺寸15 cm×15 cm×3 cm),周围浇铸石蜡与石膏粉10∶1混合物;⑤将熔化的石蜡倒入2只杯子,冷却定型后取出依次放置即完成模体制作。
1.4 MapCheck标定二维矩阵若要实现绝对剂量比对,需要对矩阵进行绝对剂量修正。矩阵等中心摆位,在10 × 10射野,100 MU条件下出束后将其接收到的实际剂量定义为100 cGy即完成绝对剂量校准。将射野中心轴内最大剂量点设为剂量归一点,即完成相对剂量归一。
1.5 计划设计与剂量验证①将MapCheck上面放置制作完成的模体,使用BigboreCT扫描定位。扫描条件:管电压120 kV,电流280 mAs,螺距0.3,层厚3 mm,扫描层数195层,轴向扫描,矩阵512 × 512。将在此条件下获得的DICOM图像数据传输到Monaco。②选择10组肺癌调强计划,分别用该模体创建QA验证文件,命名为“编号+PhantomQA”。按定位时相同的条件将模体摆放在加速器下,分别打开②中10组调强计划,机架角度归零出束后记录测量值,命名为“编号+Phantom”。③将①中的模体替换成固体水,按同样的定位条件采集数据,并按②中操作得到验证文件“编号+WaterQA”和二维矩阵测量值“编号+Water”。④在SNC Patient 软件中将10组“编号+Phantom”和“编号+Water”比较,分析自制模体与现有固体水模体的剂量特点;将10组“编号+PhantomQA”和“编号+Phantom”进行
数据采用IBMSPSS 21.0进行配对样本t检验,结果以
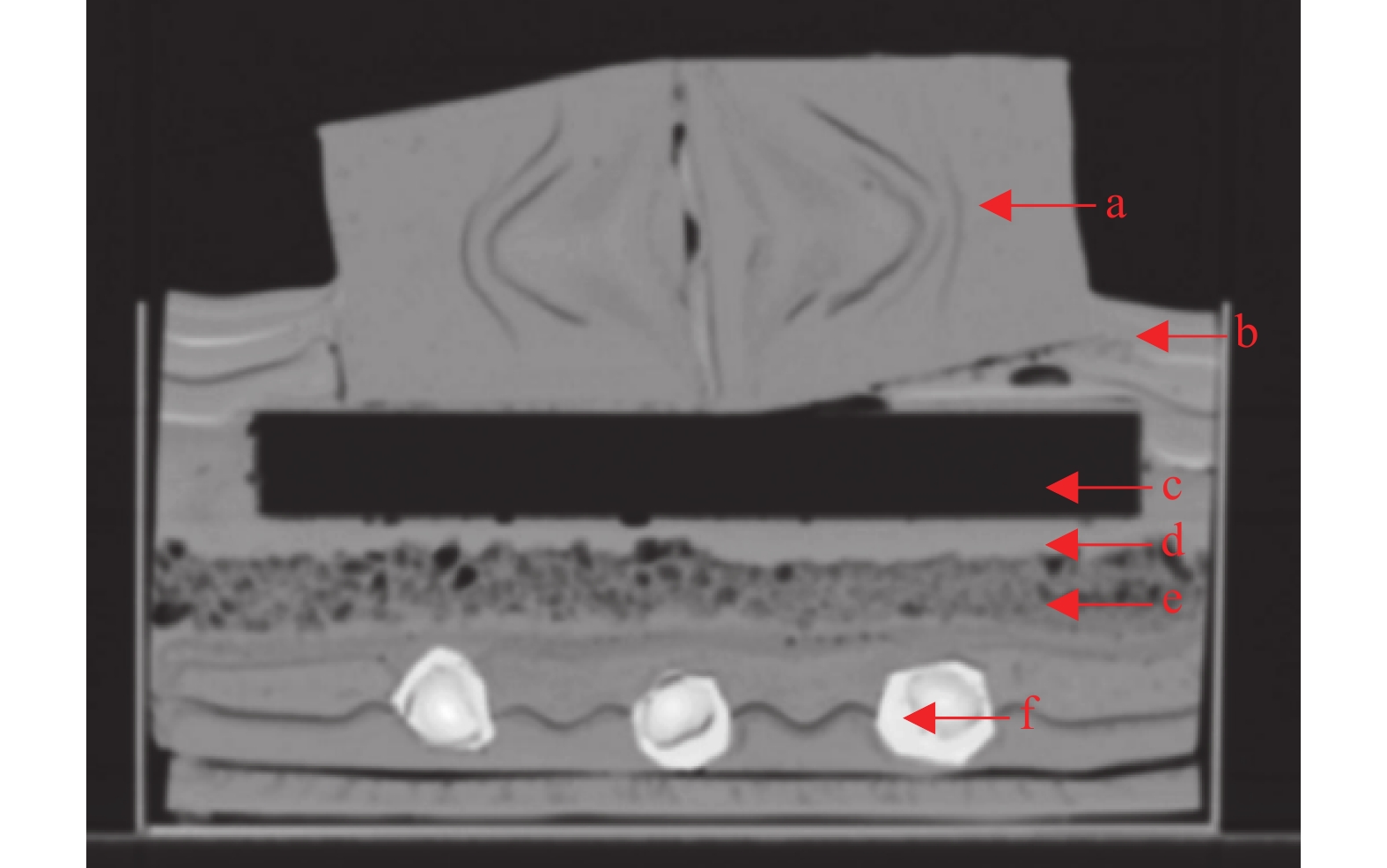
模体主要结构分为3部分:①等效肺组织,其CT值设计为−800~−1000 HU;②等效人体软组织的外轮廓,其CT值设计为40~90 HU;③等效脊柱骨组织,CT值设计要求 > 600 HU。
根据放射物理学组织等效原理,以石蜡、石膏粉、聚乙烯泡沫板为基础材料[10],通过不断的实验配比,最终确定了适用于本文的对应骨骼、肺脏、空腔、皮肤和软组织的组织辐射等效材料,制作并模拟出与人体各器官CT值一致、有曲面的剂量验证模体,具有内部结构仿真性、组织辐射等效性等特点[11],如图1。其中,骨骼等效材料由石蜡与石膏混合得到,肺部组织等效材料由聚乙烯泡沫与石蜡混合得到,人体空腔的等效材料由聚乙烯泡沫制作,软组织的等效材料由石蜡制作。经测试这些材料的CT值与人体相应组织CT值相符,见表1。
|
图 1 自制模体的剖面图 Figure 1 Cross-section of homemade phantom |
|
|
表 1 自制模体的组织辐射等效材料CT值 Table 1 CT values of tissue-equivalent materials in homemade phantom |
图2是将10组“编号+Phantom”和“编号 + Water”比较,由图2可看出,10组计划中使用本文提出的模体在中心轴(CAX)和归一点(Norm)上得到的测量值均是比在固体水模体得到的测量值要大,最小偏差为8.3%,最大偏差为11.5%。这是因为在非均匀介质中发生了更广泛的射线反应,造成射程变短,需要更多的粒子加入才能达到相同的目标剂量[12]。

|
图 2 2种模体中实际测量值的剂量学对比 Figure 2 Dosimetry comparison of measured values in two phantoms |
使用2种模体进行剂量验证的QA结果如表2。10组自制模体验证结果中
|
|
表 2 使用2种模体的10例肺癌放疗计划的QA结果 Table 2 QA results of 10 cases of lung cancer radiotherapy planning in two phantoms |
在相同比对标准下,使用2种模体进行剂量验证的
|
|
表 3 10例肺癌放疗计划在2种模体中剂量验证
|
本文制作的辐射模体具有内部无大气腔、摆位重复性高的特点,其使用市场上易购得的材料仿真人体器官,模拟人体不同器官物理密度及曲度,以便更有效的模拟胸部辐射衰减。经CT测量,聚乙烯、聚乙烯石蜡混合物、固体水、石蜡石膏混合物的CT值分别是−1000~−860 HU、−900~−170 HU、0 HU、400~1000 HU,分别等效于人体气腔、肺脏、软组织、骨组织等。该模体可应用于验证TPS算法在非均匀组织中的计算精度[13];测量靶区和组织器官的受照剂量,为研究X射线在人体器官内的能量沉积分布规律、放射治疗中精确剂量控制、放疗计划的设计及放射治疗质量保证研究提供参考[14-15]。
调强放疗剂量验证工作的流程是将TPS上优化的计划移植到剂量验证模体上,生成一个验证计划,然后将剂量验证模体置于LA下,按验证计划设置的条件对其进行辐照,生成剂量曲线(Profile),然后与TPS的剂量进行比对[16],按照美国医学物理学家协会(AAPM)53号报告评价γ通过率(3 mm/3%)应大于90%,否则该计划不能实施治疗[17]。目前剂量验证主要是使用二维验证和三维验证[16]。使用ArcCheck验证的是一个曲面的剂量,缺乏对实际剂量点在空间上的充分验证[18]。本文采用二维剂量验证方式,该方法虽缺乏对剂量点空间分布的验证,但是在验证单角度的多叶光栅的准确性和平面剂量的准确性上有优势,符合本文的实验要求。
本文分别使用自制模体和固体水模体对放疗计划进行剂量验证,在自制模体中的实际测量值比在固体水中的测量值大,最大偏差是11.5%。单独使用自制模体对10例肺癌放疗计划进行剂量验证结果表明,靶区中心剂量验证的3 mm/3%的γ通过率值均大于90%,AD、RD的平均γ通过率为(98.45 ± 1.39)%、(99.41 ± 0.66)%。与固体水模体相比,使用自制模体的剂量验证平均
本文提出的材料配比新颖,制作工艺简便,易于保存,值得在实际应用中进一步推广。但在使用过程中需要注意以下2点:一是本文制作的模体面积较小,不能满足大面积调强计划的验证需要,否则会因为射线未途经模体直接到达探头而造成失真,计算误差会偏大,因此应避免选用面积较大的计划(如乳腺、全脑全脊髓、全骨盆等)进行剂量测定;二是使用二维验证需要把所有机架角度归零,忽略了重力对多叶光栅位置精度的影响,治疗床对剂量分布的影响等[19]。接下来本文将对测量方法进一步优化,在各个模拟器官中插入电离室,测量各器官的实际能量沉积。
综上所述,本模体符合临床的精度要求,可为放射治疗中精确剂量控制、调强计划的剂量验证及放射治疗质量保证研究提供基础和参考。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
黄伟, 张延可, 朱健, 等. 中国放射肿瘤学33年发展回顾与展望[J]. 国际肿瘤学杂志, 2020, 47(1): 1-9. Huang W, Zhang YK, Zhu J, et al. Review and prospect of the 33-year development of radiation oncology in China[J]. J Int Oncol, 2020, 47(1): 1-9. DOI:10.3760/cma.j.issn.1673-422X.2020.01.001 |
| [3] |
Tino R, Leary M, Yeo A, et al. Additive manufacturing in radiation oncology: a review of clinical practice, emerging trends and research opportunities[J]. Int J Extrem Manuf, 2020, 2(1): 012003. DOI:10.1088/2631-7990/ab70af |
| [4] |
Czarnecki D, Poppe B, Zink K. Impact of new ICRU Report 90 recommendations on calculated correction factors for reference dosimetry[J]. Phys Med Biol, 2018, 63(15): 155015. DOI:10.1088/1361-6560/aad148 |
| [5] |
Diamantopoulos S, Platoni K, Patatoukas G, et al. Treatment plan verification: a review on the comparison of dose distributions[J]. Phys Med, 2019, 67: 107-115. DOI:10.1016/j.ejmp.2019.10.029 |
| [6] |
洪君, 韩济华, 张艳, 等. 不同空腔厚度模体对上段食管癌剂量验证的影响[J]. 中国辐射卫生, 2021, 30(3): 282-287,302. Hong J, Han JH, Zhang Y, et al. Effect of phantoms with different cavity thickness on dose verification upper esophageal cancer[J]. Chin J Radiol Health, 2021, 30(3): 282-287,302. DOI:10.13491/j.issn.1004-714X.2021.03.007 |
| [7] |
Oborn BM, Gargett MA, Causer TJ, et al. Experimental verification of dose enhancement effects in a lung phantom from inline magnetic fields[J]. Radiother Oncol, 2017, 125(3): 433-438. DOI:10.1016/j.radonc.2017.09.012 |
| [8] |
卢峰, 陈英民, 宋钢, 等. 光子放疗靶区计划剂量验证的结果与分析[J]. 中国辐射卫生, 2019, 28(3): 267-270. Lu F, Chen YM, Song G, et al. Results and analysis of the target dose verification for photon radiotherapy[J]. Chin J Radiol Health, 2019, 28(3): 267-270. DOI:10.13491/j.issn.1004-714X.2019.03.013 |
| [9] |
Grégoire V, Mackie TR. State of the art on dose prescription, reporting and recording in Intensity-Modulated Radiation Therapy (ICRU report No. 83)[J]. Cancer/Radiothérapie, 2011, 15(6/7): 555-559. DOI:10.1016/j.canrad.2011.04.003 |
| [10] |
Bibb R, Thompson D, Winder J. Computed tomography characterisation of additive manufacturing materials[J]. Med Eng Phys, 2011, 33(5): 590-596. DOI:10.1016/j.medengphy.2010.12.015 |
| [11] |
彭刚, 曾勇明, 赵峰, 等. 中国人仿真胸部体模组织等效性的影像学研究[J]. 重庆医科大学学报, 2010, 35(7): 1060-1063. Peng G, Zeng YM, Zhao F, et al. Imaging study of tissue equivalence on Chinese anthropomorphic chest phantom[J]. J Chongqing Med Univ, 2010, 35(7): 1060-1063. DOI:10.13406/j.cnki.cyxb.2010.07.008 |
| [12] |
李乾坤, 傅玉川. 小射野条件下60Coγ射线及6-MV X射线在非均匀介质中的剂量特性研究
[J]. 辐射研究与辐射工艺学报, 2007, 25(1): 28-32. Li QK, Fu YC. Dosimetry perturbation in inhomogeneous phantoms with small beamlets of 60Co γ-rays and 6-MV photon beams [J]. J Radiat Res Radiat Process, 2007, 25(1): 28-32. DOI:10.3969/j.issn.1000-3436.2007.01.007 |
| [13] |
Shen ZW, Tan X, Li S, et al. Correlation between the γ passing rates of IMRT plans and the volumes of air cavities and bony structures in head and neck cancer[J]. Radiat Oncol, 2021, 16(1): 134. DOI:10.1186/s13014-021-01861-y |
| [14] |
van Hamersvelt RW, Willemink MJ, de Jong PA, et al. Feasibility and accuracy of dual-layer spectral detector computed tomography for quantification of gadolinium: a phantom study[J]. Eur Radiol, 2017, 27(9): 3677-3686. DOI:10.1007/s00330-017-4737-8 |
| [15] |
Brænne KR, Flinder LI, Martiniussen MA, et al. A liver phantom study: CT radiation dose reduction and different image reconstruction algorithms affect diagnostic quality[J]. J Comput Assist Tomogr, 2016, 40(5): 735-739. DOI:10.1097/RCT.0000000000000433 |
| [16] |
Onizuka R, Araki F, Ohno T. Monte Carlo dose verification of VMAT treatment plans using Elekta Agility 160-leaf MLC[J]. Phys Med, 2018, 51: 22-31. DOI:10.1016/j.ejmp.2018.06.003 |
| [17] |
Fraass B, Doppke K, Hunt M, et al. American association of physicists in medicine radiation therapy committee task group 53: quality assurance for clinical radiotherapy treatment planning[J]. Med Phys, 1998, 25(10): 1773-1829. DOI:10.1118/1.598373 |
| [18] |
张喜乐, 杨瑞杰, 李君, 等. 立体定向调强放射治疗剂量验证结果分析[J]. 中华放射医学与防护杂志, 2019, 39(9): 680-685. Zhang XL, Yang RJ, Li J, et al. Analysis of dosimetric verification results of stereotactic body radiotherapy[J]. Chin J Radiol Med Prot, 2019, 39(9): 680-685. DOI:10.3760/cma.j.issn.0254-5098.2019.09.008 |
| [19] |
Guckenberger M, Meyer J, Vordermark D, et al. Magnitude and clinical relevance of translational and rotational patient setup errors: A cone-beam CT study[J]. Int J Radiat Oncol Biol Phys, 2006, 65(3): 934-942. DOI:10.1016/j.ijrobp.2006.02.019 |



