2. 南华大学,湖南 衡阳 421001;
3. 河北大学生命科学学院,河北 保定 071002
2. Nanhua University, Hengyang 421001 China;
3. College of Life Sciences, Hebei University, Baoding 071002 China
放射性肺损伤(Radiation-Induced Lung Injury, RILI) 是胸部恶性肿瘤放射治疗引发的常见并发症,其包括2个阶段:早期放射性肺炎(Radioactive Pneumonia,RP)表现为组织炎症,晚期放射性肺纤维化(Radiation-induced Pulmonary Fibrosis,RPF)表现为成纤维细胞过度增生、胶原和细胞外基质大量沉积[1]。电离辐射诱导细胞DNA损伤、活性氧(ROS)产生,导致免疫细胞聚集,诱导细胞因子白介素(IL)、转化生长因子(TGF)大量释放[2]。因此,放射性纤维化被认为是多种效应细胞、细胞因子等共同参与的复杂免疫反应[3-4]。作为免疫系统的重要组成部分,补体能够参与中性粒细胞、嗜酸性粒细胞、单核细胞等炎症细胞的募集[5],在炎症反应中发挥重要作用。但补体在放射性肺损伤中的作用研究鲜有报道。本研究通过观察不同补体(C2、C3、C4、C5等)在60Co γ射线单次20 Gy胸部照射诱发早期放射性肺炎和晚期放射性肺纤维化中的变化规律,为放射性肺损伤防治研究提供新线索,并利用体外培养的肺上皮细胞,探索辐射损伤细胞的补体反应的机制。
1 材料与方法 1.1 主要试剂及仪器戊巴比妥钠(Merck,德国),TRI Reagent(Sigma,美国),小鼠补体成分2(C2)酶联免疫试剂盒(CUSABIO,中国),补体成分3a(C3a)检测试剂盒、补体成分4(C4)检测试剂盒、末端补体复合物C5b-9(C5b-9)检测试剂盒(Cloud-clone,中国),BCA 蛋白浓度测定试剂盒(碧云天,中国),C3a Rabbit pAb (ABclonal,中国),T-PERTM组织蛋白提取试剂(Thermo,美国),CD45-APC-Cy7抗体、CD3e-FITC抗体、CD4-PE-Cy7抗体、CD8α-Percp抗体、CD11c-APC-Cy抗体(BD,美国),SuperReal荧光定量预混试剂(TIANGEN,中国)。钴源(Co-60,英国维瑞斯公司),MULTISKAN GO全波长酶标仪(Thermo,美国),CFX96 Touch荧光定量PCR检测系统(Bio-Rad,美国),FACSCalibur流式细胞仪(BD,美国)。
1.2 实验动物饲养及分组120只6~8周龄、体重18~20 g的SPF级雄性C57BL/6小鼠(北京维通利华生物科技有限公司)[动物许可证号:SCXK(京)2019-0006],随机分为12个组(6个对照组、6个照射组),每组小鼠10只。饲养于军事科学院军事医学研究院实验动物中心,饲养环境:温度:18~22℃,相对湿度:50%~60%,照明:10~14 h,换气:8~20 次/h。
1.3 实验细胞及培养Beas-2B细胞为本实验室所存。Beas-2B细胞用LHC-8无血清培养液,置37℃,5% CO2的恒温细胞培养箱中培养。当细胞密度达到80%~90%时,用0.25%的胰酶消化,按照实验要求细胞数进行接种或传代。将接种后Beas-2B细胞随机分为对照组、照射组。
1.4 实验方法 1.4.1 60Co γ射线照射利用军事医学研究院辐射医学研究所钴源照射室进行60Co γ射线照射。
动物照射时,将小鼠麻醉(1%戊巴比妥钠,50 mg/kg,腹腔注射),固定在自行设计的动物照射装置上,除胸部照射部位(面积3.0 cm×1.5 cm)外,其余部位用铅砖(10 cm厚)屏蔽遮挡。置于照射室,与放射源距离3 m处,一次照20 Gy,照射剂量率69.42 cGy/min,照射时间28:49 (min/s)。同时对照组进行假照射。
细胞照射前1天按照实验要求细胞数进行接种,培养24 h后进行照射。将细胞置于照射室,与放射源距离3 m处,照射剂量率69.42 cGy/min,分别照射2∶53、5∶46、8∶25、11∶31 (min/s),即照射剂量为2 Gy、4 Gy、6 Gy、8 Gy,同时对照组进行假照射。照射后各组更换新培养液继续培养。
1.4.2 肺病理切片的制作、染色及病理形态学观察小鼠麻醉处死后,放血,取出全肺,分离出右肺置于−80℃冻存,左肺置于10%福尔马林溶液固定。固定结束后石蜡包埋,常规病理切片,进行HE染色和Masson三色染色后在普通光学显微镜下进行观察。
1.4.3 流式细胞检测肺组织白细胞、DC细胞和T细胞亚群分别在照射后第1、2、3、7、15 d将小鼠麻醉,放血,取小鼠右肺剪碎后胶原酶消化,置于40 µm细胞筛网过滤得到肺单细胞悬液,单细胞悬液分为2管,分别加入CD16/32抗体,室温孵育15 min,一管加入CD45-APC-Cy7、CD3e-FITC、CD4-PE-Cy7、CD8α-Percp抗体进行染色,一管加入CD11C-APC-Cy抗体染色,4℃孵育60 min。流式细胞仪进行检测。
1.4.4 ELISA检测肺组织匀浆液中补体含量称取小鼠肺组织0.05 g,加入1 mL PBS(含蛋白酶抑制剂),匀浆仪匀浆后离心(3000 r/min,15 min),收取上清液,即肺组织匀浆液。ELISA试剂盒检测待测补体C2、C3a、C4及补体复合物C5b-9的OD值,通过试剂盒标准品所得OD值构建标准曲线,计算得到补体的浓度,BCA试剂盒检测肺组织匀浆液总蛋白浓度,求得待测补体在总蛋白含量。
1.4.5 Western Blot检测肺组织补体C3a蛋白表达水平称取肺组织0.05 g,加入1 mL组织蛋白提取液,匀浆仪冰上匀浆,4℃ 10000 g离心5 min,收取上清液,微量分光光度计检测蛋白提取液中蛋白浓度。将相同的蛋白质浓度进行免疫印迹分析,一抗稀释1000倍,4℃下孵育过夜,二抗室温孵育1 h,显影检测肺组织补体C3a蛋白表达水平。
1.4.6 RT-PCR检测补体mRNA表达水平提取细胞中总RNA并逆转录合成cDNA。cDNA与SYBR Green PCR Master Mix和基因特异性引物预混后进行RT-PCR,半定量每个目标基因的实时PCR数据表示为与对照相对定量。
1.5 统计学分析采用SPSS 22.0软件进行统计学分析。数据以
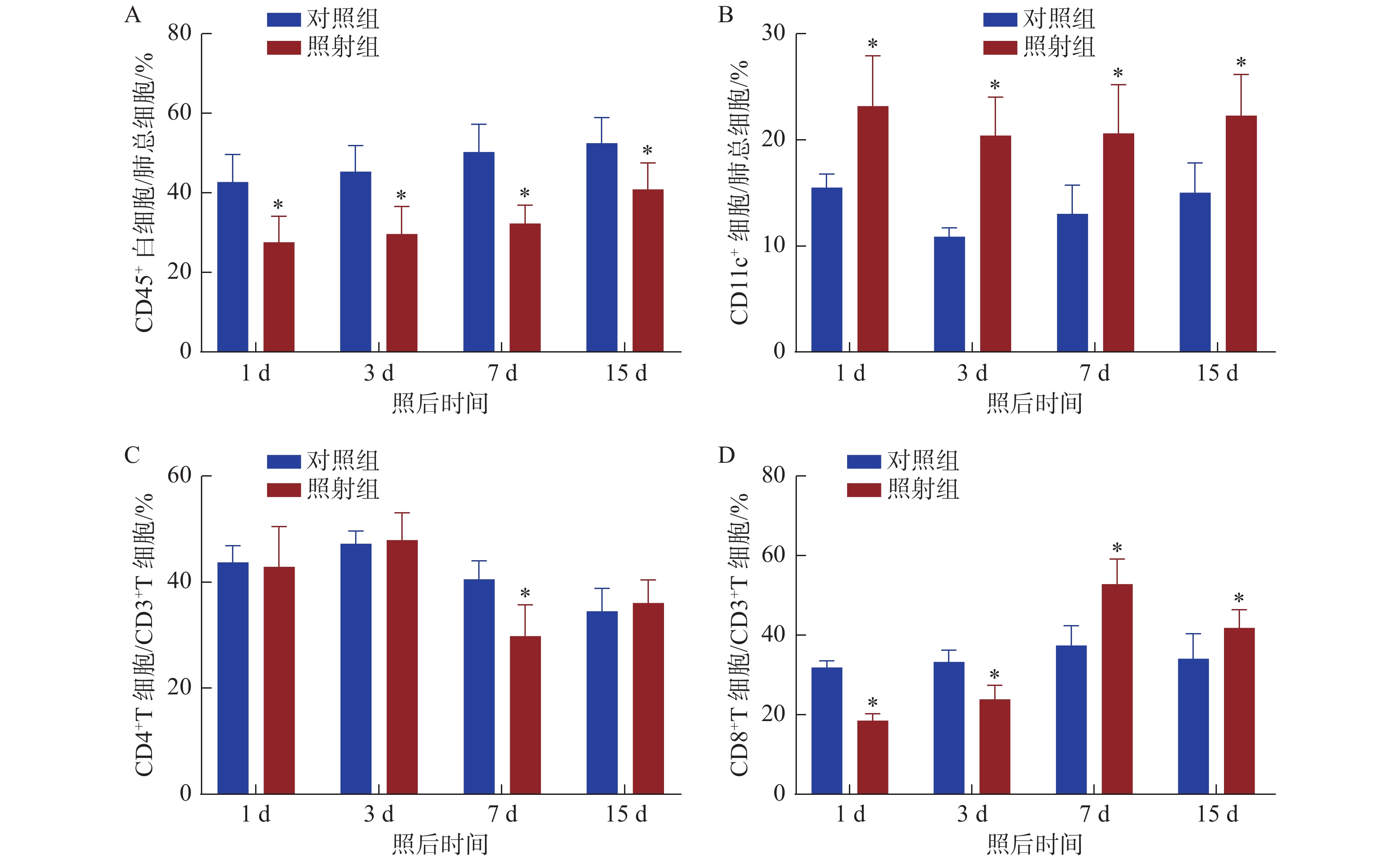
60Co γ射线单次20 Gy胸部照射C57BL/6小鼠后1 d、3 d、7 d、15 d,肺组织中炎性相关细胞分子检测结果如图1。可以看出,反应基础免疫的CD45+白细胞占比(图1A)明显减少(P < 0.05),辐射损伤作用明显。负责抗原提呈的DC细胞比例( 图1B)明显增高(P < 0.05),辐射所致炎性反应明显。辅助细胞免疫的CD4 +T细胞亚群百分数(图1C)除7 d外(减少),基本无明显变化;细胞毒效应的CD8+T细胞亚群百分数(图1D)在照射后早期减少(P < 0.05),7 d后开始明显增高( P < 0.05)。这也DC介导辐射损伤肺上皮细胞的抗原提呈致T细胞特异性活化结果一致。
|
图 1 流式检测肺组织免疫细胞变化 Figure 1 Immune cell changes in lung tissue by flow cytometry 注:A:小鼠胸部照射后不同时间CD45+白细胞比例变化(n = 7);B:小鼠胸部照射后不同时间CD11c + DC细胞比例变化(n = 7);C:小鼠胸部照射后不同时间CD4+T细胞比例变化(n = 7);D:小鼠胸部照射后不同时间CD8+T细胞比例变化(n = 7);*,与对照组相比,P < 0.05 |
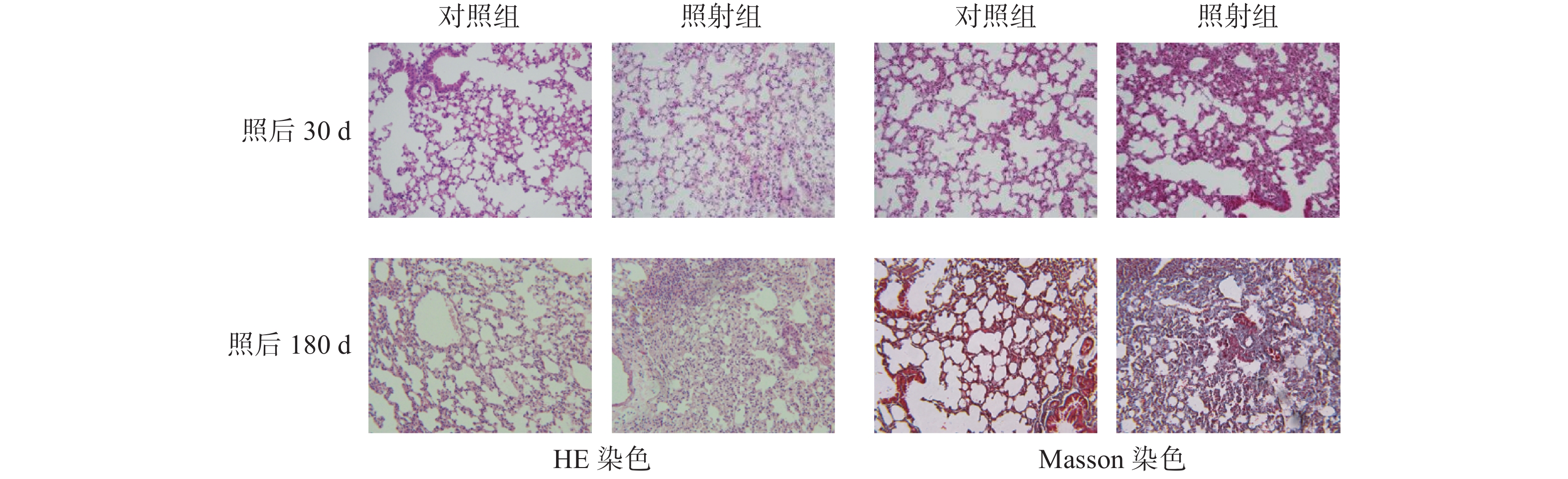
60Co γ射线单次20 Gy胸部照射C57BL/6小鼠后30 d和180 d,肺组织切片病理观察结果如图2。可以看出,照射后30 d,小鼠肺组织炎性反应仍很明显,并呈现早期纤维化反应症状,表现在肺泡壁增厚,肺泡腔融合,肺泡数量减少,血管明显扩张,大量红细胞渗出,少量白细胞浸润等。照后180 d,小鼠肺组织呈现典型的纤维化症状,包括肺组织结构严重破坏,肺泡腔明显缩小,胶原纤维大量弥漫于整个肺部,并可见明显纤维化病灶形成等。
|
图 2 小鼠胸部照射后不同时间肺脏病理变化(200×) Figure 2 Pathological changes of lung at different times after chest irradiation in mice (200×) |
60Co γ射线单次20 Gy胸部照射C57BL/6小鼠后1 d、3 d、7 d、15 d、30 d、180 d,ELISA检测肺组织中补体C2、C3a、C4和补体复合物C5b-9含量,结果如表1。照射后不同补体(复合物)的反应存在差异明显,其中,补体C2、C4和补体复合物C5b-9除在早期(3 d或7 d)有一过性增高(P < 0.05)外,其他时间均与对照组无明显变化,提示这些补体可能与照射引起的炎性反应有关。补体C3a在照射后各时间点均高于对照组,但可能是由于C3a片段太小,ELISA检测结果比其他补体低1~2个量级,为此,对相同组织样本补体C3a进行Western Blot检测,结果如 图3。肺组织补体C3a在照射后3~180 d均明显高于对照组水平,表明补体C3a参与了放射性肺纤维化发生发展的全过程,提示通过调控补体C3a及其受体可能发现有效防治放射性肺损伤的新途径。
|
|
表 1 20 Gy γ射线胸部照射后不同时间点肺组织中C2、C3、C4、C5b-9含量(ng/mg protein, |

|
图 3 肺组织中C3a表达 Figure 3 Expression of C3a in lung tissue A:Western Blot检测C3a表达;B:对Western Blot结果灰度分析。 |
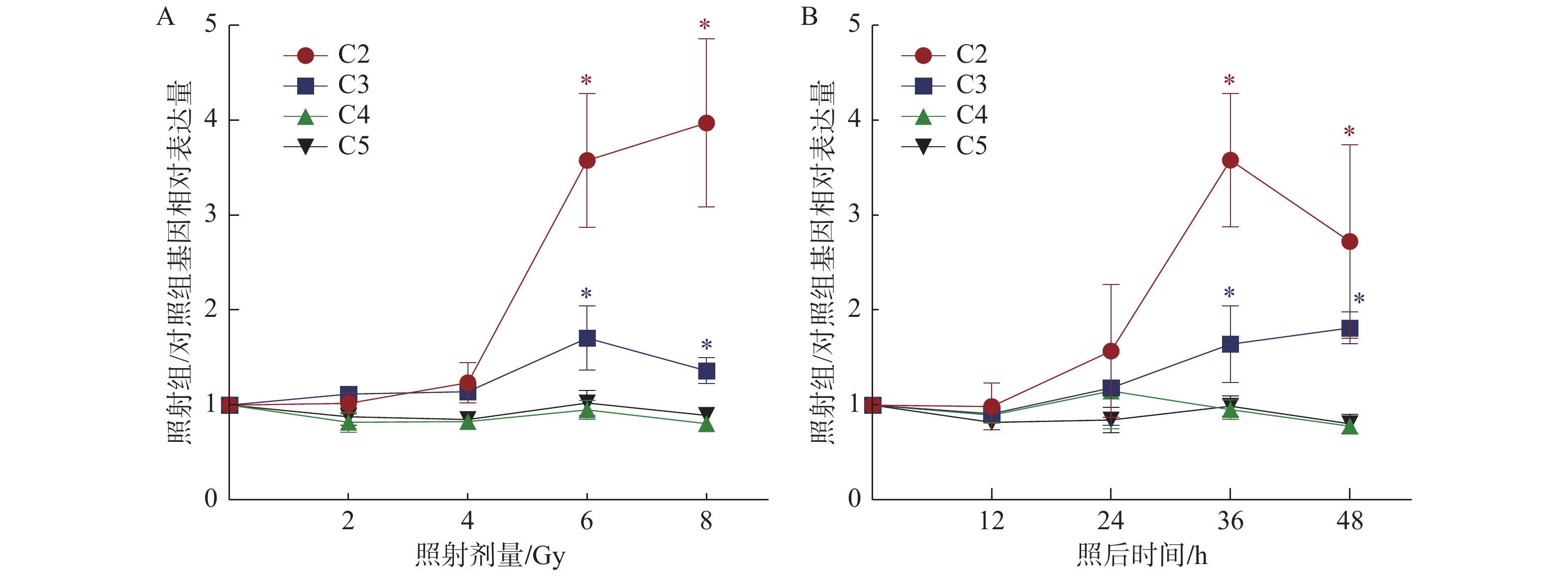
RT-PCR检测不同剂量60Co γ射线照射后人支气管上皮细胞(Beas-2B细胞)补体C2、C3、C4、C5的mRNA表达水平,结果如图4。补体C2、C3的mRNA表达水平与照射剂量明显相关,可能提示其与细胞的放射损伤关系密切;而补体C4、C5的mRNA表达水平与照射剂量无明显相关性,表明其与肺细胞照射损伤无关,而可能通过机体内其他细胞参与炎性反应。6 Gy60Co γ射线照射后不同时间Beas-2B细胞内补体C2、C3、C4、C5的mRNA表达水平如图4B。补体C2 mRNA表达水平在照射后24 h开始增高,36 h达到峰值,48 h后开始下降,与体内ELISA测定的结果完全一致。补体C3 mRNA表达水平在照射后48 h内持续高表达,进一步提示补体C3可能与肺上皮细胞照射后反应有关,这与上述体内实验结果完全一致。
|
图 4 γ射线照射Beas-2B细胞后补体基因相对表达量 Figure 4 Relative expression of complement genes in BEAS-2B cells irradiated with γ-ray 注:A:不同剂量照射Beas-2B细胞后36 h胞内补体基因相对表达量;B:6 Gy照射Beas-2B细胞后不同时间补体基因相对表达量;*与对照组相比,P < 0.05 |
放射治疗是治疗胸部恶性肿瘤的主要方法之一[6],然而相关报道指出胸部放疗患者5%~20%会发生RILI,其发生率高、预测性低、治疗困难是困扰医学界的难题[7-8],如何有效减少放射性肺炎的发生、减轻肺纤维化的程度是研究的重点热点,故而探索其发病机制是解决这一问题的关键。本研究利用60Co γ射线对小鼠进行单次20 Gy胸部照射,观察到早期(15 d内)白细胞数降低、DC细胞增多和T细胞亚群特异性活化等明显的放射性肺炎反应。照射后6个月,小鼠肺组织结构严重破坏,肺泡腔明显缩小,胶原纤维弥漫整个肺部,并可见明显纤维化病灶形成,诊断为典型的放射性肺纤维化疾病。
补体系统由30多种蛋白及可溶性或膜结合蛋白受体组成,主要通过经典途径、旁路途径和凝集素(MBL)途径3种途径激活[9],在免疫防御、调节免疫应答及病理损伤中起着十分重要的作用。补体C2、C4是补体经典途径和MBL途径的重要组成部分,二者是免疫防御发挥重要作用,有研究报道补体C2、C4的完全或部分缺乏与感染易感性增加有关[10-11]。本研究结果发现γ射线胸部照射小鼠早期肺组织匀浆中补体C2、C4明显增高,后恢复到对照组水平,结果提示补体C2、C4参与了放射性肺损伤的早期反应,补体C2、C4含量增多与机体辐射后的诱发免疫防御有关,同时补体C2、C4的肺组织激活可能会导致经典途径或MBL途径的激活,引起下游反应,进一步参与早期的炎症反应。然而,体外研究发现,人肺上皮细胞Beas-2B照射后C2 mRNA水平升高而C4 mRNA无明显变化,表明补体C2与细胞的放射损伤关系密切,而补体C4可能通过机体内其他细胞参与炎性反应。
补体复合物C5b-9是补体活化的最终产物,也是膜攻击复合物(Membrane Attack Complex,MAC),可以杀伤致病细胞,在先天性免疫和获得性免疫中均发挥重要作用。本研究发现补体复合物C5b-9在小鼠胸部照射早期出现一过性增高,这与C2、C4的变化趋势一致,由此我们推测辐射早期引起补体通过经典途径或MBL途径活化致使补体复合物C5b-9含量增加参与早期反应。同时相关研究指出补体复合物C5b-9能够增强组织因子和粘附分子的表达,促进趋化因子[12]和血小板激活因子的释放[13],促进炎症、增加血管通透性[14]。推测早期免疫复合物C5b-9增高,可能参与早期的炎症反应。同时研究指出C5b-9可以杀伤致病细胞,导致细胞坏死,也可促进ROS的产生[15],提示照射早期肺损伤可能与照射后C5b-9增多有关,故而我们推测补体复合物C5b-9在放射性肺损伤前期发挥重要作用。
补体C3a是补体活化的重要产物,也是免疫系统中重要的趋化介质,能够上调或下调不同的细胞因子,在免疫反应中发挥不同作用。本研究发现照射后小鼠肺组织C3a持续高表达,提示补体C3a作为趋化介质参与早期的炎症反应;相关研究指出补体C3a能够激活树突状细胞(DC)和调节T细胞信号传导[16],我们前期的研究发现γ射线照射后调节T细胞持续激活[17],同时DC细胞在照射后早期明显增高,提示照射后早期C3a高表达与DC激活及Treg增多存在相关联系;相关研究指出补体C3a能够上调 TGF-β转录,抑制smad7的表达[18-19],阻断补体C3a受体(C3aR)能够抑制TGF-β表达,减轻纤维化[20],提示补体C3a在照射晚期高表达可能参与放射性肺纤维化的形成。以上结果提示C3a参与了放射性肺纤维化发生发展的全过程,提示通过调控补体C3a及其受体可能是防治放射性肺损伤的新途径。
综上所述,γ射线照射导致小鼠肺组织补体C2、C3a、C4及补体复合物C5b-9在不同时相出现增高,提示补体以不同方式在放射性肺损伤过程中发挥重要作用,补体C3a在照射后就呈高表达状态,参与了放射性肺纤维化发生发展的全过程,提示通过调控补体C3a及其受体可能是防治放射性肺损伤的新途径。
| [1] |
Giridhar P, Mallick S, Rath GK, et al. Radiation induced lung injury: prediction, assessment and management[J]. Asian Pac J Cancer Prev, 2015, 16(7): 2613-2617. DOI:10.7314/apjcp.2015.16.7.2613 |
| [2] |
Yan YJ, Fu JM, Kowalchuk RO, et al. Exploration of radiation-induced lung injury, from mechanism to treatment: a narrative review[J]. Transl Lung Cancer Res, 2022, 11(2): 307-322. DOI:10.21037/tlcr-22-108 |
| [3] |
Arroyo-Hernández M, Maldonado F, Lozano-Ruiz F, et al. Radiation-induced lung injury: current evidence[J]. BMC Pulm Med, 2021, 21(1): 9. DOI:10.1186/s12890-020-01376-4 |
| [4] |
陈家祯, 王玉, 王存良, 等. 放射性肺损伤发病机制及分子靶向治疗研究进展[J]. 中国辐射卫生, 2021, 30(3): 377-380,390. Chen JZ, Wang Y, Wang CL, et al. Research progress on pathogenesis and molecular targeted therapy of radiation-induced lung injury[J]. Chin J Radiol Health, 2021, 30(3): 377-380,390. DOI:10.13491/j.issn.1004-714X.2021.03.023 |
| [5] |
Sadik CD, Miyabe Y, Sezin T, et al. The critical role of C5a as an initiator of neutrophil-mediated autoimmune inflammation of the joint and skin[J]. Semin Immunol, 2018, 37: 21-29. DOI:10.1016/j.smim.2018.03.002 |
| [6] |
Strange CD, Shroff GS, Truong MT, et al. Imaging of the post-radiation chest in lung cancer[J]. Clin Radiol, 2022, 77(1): 19-30. DOI:10.1016/j.crad.2021.04.013 |
| [7] |
Bledsoe TJ, Nath SK, Decker RH. Radiation pneumonitis[J]. Clin Chest Med, 2017, 38(2): 201-208. DOI:10.1016/j.ccm.2016.12.004 |
| [8] |
Sunil Gowda SN, Raviraj R, Nagarajan D, et al. Radiation-induced lung injury: impact on macrophage dysregulation and lipid alteration-a review[J]. Immunopharmacol Immunotoxicol, 2019, 41(3): 370-379. DOI:10.1080/08923973.2018.1533025 |
| [9] |
Talaat IM, Elemam NM, Saber-Ayad M. Complement system: an immunotherapy target in colorectal cancer[J]. Front Immunol, 2022, 13: 810993. DOI:10.3389/fimmu.2022.810993 |
| [10] |
Čubelić D, Mac Lochlainn DJ, Bateman E, et al. Lessons of the month 2: meningococcal epiglottitis and connective tissue disease associated with C2 deficiency[J]. Clin Med (Lond), 2021, 21(5): e539-e540. DOI:10.7861/clinmed.2021-0529 |
| [11] |
Jaatinen T, Lahti M, Ruuskanen O, et al. Total C4B deficiency due to gene deletion and gene conversion in a patient with severe infections[J]. Clin Diagn Lab Immunol, 2003, 10(2): 195-201. DOI:10.1128/cdli.10.2.195-201.2003 |
| [12] |
Czermak BJ, Lentsch AB, Bless NM, et al. Role of complement in in vitro and in vivo lung inflammatory reactions[J]. J Leukoc Biol, 1998, 64(1): 40-48. DOI:10.1002/jlb.64.1.40 |
| [13] |
Kilgore KS, Ward PA, Warren JS. Neutrophil adhesion to human endothelial cells is induced by the membrane attack complex: the roles of P-selectin and platelet activating factor[J]. Inflammation, 1998, 22(6): 583-598. DOI:10.1023/a:1022362413939 |
| [14] |
Koopman JJE, van Essen MF, Rennke HG, et al. Deposition of the membrane attack complex in healthy and diseased human kidneys[J]. Front Immunol, 2021, 11: 599974. DOI:10.3389/fimmu.2020.599974 |
| [15] |
Ziporen L, Donin N, Shmushkovich T, et al. Programmed necrotic cell death induced by complement involves a Bid-dependent pathway[J]. J Immunol, 2009, 182: 515-521. DOI:10.4049/jimmunol.182.1.515 |
| [16] |
Zhou WD. The new face of anaphylatoxins in immune regulation[J]. Immunobiology, 2012, 217(2): 225-234. DOI:10.1016/j.imbio.2011.07.016 |
| [17] |
Xiong SS, Pan XJ, Xu L, et al. Regulatory T cells promote β-catenin-mediated epithelium-to-mesenchyme transition during radiation-induced pulmonary fibrosis[J]. Int J Radiat Oncol Biol Phys, 2015, 93(2): 425-435. DOI:10.1016/j.ijrobp.2015.05.043 |
| [18] |
Fisher AJ, Cipolla E, Varre A, et al. Potential mechanisms underlying TGF-β-mediated complement activation in lung fibrosis[J]. Cell Mol Med Open Access, 2017, 3(3): 14. DOI:10.21767/2573-5365.100037 |
| [19] |
Gu HM, Mickler EA, Cummings OW, et al. Crosstalk between TGF-β1 and complement activation augments epithelial injury in pulmonary fibrosis[J]. FASEB J, 2014, 28(10): 4223-4234. DOI:10.1096/fj.13-247650 |
| [20] |
Gu HM, Fisher AJ, Mickler EA, et al. Contribution of the anaphylatoxin receptors, C3aR and C5aR, to the pathogenesis of pulmonary fibrosis[J]. FASEB J, 2016, 30(6): 2336-2350. DOI:10.1096/fj.201500044 |




