2. 长江大学附属黄冈市中心医院骨科,湖北 黄冈 438000;
3. 长江大学附属黄冈市中心医院肿瘤科,湖北 黄冈 438000
2. Orthopedic department, Huanggang Central Hospital of Yangtze University, Huanggang 438000 China;
3. Oncology department, Huanggang Central Hospital of Yangtze University, Huanggang 438000 China
脑转移瘤为颅内肿瘤发病率较高的肿瘤之一,患者死亡率较高,且严重影响患者的生活质量[1]。全脑放疗(whole brain radiotherapy,WBRT)是既往脑转移瘤的标准治疗手段[2-3],然而,单纯WBRT患者生存期仅为 6个月左右。放疗手术(Stereotactic Radiosurgery. SRS)对 1~3个脑转移瘤的局部控制率明显提高,且对神经认知功能影响较WBRT小。研究表明,WBRT 后序贯 SRS加量较单独行WBRT 的患者有更高的局部控制率及更长的中位生存期[4]。然而,这一治疗模式中,2次放疗剂量会产生叠加效应,增加对正常脑组织的毒性损伤,同时患者的治疗时间更长,治疗费用更高[5]。随着现代放疗技术的进步,基于多种放疗技术实现WBRT联合局部同期加量(simultaneous integrated boost radiotherapy,SIB)已得到广泛应用,包括三维适形放疗(Three Dimensional Conformal Radiotherapy,3D-CRT)、调强放疗(Intensity-Modulated Radiotherapy,IMRT)、旋转调强放疗(Volumetric Modulate Arc Therapy,VMAT)、螺旋断层放疗(Helical Tomotherapy,HT)等。多项研究证实采用同期加量照射肿瘤不仅可以得到较好的局部控制,更好地保护危及器官,还能消除剂量叠加的不确定性,缩短治疗时间[6-9]。
尽管VMAT和HT在WBRT + SIB的应用中相对于3D-CRT及IMRT有更好的靶区均匀性和适形度[10],但大多数医疗机构尤其是基层医院并不具备开展VMAT 和HT的条件,且IMRT较3D-CRT有更好的靶区适形度,危及器官的受量更低,因此,IMRT仍是目前技术条件受限地区最经济有效的选择[11]。已有研究报道了应用IMRT行WBRT + SIB治疗脑转移瘤的疗效及不良反应,但多数关注的是1~3个脑转移瘤[4,6,11-12]。此外,WBRT+SIB这一技术的难点在于如何保证病灶足够受量的同时减少剩余脑组织的受量,并尽量保护海马等重要结构,进而减轻 WBRT对神经认知功能的影响[13]。袁双虎等[14]评估了静态调强放疗、动态调强放疗、VMAT和HT针对1~5个脑转移瘤采用SMART-Brain放疗计划的剂量学特点,结果发现这4种放疗方式均能有效避免海马和内耳损伤,且转移瘤计划靶区平均覆盖率为97.1%~99.4%。基于以上现状,本研究通过探讨SMART-Brain治疗不同数量脑转移瘤的疗效及安全性,试图在技术条件受限的地区为临床治疗脑转移瘤提供一种更优的治疗方案。
1 资料与方法 1.1 临床病例选择选取 2018 年 6 月—2019 年 6月在黄冈市中心医院进行脑转移瘤放疗的 60 例患者。其中,男性32例,女性28例,年龄 43~79岁,年龄中位数为62岁。原发疾病经病理明确诊断为肺癌26例、乳腺癌15例、直肠癌9例、其他10例。脑转移病灶均为MRI证实的可测量的病灶,其中1~3个转移瘤34例,4~6个转移瘤26例。ECOG评分0~2分,预计生存期 > 3个月。排除标准:既往有全脑放疗史;有弥漫性软脑膜疾病者;广泛的颅外疾病,不能通过全身治疗加以控制;严重的精神疾病无法配合随访者;近3个月有中风史。所有患者均签署SMART-Brain放射治疗知情同意书,具体如 表1。
|
|
表 1 60例脑转移患者一般临床资料 Table 1 General information of 60 patients with brain metastases |
所有患者均采用仰卧位,双手置于身体两侧,平躺于定位板上,经头颈肩膜固定。采用美国 GE 公司的多层螺旋CT进行定位,扫描范围为:上界至颅顶,下界为颈2椎体下缘,以3 mm的层厚行CT增强扫描,获取的CT图像通过 Sanjiasoft网络管理系统传输至我科Pinnacle3 9.10计划系统,与患者头部MRI 图像进行融合。
1.3 靶区及危及器官勾画和剂量限制沿颅骨内缘至枕骨大孔的脑组织作为全脑照射范围,定义为临床靶区(clinical target volume,CTV),CTV外扩3 mm定义为计划靶区(planning target volume,PTV);颅内可见转移病灶作为肿瘤靶区(gross tumor volume,GTV),GTV 外扩3 mm为计划肿瘤靶区(planning gross tumor volume,PGTV)。处方剂量PTV 为30 Gy/3 Gy/10次,要求95%的PTV接受至少30 Gy剂量;PGTV 为40 Gy/4 Gy/10次,要求95% 的PGTV接受至少40 Gy剂量。在融合图像上勾画海马、脑干等危及器官,海马二维外扩3~5 mm形成海马PRV(Planning organs at Risk Volume),脑干二维外扩3 mm形成脑干PRV。其他危及器官包括:眼球、晶体、视神经、视交叉和内耳。要求危及器官最大受照剂量Dmax及平均受照剂量Dmean满足以下条件:海马Dmax ≤ 16 Gy,眼球 Dmax ≤ 40 Gy,晶体Dmax ≤ 8 Gy,视神经Dmax ≤ 40 Gy,视交叉Dmax < 40 Gy,脑干 Dmax ≤ 40 Gy,内耳Dmean < 35 Gy。
1.4 治疗计划设计与优化采用 Pinnacle3 9.10计划系统进行设计,采用全脑全调强技术,给予海马、内耳等重要功能区域进行保护性脑照射,PTV剂量为30 Gy/10 F,使用IMRT技术同期加量给予PGTV剂量为40 Gy/10 F。计划射线能量选择6 MV X线,剂量率300 MU/min,机器型号为Varian 600CD直线加速器。机架角采用9野均分,分别设置180°、140°、100°、60°、20°、340°、300°、260°、220°。
1.5 观察指标放疗结束后1个月复查头部增强MRI,以颅内肿瘤大小的变化作为判定近期疗效的客观依据。每次复查均行增强MRI检查,根据RECIST 1.1实体瘤疗效评定标准[15],对脑转移灶的变化分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和进展(progressive disease,PD)。有效率(response rate,RR)=(CR + PR)/总例数 × 100%,疾病控制率(disease control rate,DCR) = (CR + PR + SD)/总例数×100%。评估不良反应(脑功能及内耳受损等情况)发生率。采用简易智力状况检查法(mini-mental state examination,MMSE)进行调查评分。总生存(Overall survival,OS)时间和颅内无进展生存(Intracranial progression-free survival,IPFS)时间定义为从随机化分组开始至患者死亡、颅内进展或随访截止日期。评估患者1年、2年的OS率及1年颅内无进展生存率,总生存率 = 生存人数/总人数 × 100% ,颅内无进展生存率 = 颅内病灶无进展人数/总人数 × 100%。
1.6 随访随访所有患者,随访时间9~33个月,随访时间中位数为24.1个月,此后每3个月复查一次至随访结束,无失访者。
1.7 统计学分析采用 SPSS 23.0软件进行统计学分析,计数资料以例数及率(%)表示,根据疗效评估结果计算RR及DCR,采用 Kaplan-Meier 法进行生存分析。
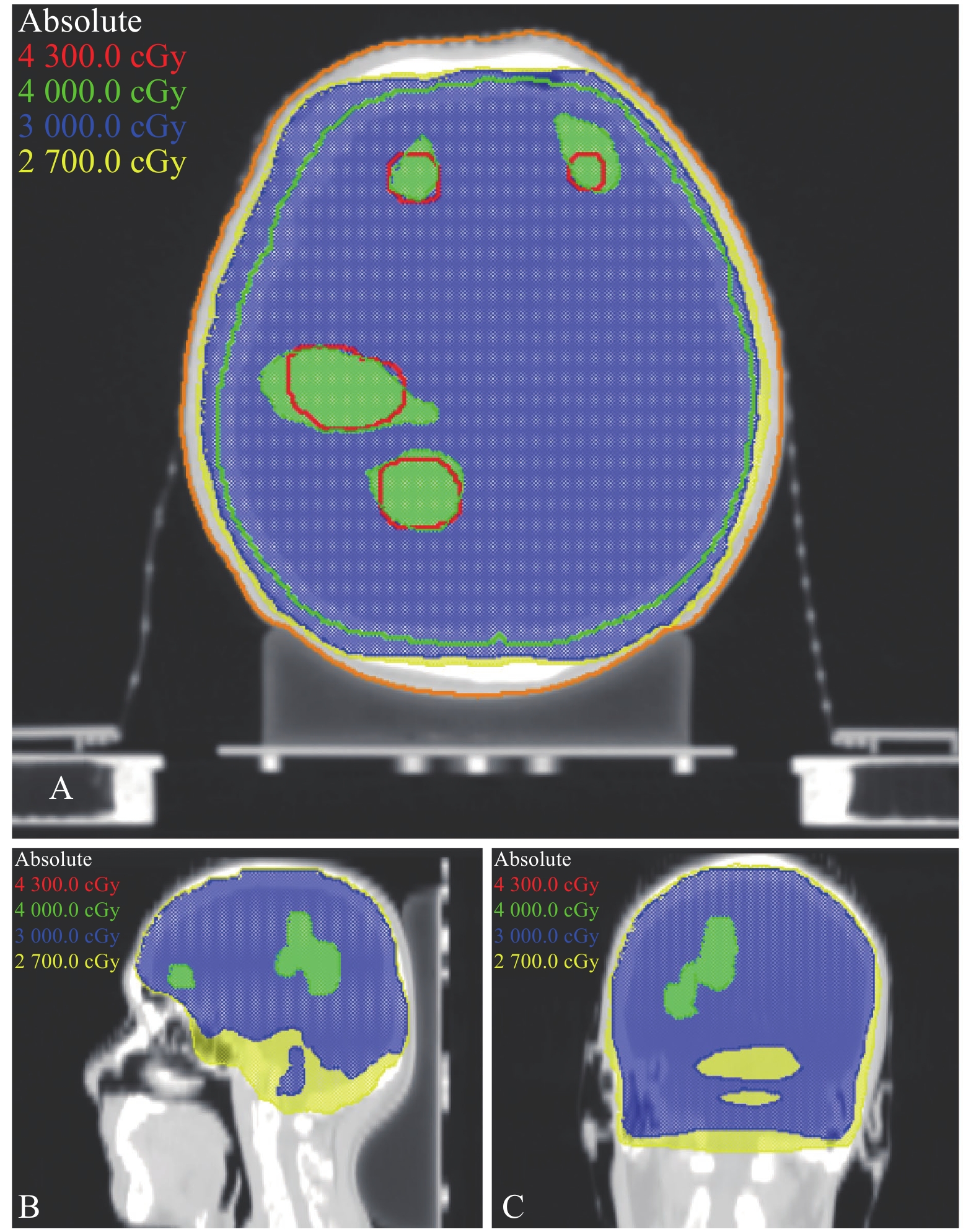
2 结 果 2.1 脑转移瘤患者SMART-Brain计划靶区勾画和剂量分布情况图1显示了同一例脑转移瘤患者(4个病灶)SMART-Brain放疗计划靶区勾画和剂量分布情况,其中绿色为4 000 cGy的剂量线,蓝色为3 000 cGy的剂量线,图1A中位横断位显示脑转移瘤和全脑的剂量包裹情况,图1B和图1C分别显示矢状位和冠状位剂量分布情况。
|
图 1 同一例脑转移瘤患者SMART-Brain计划剂量分布图 Figure 1 Dose distribution of SMART-Brain plan for a patient with brain metastases |
接受SMART-Brain计划脑放疗的60例患者在放疗结束后1个月复查颅脑MRI检查,完全缓解24例,部分缓解20例,病情稳定11例,疾病进展5例,有效率为73.33%(44例);疾病控制率91.67%(55例),见表2。
|
|
表 2 60例脑转移患者临床疗效分析 Table 2 Clinical efficacy for 60 patients with brain metastases |
60例脑转移患者行SMART-Brain计划脑放疗前及放疗结束后1、3、6个月分别采用MMSE进行调查评分。与放疗前相比,患者放疗结束后1、3、6个月时的MMSE评分无统计学差异(P > 0 .05),提示患者定向力、记忆力、注意力、计算力、回忆力和语言能力等功能基本保持稳定(见 表3)。入组患者也未出现2级以上的中耳炎、听力下降、眩晕等内耳受损的副反应。
|
|
表 3 60例脑转移患者放疗前后MMSE评分比较 Table 3 MMSE scores of 60 patients with brain metastases before and after radiotherapy |
患者随访时间9~33个月,随访时间中位数为24.1个月,患者OS和IPFS时间中位数分别为15.2个月和12个月,1年和2年OS率分别为66.7%和26.4%,1年颅内无进展生存率为46.7%,见图2。

|
图 2 60例脑转移患者总生存和颅内无进展生存曲线 Figure 2 Overall survival and intracranial progression-free survival curves of 60 patients with brain metastases |
全脑放射治疗为临床上治疗多发性转移瘤一种有效的治疗手段,但由于正常脑组织耐受剂量的限制,通常只给予30 Gy/10 F的照射剂量,转移瘤床受照剂量低容易引起局部复发。随着放疗技术的进步,全脑同步推量技术已成为3个以下脑转移瘤患者的常规治疗模式[6,8,11-12]。有研究表明同步推量调强放疗法治疗效果优于序贯三维适形放疗法,且同步推量调强放疗的脑转移瘤靶区适合度也优于序贯三维适形放疗[16]。杨森等[10]通过应用容积旋转调强放疗技术在脑转移瘤同期局部病灶加量的应用研究,发现VMAT在WBRT + SIB的应用中相对于3D-CRT以及IMRT有更好的靶区均匀性和适形度。Bauman等[17]对1~3个脑转移灶采用Tomotherapy技术行全脑同步推量至脑转移灶60 Gy/10 F,治疗结束3个月后随访,发现未增加患者中枢神经系统毒性。马玉超等[8]对3个以上脑转移灶行Tomotherapy全脑放疗同步进行立体定向放射治疗,患者局控率提高,同时不良反应减轻;且Tomotherapy在剂量学分布上存在着较大的优势,在获得更为理想的靶区剂量同时更好地保护了正常组织,降低了危及器官的不良反应,是一种较为理想的治疗方式。尽管 VMAT 和 Tomotherapy 对脑转移患者全脑同步推量效果显著,但对于大部分基层医院来说并不具备开展 VMAT 和 Tomotherapy 的条件,且IMRT较3D-CRT有更好的靶区适形度,危及器官的受量更低,因此,IMRT仍是目前技术条件受限地区最经济有效的选择[11]。
本研究对60例不同数量脑转移病灶患者实施调强技术同期加量照射和重点功能区域保护的脑部放疗方法进行了随访分析,放疗结束后1个月复查颅脑MRI检查,发现完全缓解24例,部分缓解20例,病情稳定11例,进展5例,有效率为73.33%(44例);疾病控制率91.67%(55例)。患者时间中位数OS为15.2个月,1年OS率和2年OS率分别为66.7%和26.4%,略高于赵兵等[18]对肺癌脑转移瘤WBRT同期加量的患者的1年和2年OS率,可能与患者同期加量的单次放疗剂量不同以及患者癌种不同等因素有关。王志芬等[19]观察1~3个脑转移瘤患者行全脑放疗联合全程局部同期推量适形放疗的1年颅内无进展生存率为65.6%,高于本研究1年颅内无进展生存率46.7%;历程等[20]研究发现小细胞肺癌脑转移全脑联合转移灶同步加量放疗的中位IPFS为10个月,且年龄 > 60岁和脑转移灶个数 > 3个是不良预后因素。由于本研究纳入了近一半的脑转移病灶 > 3个的患者,故其1年颅内无进展生存率低于以上研究结果。此外,本研究患者采用SMART-Brain计划的总放疗时间为2周,而传统方法需要先行全脑放疗2周,完成后再行肿瘤局部加量,总放疗时间需要3~4周,前者显著减少了放疗次数,缩短了放疗时间,从而减轻了患者家庭的经济负担和时间成本。
简易智力状况检查法(MMSE)评分是评估脑转移患者神经认知功能的常用方法,具有较高的重复性、可靠性及较高的灵敏度和特异性,用于评估定向力、记忆力、注意力、计算力、回忆力和语言能力等功能[21]。刘金娥等[22]比较了不同分割剂量同步推量调强放疗治疗肺癌脑转移瘤的安全性,结果表明3组患者在放疗后3个月时神经认知功能障碍、记忆损伤及脑坏死方面等不良反应均无统计学差异(P > 0.05),且均未出现3级以上神经认知功能障碍。在本研究中,与放疗前基线相比,患者行SMART-Brain计划脑放疗结束后1个月、3个月和6个月的MMSE评分无统计学差异( P > 0.05),与上述研究结论一致,提示该方法能更好地保护海马并降低WBRT时海马的辐射剂量,进而减轻放射性脑损伤引起的神经认知功能下降。此外,有研究表明,对于脑转移瘤全脑放疗,与3DCRT相比,固定野调强放疗和VMAT明显减少了双侧中耳腔和咽鼓管峡部的照射剂量,进而减少内耳相关不良反应的发生 [23]。这与本研究发现的所有患者未出现2级以上的中耳炎、听力下降及眩晕等内耳受损的副反应结论一致。由此可见,SMART-Brain实现了预防性脑照射、肿瘤局部加量与功能保护的同步进行。
综上所述,对于脑转移瘤同步加量放疗,SMART-Brain在海马等记忆功能保护及治疗时间上具有明显的优势,因此,是一种疗效更佳、副作用更小、更经济安全的放疗方法。
| [1] |
张倩, 胡力宏, 宋旭旭, 等. 全脑放疗联合γ-刀局部加量治疗脑转移瘤的临床疗效[J]. 医疗卫生装备, 2016, 37(7): 87-89,100. Zhang Q, Hu LH, Song XX, et al. Clinical effect of whole-brain radiotherapy combined with γ-knife in treatment of brain metastases[J]. Chin Med Equip J, 2016, 37(7): 87-89,100. DOI:10.7687/J.ISSN1003-8868.2016.07.087 |
| [2] |
Alexander E, Moriarty TM, Davis RB, et al. Stereotactic radiosurgery for the definitive, noninvasive treatment of brain metastases[J]. J Natl Cancer Inst, 1995, 87(1): 34-40. DOI:10.1093/jnci/87.1.34 |
| [3] |
孟曼, 毕金玲, 黄勇, 等. 脑转移瘤全脑放疗疗效与预后相关因素分析[J]. 中国辐射卫生, 2019, 28(4): 458-461,472. Meng M, Bi JL, Huang Y, et al. Analysis of factors related to the efficacy and prognosis of brain metastases in whole brain radiotherapy[J]. Chin J Radiol Health, 2019, 28(4): 458-461,472. DOI:10.13491/j.issn.1004-714X.2019.04.030 |
| [4] |
Ni LQ, Liang XD. Feasibility of simultaneous integrated boost with forward intensity-modulated radiation therapy for multiple brain metastases[J]. Contemp Oncol, 2014, 18(3): 187-191. DOI:10.5114/wo.2014.43156 |
| [5] |
杨金磊, 刘博宇, 卜明伟, 等. 混合适形调强技术应用于脑转移瘤放疗的剂量学研究[J]. 中华放射医学与防护杂志, 2014, 34(12): 921-9239. DOI: 10.3760/cma.j.issn.0254-5098.2014.12.011. Yang JL, Liu BY, Bu MW, et al. Dosimetry study in brain metastases radiotherapy by hybrid IMRT[J]. Chin J Radiol Med Prot, 2014, 34(12): 921-923. DOI: 10.3760/cma.j.issn.0254-5098.2014.12.011. |
| [6] |
孙涛, 林秀桐, 王若峥, 等. IMRT、VMAT和混合IMRT技术在颅脑多发转移瘤同步加量放疗中的剂量学研究[J]. 中华放射肿瘤学杂志, 2017, 26(10): 1187-1191. Sun T, Lin XT, Wang RZ, et al. Dosimetric comparison of simultaneous integrated boost with intensity-modulated radiotherapy, volumetric modulated arc therapy, and hybrid intensity-modulated radiotherapy in patients with multiple brain metastases[J]. Chin J Radiat Oncol, 2017, 26(10): 1187-1191. DOI:10.3760/cma.j.issn.1004-4221.2017.10.017 |
| [7] |
Sood S, Pokhrel D, Mcclinton C, et al. Volumetric-modulated arc therapy (VMAT) for whole brain radiotherapy: not only for hippocampal sparing, but also for reduction of dose to organs at risk[J]. Med Dosim, 2017, 42(4): 375-383. DOI:10.1016/j.meddos.2017.07.005 |
| [8] |
马玉超, 肖建平, 毕楠, 等. HT全脑+病灶同步推量放疗多发性脑转移瘤剂量学及临床分析[J]. 中华放射肿瘤学杂志, 2018, 27(5): 435-440. Ma YC, Xiao JP, Bi N, et al. Whole-brain irradiation with simultaneous integrated boost by helical tomotherapy for multiple brain metastases: dosimetric and clinical analyses[J]. Chin J Radiat Oncol, 2018, 27(5): 435-440. DOI:10.3760/cma.j.issn.1004-4221.2018.05.001 |
| [9] |
刘清峰, 肖建平, 张烨, 等. 基于核磁定位的多发脑转移瘤全脑+病灶同步推量治疗中新发病灶的影响因素研究[J]. 癌症进展, 2020, 18(11): 1099-1102. Liu QF, Xiao JP, Zhang Y, et al. Factors influencing the occurrence of new lesions in patients with multiple brain metastases treated by magnetic resonance imaging localization-based whole brain radiotherapy and simultaneous integrated boost for local lesions[J]. Oncol Prog, 2020, 18(11): 1099-1102. DOI:10.11877/j.issn.1672-1535.2020.18.11.06 |
| [10] |
杨森, 张彦秋, 毛羽, 等. 脑转移瘤局部病灶加量容积旋转调强放疗海马体剂量学研究[J]. 中华肿瘤防治杂志, 2017, 24(6): 374-378. Yang S, Zhang YQ, Mao Y, et al. Preliminary dosimetry study of local lesions in brain metastases boost for hippocampus protection by VMAT[J]. Chin J Cancer Prev Treat, 2017, 24(6): 374-378. DOI:10.16073/j.cnki.cjcpt.2017.06.004 |
| [11] |
曾嵘, 陈鹏, 王杰, 等. 脑转移瘤同期加量混合调强放疗与调强放疗的剂量学比较[J]. 中国医学物理学杂志, 2020, 37(6): 671-675. Zeng R, Chen P, Wang J, et al. Dosimetric comparison of Hybrid-IMRT vs IMRT for radiotherapy with simultaneous integrated boost for brain metastases[J]. Chin J Med Phys, 2020, 37(6): 671-675. DOI:10.3969/j.issn.1005-202X.2020.06.003 |
| [12] |
韩翔, 窦超超, 杨现松, 等. 容积旋转调强放疗行同期推量治脑转移瘤的疗效分析[J]. 现代肿瘤医学, 2021, 29(9): 1506-1509. Han X, Dou CC, Yang XS, et al. Analysis of the therapeutic effect of simultaneous plus volumetric modulated arc therapy in the treatment of brain metastatic tumors[J]. J Modern Oncol, 2021, 29(9): 1506-1509. DOI:10.3969/j.issn.1672-4992.2021.09.008 |
| [13] |
Chia BSH, Leong JY, Ong ALK, et al. Randomised prospective phase II trial in multiple brain metastases comparing outcomes between hippocampal avoidance whole brain radiotherapy with or without simultaneous integrated boost: HA-SIB-WBRT study protocol[J]. BMC Cancer, 2020, 20(1): 1045. DOI:10.1186/s12885-020-07565-y |
| [14] |
Jiang AJ, Sun WP, Zhao F, et al. Dosimetric evaluation of four whole brain radiation therapy approaches with hippocampus and inner ear avoidance and simultaneous integrated boost for limited brain metastases[J]. Radiat Oncol, 2019, 14(1): 46. DOI:10.1186/s13014-019-1255-7 |
| [15] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [16] |
刘金娥, 林锋, 蒙静敏. 同步推量调强放疗与序贯三维适形放疗治疗肺癌脑转移瘤的疗效对比[J]. 肿瘤学杂志, 2018, 24(7): 747-750. Liu JE, Lin F, Meng JM. Comparison of simultaneous plus intensity radiotherapy with sequential three-dimensional conformal radiotherapy in treatment of lung cancer patient with brain metastasis[J]. J Chin Oncol, 2018, 24(7): 747-750. DOI:10.11735/j.issn.1671-170X.2018.07.B019 |
| [17] |
Bauman G, Yartsev S, Fisher B, et al. Simultaneous infield boost with helical tomotherapy for patients with 1 to 3 brain metastases[J]. Am J Clin Oncol, 2007, 30(1): 38-44. DOI:10.1097/01.coc.0000245473.41035.c4 |
| [18] |
赵兵, 李云海, 肖锋, 等. 肺癌脑转移瘤同期加量调强放疗与序贯加量放疗的对比研究[J]. 肿瘤学杂志, 2020, 26(9): 808-812. Zhao B, Li YH, Xiao F, et al. Comparison of concurrent intensity-modulated radiotherapy and sequential intensity-modulated radiotherapy for brain metastases from lung cancer[J]. J Chin Oncol, 2020, 26(9): 808-812. DOI:10.11735/j.issn.1671-170X.2020.09.B011 |
| [19] |
王志芬. 全脑照射全程局部同步推量适形放疗在1~3个脑转移瘤患者中的前瞻性研究[D]. 石家庄: 河北医科大学, 2013: 1-43. Wang ZF. A prospective study of whole brain radiotherapy with local simultaneous integrated boost conformal radiotherapy in the treatment of patients with one to three brain metastases[D]. Shijiazhuang: Hebei Medical University, 2013: 1-43. |
| [20] |
历程. 小细胞肺癌脑转移全脑联合转移灶同步加量放疗的临床分析[D]. 长春: 吉林大学, 2020. Li C. Whole-brain radiation therapy with simultaneous integrated boost for brain metastasis of small cell lung cancer: a clinical analysis[D]. Changchun: Jilin University, 2020. |
| [21] |
McDuff SGR, Taich ZJ, Lawson JD, et al. Neurocognitive assessment following whole brain radiation therapy and radiosurgery for patients with cerebral metastases[J]. J Neurol Neurosurg Psychiat, 2013, 84(12): 1384-1391. DOI:10.1136/jnnp-2013-305166 |
| [22] |
刘金娥, 沈永奇, 梁勋斯, 等. 不同分割剂量同步推量调强放疗治疗肺癌脑转移瘤的安全性分析[J]. 中国医学物理学杂志, 2021, 38(4): 422-425. Liu JE, Shen YQ, Liang XS, et al. Safety analysis of simultaneous integrated boost intensity-modulated radiotherapy with different fractional doses in lung cancer brain metastases[J]. Chin J Med Phys, 2021, 38(4): 422-425. DOI:10.3969/j.issn.1005-202X.2021.04.005 |
| [23] |
吴哲, 王东, 陈晓梅, 等. 3种全脑放疗技术对中耳剂量学研究[J]. 中国辐射卫生, 2021, 30(3): 276-281. Wu Z, Wang D, Chen XM, et al. Dosimetric study on middle ear with three whole-brain radiotherapy techniques[J]. Chin J Radiol Health, 2021, 30(3): 276-281. DOI:10.13491/j.issn.1004-714X.2021.03.006 |




