调强放射治疗(intensity modulated radiation therapy,IMRT)技术作为21世纪初的主流放疗技术,其优势是高度适形和陡峭的剂量梯度,最大限度把剂量集中在肿瘤区域内,提高肿瘤剂量,同时使危及器官少受或免受射线照射,更好地保护肿瘤周围的正常组织[1]。IMRT在直肠癌综合治疗中有重要的价值[2]。为了保护靶区周围的正常组织及危及器官,IMRT计划经过优化,剂量梯度变化较明显,因此在设计治疗计划时,必需考虑可能存在的一些不确定性因素。研究认为,在执行IMRT计划过程中,患者的摆位误差对剂量学影响较大[3]。即使设计治疗计划时,已充分考虑了摆位误差,但摆位误差仍然不可避免的,只能减小,不能消除[4-5]。实际的摆位误差对患者肿瘤靶区、正常组织及危及器官会产生什么样的影响无从知道,本文实际测量直肠癌术后IMRT摆位误差,研究摆位误差对患者肿瘤靶区、正常组织及危及器官剂量学的影响。
1 材料与方法 1.1 一般资料直肠癌术后30例患者,Ⅱ~Ⅲ期(T3-4/N+),腺癌。采用真空垫固定体位,处方剂量50 Gy,行调强放射治疗技术。
1.2 设备瓦里安生产的aS1000非晶硅EPID,将参考图像和射野图像的照射野边界和解剖结构进行定位匹配检测,即可确定照射野的摆位误差[6]。
1.3 方法 1.3.1 直肠癌术后患者的定位重建在CT模拟定位机下,采用仰卧位,利用真空袋固定好患者,行CT增强扫描,将扫描信息传至治疗计划系统。在治疗计划系统中,将CT图像重建成的数字重建图像、正位图像、侧位图像等信息传输到加速器电子射野影像系统中。
1.3.2 摆位误差的测量分析分析摆位误差数值时,采用国际辐射单位及测量委员会(ICRU)62号报告[4]中的坐标系,矢量表示各方向上的偏移,左右方向用X表示,左方向为正;头脚方向用Y表示,头方向为正;腹背方向用Z表示,腹方向为正。在电子射野影像系统中,以数字重建图像为参考图像,将射野图像与其配准对比,以数字重建图像计划原点为0,射野图像摆位原点和其原点在左右X、头脚Y、前后Z方向差值的绝对值,即为在该方向上的摆位误差。测量出两者在X、Y、Z方向的摆位误差。在分次治疗中,摆位误差包括摆位时的系统误差和随机误差[7],用Σ ± δ表示,Σ表示系统误差,δ表示随机误差[8]。
1.3.3 治疗计划的优化计划靶区(Planning Target Volume,PTV)至少要达到95%的处方剂量的要求;靶体积内的剂量均匀度在95%~105%;PTV的剂量范围在93%~107%;PTV 接受小于93%的处方剂量的体积小于3%;PTV 接受大于110%的处方剂量的体积小于20%;PTV外不出现大于110%的处方剂量。当出现大于TD5/5剂量限值时,需进行备案登记,由物理师、责任医师和各医疗组长共同讨论,并告知决定。杜绝发生大于TD50/5事件发生。小肠D50%小于20~30 Gy,Dmax小于40~50 Gy;膀胱V40 < 50%、V50 < 40%、D50% < 50 Gy;股骨头 D5% < 50 Gy、V50 < 5%。
1.3.4 评价指标直肠癌术后调强放疗PTV评价指标包括:D近似最小剂量D98%(PTV内剂量从高到低的高剂量98%体积区域接受的最低剂量)、D95%(PTV内剂量从高到低的高剂量95%体积区域接受的最低剂量)、中位剂量D50%(PTV内剂量从高到低的高剂量50%体积区域接受的最低剂量)、D近似最大值D2%(PTV内剂量从高到低的高剂量2%体积区域接受的最低剂量)。均匀性(Homogeneity Index,HI)定义为(D2% − D98%)/D50%[9]、适形度(Conformity Index,CI)定义为CI = (VPTV95%/VPTV) × (VPTV95%/VT)[10],其中(VPTV95%)为95%等剂量线包绕的靶区体积,VPTV为总的PTV的体积,VT为95%等剂量线所包绕的所有区域的体积;CI值在0~1,值越大,适形度越好[11]。OAR和PRV的剂量体积评价:并行器官推荐:Dmean、VD,需勾画整个器官;串行器官推荐:Dmax、D2%,科室制定相应的勾画标准;串并不明器官推荐:D2%、Dmean和VD。正常组织小肠评价指标为Dmax和D2%,膀胱、左股骨头和右股骨头的评价指标包括Dmean、V50、V40、V30、V20和V10。
1.3.5 摆位误差对剂量学的影响随机选择6位患者,采用7野治疗方案,在计划系统中,把每位患者最终的治疗计划作为模板,利用DVH测量计算出模板计划患者1、2、3、4、5、6,PTV的D98%、D95%、D50%、D2%、Hi及Ci;正常组织小肠的Dmax和D2%,膀胱、左股骨头和右股骨头的Dmean和V50。
由测量结果得出,直肠癌术后IMRT,在各个方向,大于等于10 mm的摆位误差视为不符合要求,对于不符合要求的,分析原因,经纠正后,重新摆位测量。通过纠正,在X方向,最大为5 mm,最小为−7 mm;在Y方向,最大为8 mm,最小为−5 mm;在Z方向,最大为6 mm,最小为−4 mm。本研究以L5、R7,G8、T5,B6、A4表示,分别代表将患者向左移动5 mm,向右移动7 mm,向头部移动8 mm,向脚部移动5 mm,向腹部移动6 mm,向背部移动4 mm。在治疗计划系统中,可通过改变原治疗计划的射野中心位置来实现,分别是将射野中心位置向右移动5 mm,向左移动7 mm,向脚部移动8 mm,向头部移动5 mm,向背部移动6 mm,向腹部移动4 mm。
在治疗计划系统中,运用调强剂量验证野的计划设计操作,将患者1的模板计划不作任何改变地拷贝到计划CT图像中,把拷贝计划的射野中心位置在X轴方向右移动5 mm,即L5,模拟在实际治疗过程中患者体位在三维方向的误差性。其他所有条件如射线角度、射野形状、处方剂量等都不变,也不进行重新优化。进行剂量体积计算时,机器跳数没有变化。利用DVH(见图1)测量计算出模板计划患者1,L5,PTV的D98%、D95%、D50%、D2%、Hi及Ci;正常组织小肠的Dmax和D2%,膀胱、左股骨头和右股骨头的Dmean和V50。同时计算出患者1其他5个方向R7,G8、T5,B6、A4,PTV的D98%、D95%、D50%、D2%、Hi及Ci;正常组织小肠的Dmax和D2%,膀胱、左股骨头和右股骨头的Dmean和V50。

|
图 1 DVH图像 Figure 1 DVH image |
将L5,6位患者PTV的D98%、D95%、D50%、D2%、HI及CI;正常组织小肠的Dmax和D2%,膀胱、左股骨头和右股骨头的Dmean和V50,与模板计划的6位患者数据进行统计学对比分析。同时,分别将R7,G8、T5,B6、A4,6位患者PTV的D98%、D95%、D50%、D2%、HI及CI;正常组织小肠的Dmax和D2%,膀胱、左股骨头和右股骨头的Dmean和V50,与模板计划的6位患者数据进行统计学对比分析。
1.3.6 统计方法用SPSS19.0软件进行统计、分析,检验水准α = 0.05。
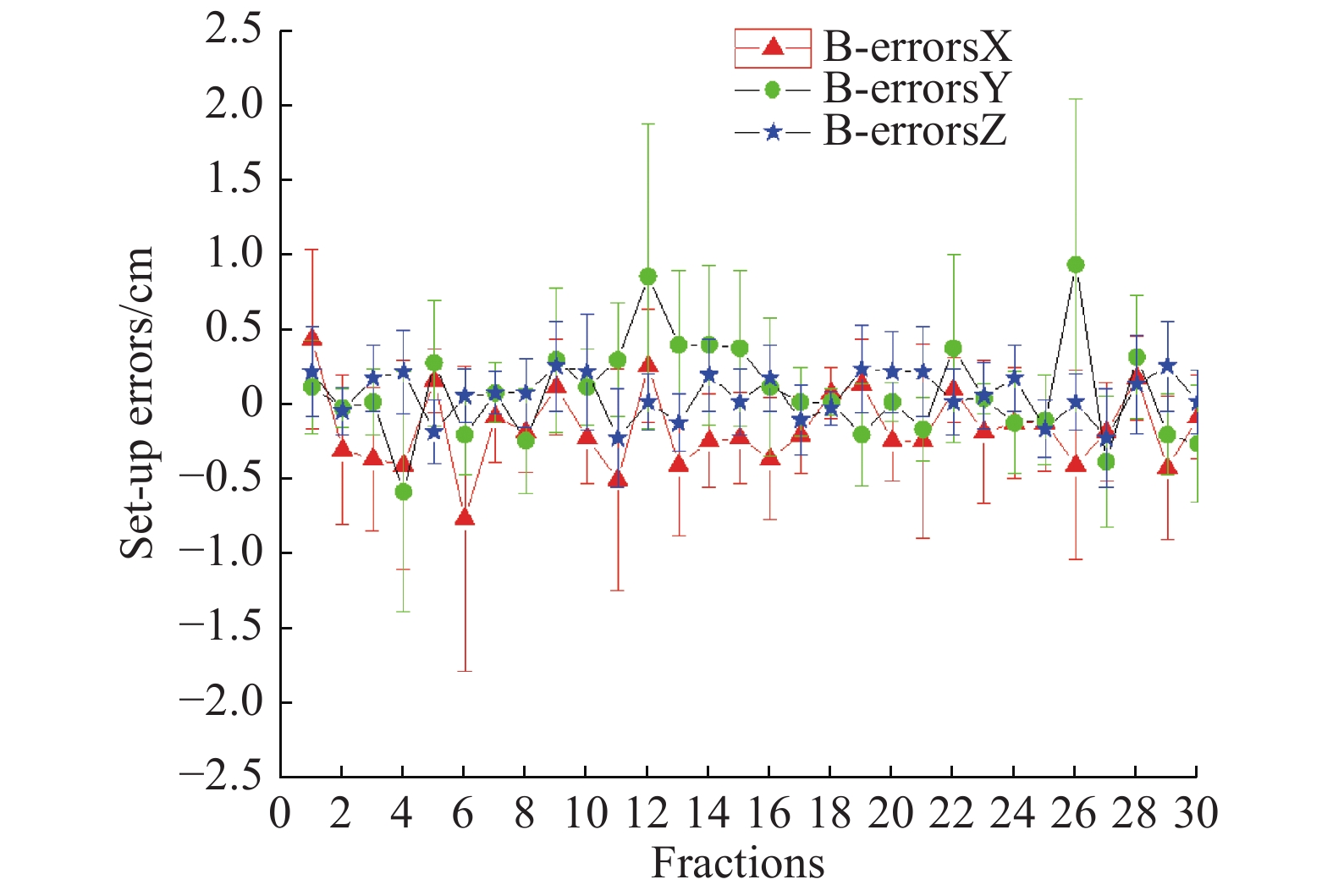
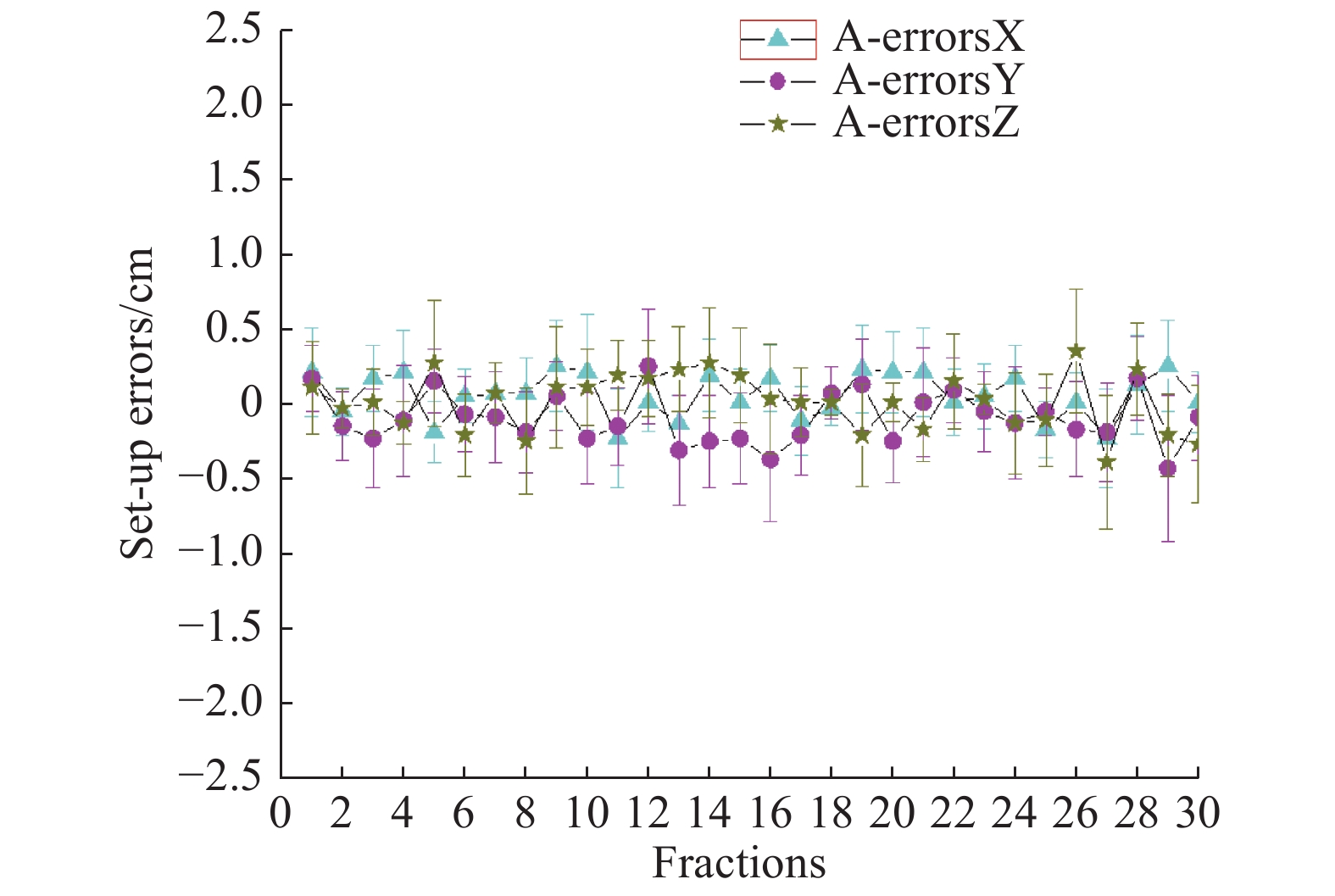
2 结 果 2.1 直肠癌术后调强放疗的摆位误差30例直肠癌患者,摆位验证180次,拍摄射野图像360张,如图2-7。在X方向,≥10 mm的摆位误差出现4次,占180次摆位验证的2.22%,即 < 10 mm的摆位误差为97.78%,一次最大摆位误差为15 mm。在Y方向,≥10 mm的摆位误差出现6次,占180次摆位验证的3.33%,即< 10 mm的摆位误差为96.67%,一次最大摆位误差为14 mm。在Z方向,≥10 mm的摆位误差出现0次,即 < 10 mm的摆位误差为100%,一次最大摆位误差为6 mm。通过纠正,在X方向,最大为5 mm,最小为−7 mm;在Y方向,最大为8 mm,最小为−5 mm;在Z方向,最大为6 mm,最小为−4 mm;摆位误差在5 mm以下的占大部分,少数超过5 mm,没有超过10 mm的。见 图8、图9、表1。
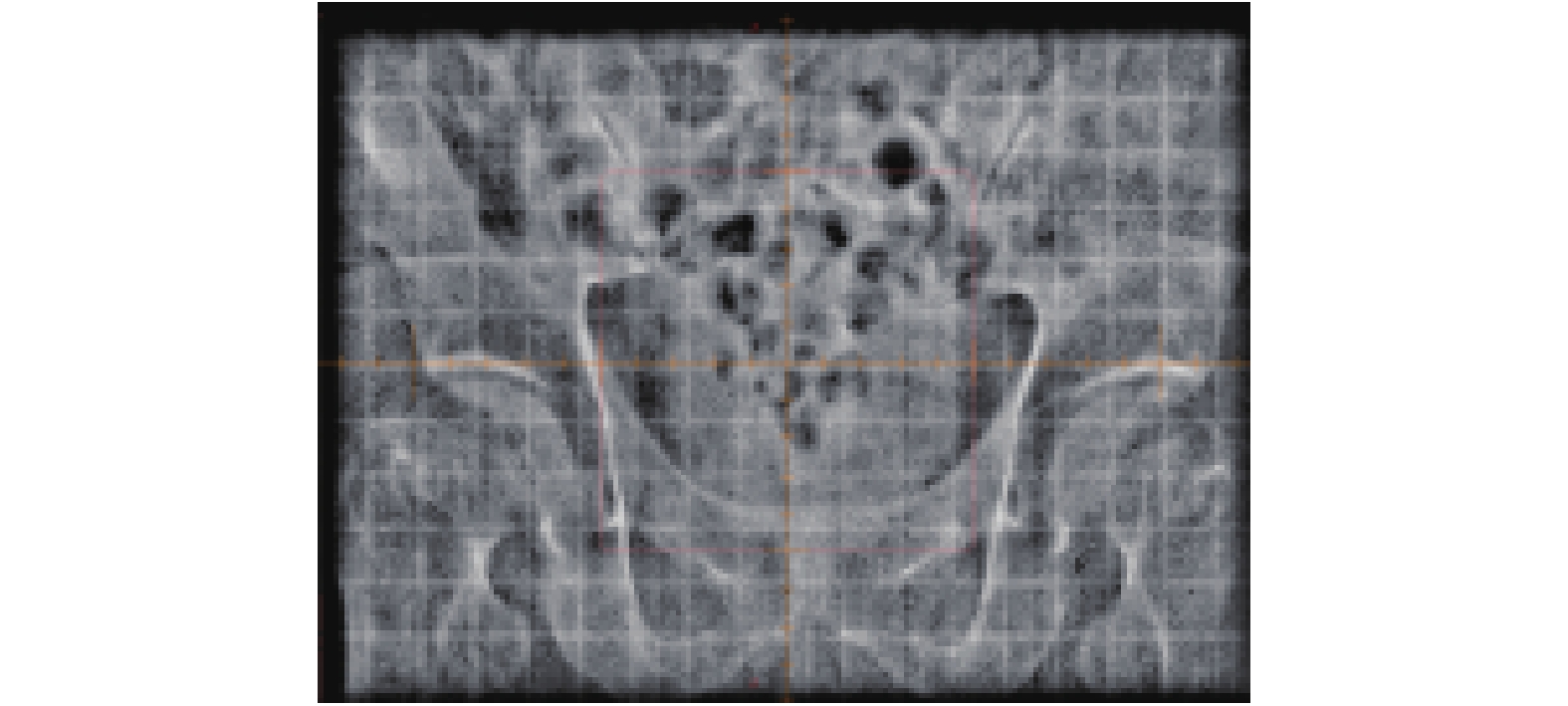
|
图 2 正位EPID射野图像 Figure 2 Real time positive EPID field image |
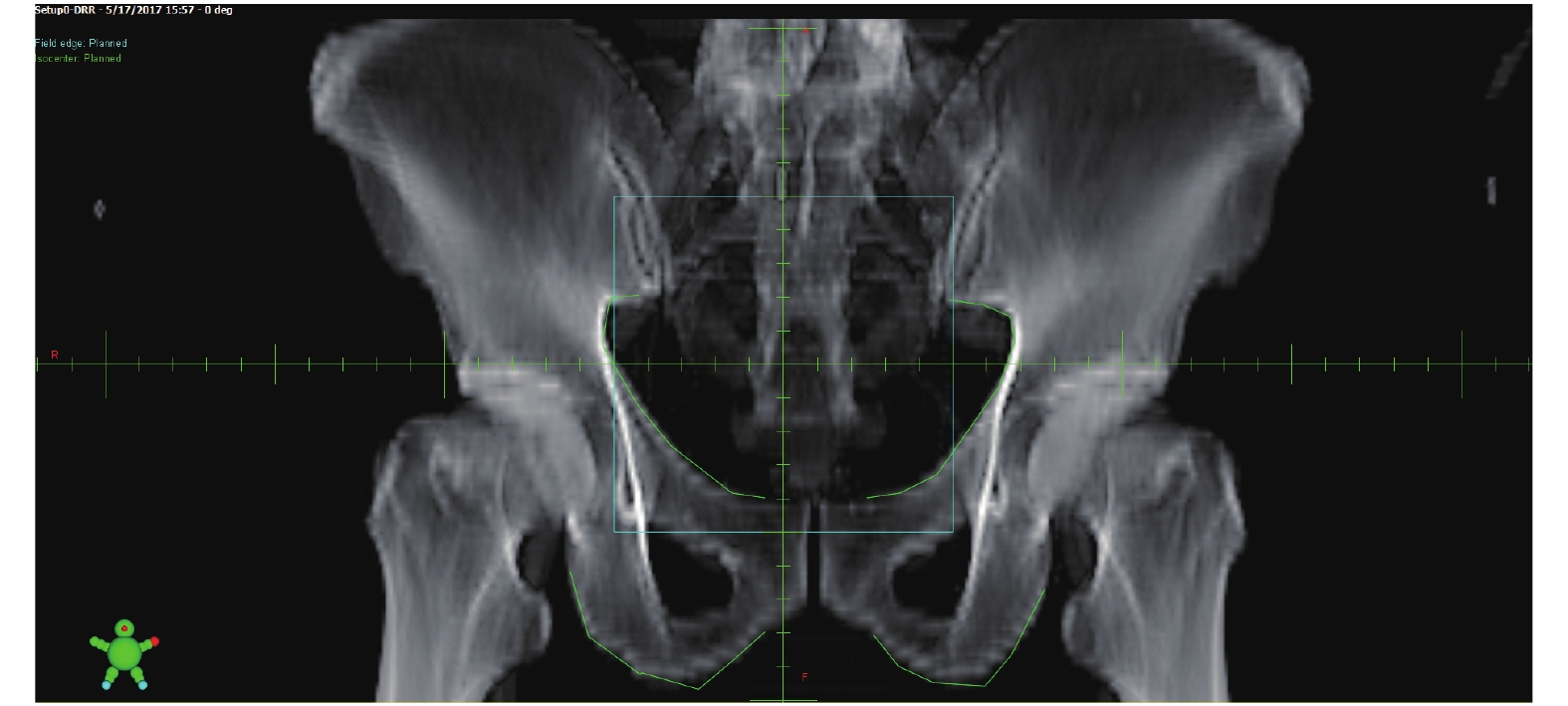
|
图 3 正位DRR图像 Figure 3 Positive DRR image |

|
图 4 正位EPID图像与DRR图像比较 Figure 4 Comparison of positive EPID images and DRR images |
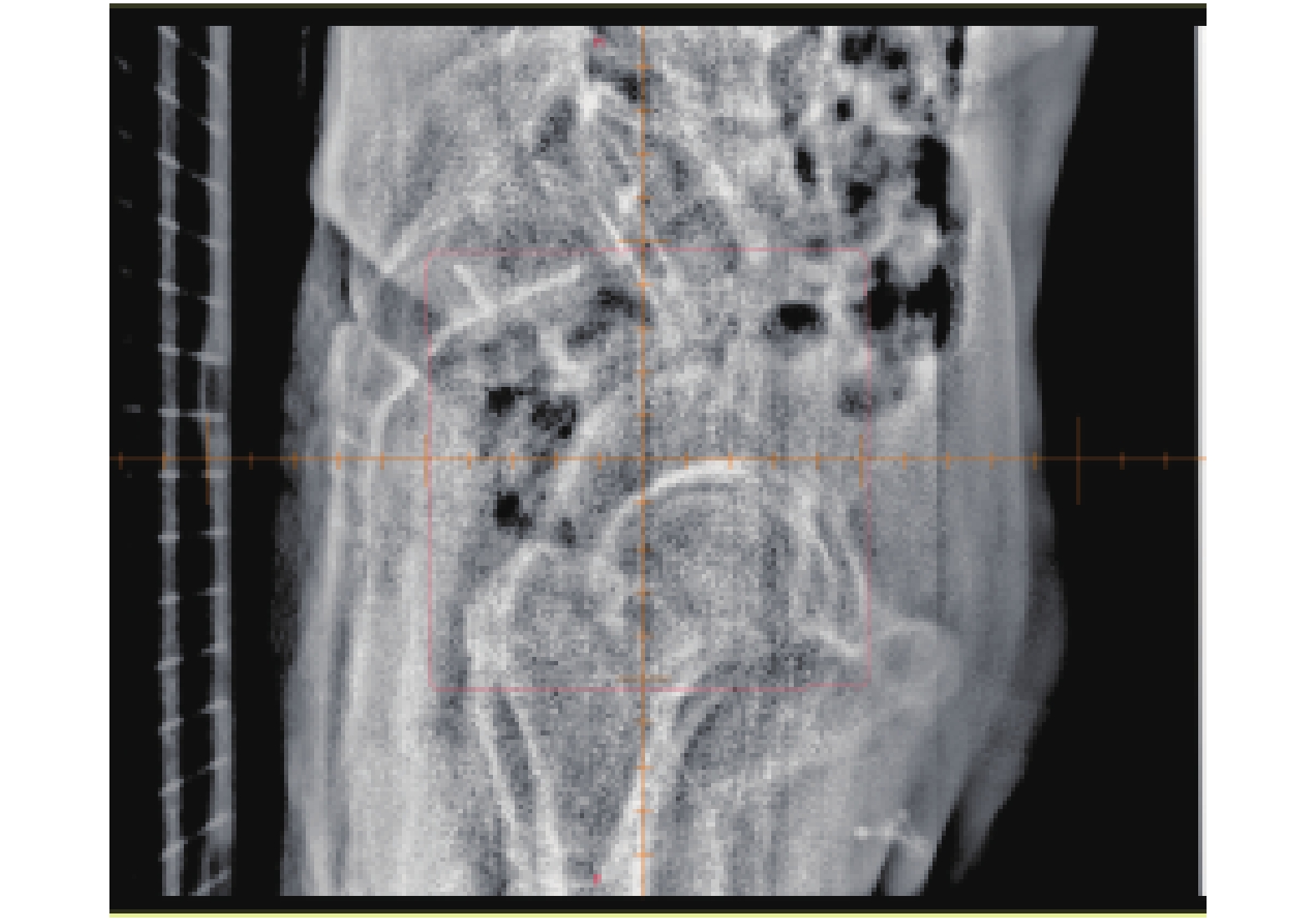
|
图 5 侧位EPID射野图像 Figure 5 Real time side EPID field image |
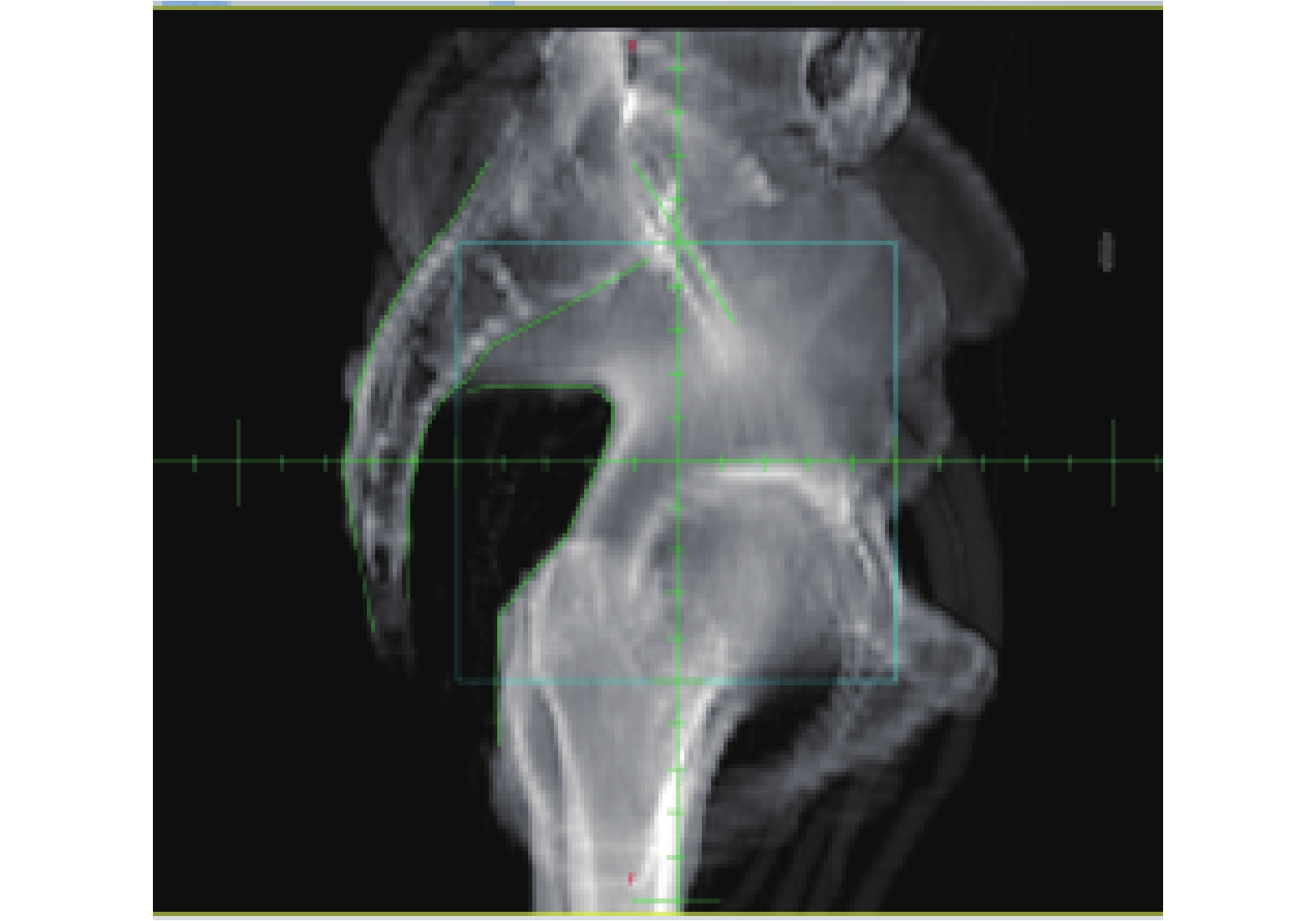
|
图 6 侧位DRR图像 Figure 6 Side DRR image |

|
图 7 侧位EPID图像与DRR图像比较 Figure 7 Comparison of side EPID images and DRR images |
|
图 8 纠正前的摆位误差图 Figure 8 Set-up-error before correction |
|
图 9 纠正后的摆位误差 Figure 9 Set-up-error after correction |
|
|
表 1 纠正后的摆位误差 Table 1 Set-up-error after correction |
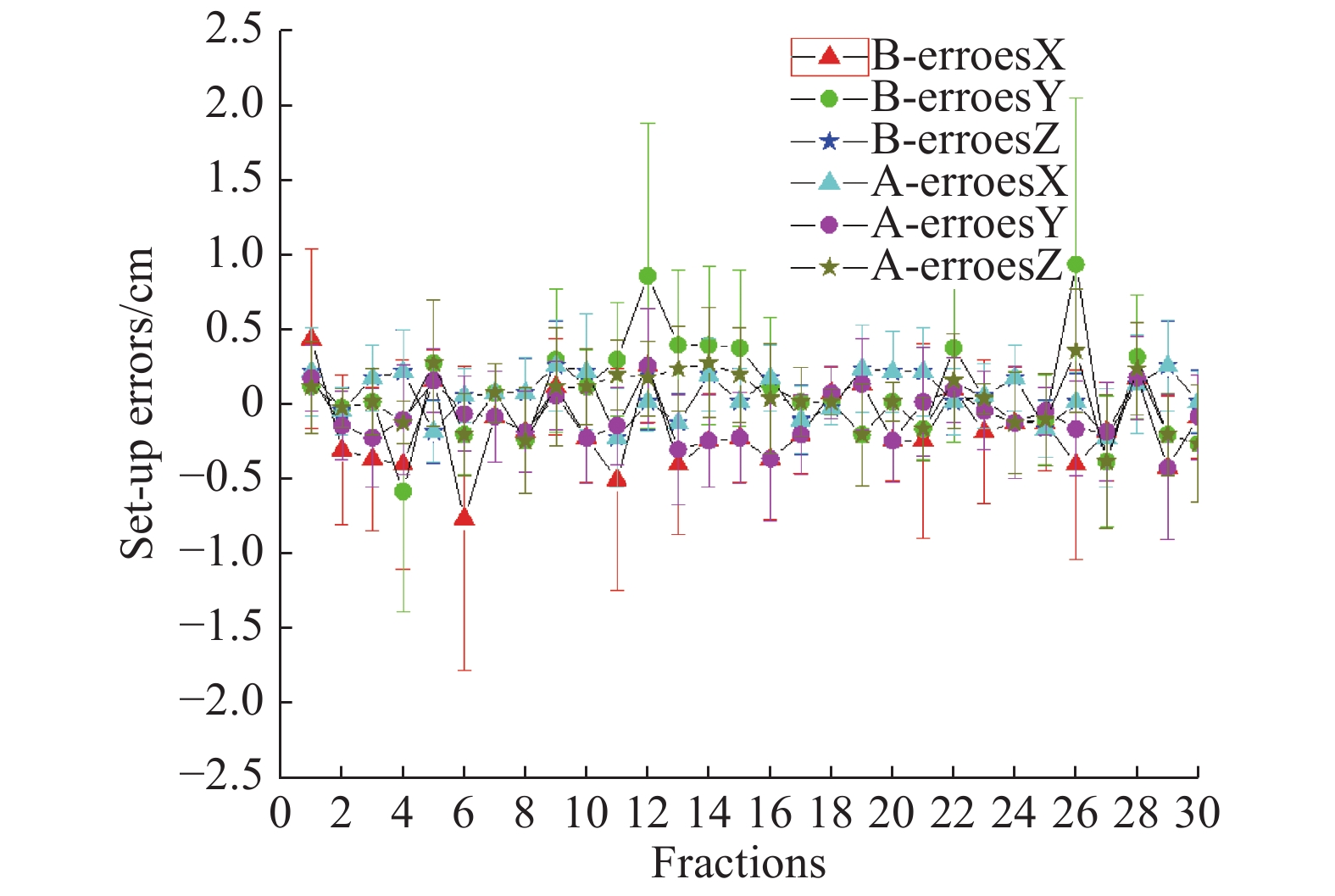
纠正前X、Y及Z方向的摆位误差与纠正后的比较,差异有统计学意义(P < 0.05)。见 图10、表2。
|
图 10 纠正前后的摆位误差 Figure 10 Set-up-error before and after correction |
|
|
表 2 纠正前X、Y及Z方向的摆位误差与纠正后的比较 Table 2 Comparison of set-up-error before and after correction in X、Y and Z direction |
摆位误差L5、R7,G8、T5,B6、A4对PTV的D98%、D95%、D50%、D2%、Hi及CI,大部分差异有统计学意义(P < 0.05)。L5时 HI、G8时D2%、T5时D50%、B6时D2%差异无统计学意义(P > 0.05)。见 表3。
|
|
表 3 摆位误差对PTV的影响(P值) Table 3 Effects of set-up error in PTV(P) |
摆位误差L5、R7,G8对正常组织小肠的Dmax、左股骨头和右股骨头的Dmean,差异有统计学意义(均P < 0.05);对膀胱、左股骨头和右股骨头的 V50、V40、V30、V20和V10,有的差异有统计学意义;有的差异无统计学意义。摆位误差T5对小肠、膀胱差异无统计学意义;对左、右股骨头的Dmean,差异有统计学意义(P < 0.05)。摆位误差B6对小肠、膀胱影响较大,差异有统计学意义( P < 0.05);对左、右股骨头的 Dmean,差异有统计学意义(P < 0.05)。摆位误差A4对小肠无影响;对膀胱、左、右股骨头的 Dmean,差异有统计学意义(P < 0.05);对膀胱的 V50、V40、V30、V20,差异有统计学意义(P < 0.05)。( 表4)。
|
|
表 4 摆位误差对正常组织的影响(P值) Table 4 Effects of set-up error in normal tissue(P) |
在调强放射治疗精准治疗过程中,精确的模拟定位、精确的计划设计、精确的治疗实施和精确的质量控制,一步不能少。在整个治疗过程中,除了摆位误差引起患者剂量实施误差以外,还存在治疗计划系统剂量计算模式中组织不均匀性的校正引起的患者剂量实施误差、剂量传输过程中引起的误差以及MLC叶片间的漏射引起的误差等[12]。摆位是影响精确照射的关键因素,摆位误差直接影响剂量分布[13]。本文仅探讨摆位误差对患者肿瘤靶区、肿瘤周围正常组织及危及器官剂量学的影响。摆位误差除了表现为患者身体在三维空间的平移,还表现为患者身体的旋转。有研究认为[14-15],旋转引起的剂量改变较小,可以忽略。由于本EPID仅能测量分析线性误差,不能测量旋转误差,因而不能为旋转造成的剂量改变提供参考数据。
直肠癌术后调强放疗的治疗实施过程需要较长的时间,每位患者一般需要30 d左右。随着治疗次数的增加,特别是低位直肠癌患者,会发生尿道刺激、下消化道反应及放射性皮炎等症状,同时每次治疗前要求保持膀胱充盈的一致性,有可能会导致患者在治疗实施过程中每次治疗坚持时间更短、摆位难度增加,降低了患者体位的重复性。放射肿瘤学家们一直在致力于减少摆位误差,提高摆位准确性[16-19]。从本研究结果可知,在X方向,≥10 mm的摆位误差出现4次,占180次摆位验证的2.22%,即 < 10 mm的摆位误差为97.78%,一次最大摆位误差为15 mm。在Y方向,≥10 mm的摆位误差出现6次,占180次摆位验证的3.33%,即 < 10 mm的摆位误差为96.67%,一次最大摆位误差为14 mm。在Z方向,≥10 mm的摆位误差出现0次,即 < 10 mm的摆位误差为100%,一次最大摆位误差为6 mm。当发现≥10 mm的摆位误差时,本研究认为是摆位错误,通过纠正,在X方向,最大为5 mm,最小为−7 mm;在Y方向,最大为8 mm,最小为−5 mm;在Z方向,最大为6 mm,最小为−4 mm;摆位误差在5 mm以下的占大部分,少数超过5 mm,没有超过10 mm的。因此,本文选定在X方向,5 mm、−7 mm;在Y方向,8 mm、−5 mm;在Z方向,6 mm、−4 mm的摆位误差来模拟研究对患者肿瘤靶区、肿瘤周围正常组织及危及器官剂量学的影响。
本研究靶区为普通常见形状,未有少见特殊的形状,如X形等。直肠癌靶区横断面上呈凹形,调强放疗可提高靶区均匀性、适形度,提高肿瘤局部剂量,降低正常组织和危及器官照射剂量[20-24]。使精准放疗、临床治疗效果得到有效保障和提高,提高患者生活质量。当摆位误差存在时,治疗设备与患者身体的位置发生了相对变化,射线照射的区域也发生了变化,如射线路径上身体轮廓、身体组织等,因而,治疗计划与患者体内的剂量分布产生了差异。患者治疗计划的靶区及其周围正常组织间剂量梯度变化快慢,导致摆位误差直接影响治疗计划的靶区及其周围正常组织剂量分布。为了使剂量分布更好地与靶区适形、最大程度地保护肿瘤周围的正常组织及危及器官,直肠癌的凹形靶区与小肠、膀胱及左右股骨头之间的剂量梯度下降十分迅速,当摆位误差存在时,引起等剂量线的相应移动,较小的偏移也会导致治疗靶区的丢失、剂量的不足,肿瘤边缘容易复发,肿瘤周围的正常组织及危及器官剂量的增加,加重正常组织损伤的风险。从统计结果发现,统计分析,比较均值,配对样品T检验,摆位误差L5、R7,G8、T5,B6、A4对PTV的D98%、D95%、D50%、D2%、HI及CI,绝大部分差异有统计学意义。L5时HI、G8时D2%、T5时D50%、B6时D2%的差异无统计学意义。摆位误差L5、R7,G8对正常组织小肠的Dmax、左股骨头和右股骨头的Dmean,差异有统计学意义;对膀胱、左股骨头和右股骨头的V50、V40、V30、V20和V10,有的差异有统计学意义;有的差异无统计学意义。摆位误差T5对正常组织小肠、膀胱差异无统计学意义;对左、右股骨头的Dmean,差异有统计学意义。摆位误差B6对正常组织小肠、膀胱影响较大,差异有统计学意义;对左、右股骨头的Dmean,差异有统计学意义。摆位误差A4对小肠无影响;对膀胱、左、右股骨头的Dmean,差异有统计学意义;对膀胱的V50、V40、V30、V20,差异有统计学意义。
综上所述,本研究的初步结果显示摆位误差降低了PTV的受照射剂量,均匀性、适形度变差,使靶区剂量达不到原计划水平;增加了正常组织小肠、膀胱、左股骨头和右股骨头的受照射剂量。后期应加大样本量继续研究。
| [1] |
Mohan R, Wu Q, Manning M, et al. Radiobiological considerations in the design of fractionation strategies for intensity-modulated radiation therapy of head and neck cancers[J]. Int J Radiat Oncol Biol Phys, 2000, 46(3): 619-630. DOI:10.1016/s0360-3016(99)00438-1 |
| [2] |
殷蔚伯, 余子豪, 徐国镇, 等. 肿瘤放射治疗学[M]. 第四版. 北京: 中国协和医科大学出版社, 2008. Yin WB, Yu ZH, Xu GZ, et al. Radiation Oncology (Fourth Edition)[M]. Beijing: Peking Union Medical College press, 2008. |
| [3] |
Xing L, Lin Z, Donaldson SS, et al. Dosimetric effects of patient displacement and collimator and gantry angle misalignment on intensity modulated radiation therapy[J]. Radiother Oncol, 2000, 56(1): 97-108. DOI:10.1016/s0167-8140(00)00192-4 |
| [4] |
Hurkmans CW, Remeijer P, Lebesque JV, et al. Set-up verification using portal imaging; review of current clinical practice[J]. Radiother Oncol, 2001, 58(2): 105-120. DOI:10.1016/s0167-8140(00)00260-7 |
| [5] |
Asselen B, Dehnad H, Raaijmakers CPJ, et al.Implanted gold markers for position verification during irradiation of head and neck cancels: a feasibility study[J]. Int J Radiat Oncol Biol Phys, 2004, 59(4): 1011-1017.
|
| [6] |
陈杨生, 曾自力. 电子射野影像系统的质量保证及应用[J]. 中国辐射卫生, 2016, 25(6): 692-695. Chen YS, Zeng ZL. Quality assurance and application of electron portal imaging device[J]. Chin J Radiol Health, 2016, 25(6): 692-695. DOI:10.13491/j.cnki.issn.1004-714x.2016.06.019 |
| [7] |
McKenzie A, van Herk M, Mijnheer B. Margins for geometric uncertainty around organs at risk in radiotherapy[J]. Radiother Oncol, 2002, 62(3): 299-307. DOI:10.1016/s0167-8140(02)00015-4 |
| [8] |
Li SZ. Markov random field modeling in image analysis[M]. London: Springer London, 2009.DOI: 10.1007/978-1-84800-279-1.
|
| [9] |
Hodapp N. Prescribing, Recording, and Reporting Intensity-Modulated Poton=Beam Therapy(IMRT)(ICRU Report 83)[J]. Strahlenther Onko, 2012, 188(1)97-99 .
|
| [10] |
叶序卷, 高远红, 陈利, 等. 直肠癌术前五野静态调强和容积弧形调强放疗剂量学的比较研究[J]. 临床肿瘤学杂志, 2012, 17(8): 717-720. Ye XJ, Gao YH, Chen L, et al. Dosimetric comparison between preoperative five-field intensity modulated radiotherapy and volumetric modulated arc therapy in the treatment of rectum cancer[J]. Chin Clin Oncol, 2012, 17(8): 717-720. DOI:10.3969/j.issn.1009-0460.2012.08.011 |
| [11] |
Feuvret L, Noël G, Mazeron JJ, et al. Conformity index: a review[J]. Int J Radiat Oncol, 2006, 64(2): 333-342. DOI:10.1016/j.ijrobp.2005.09.028 |
| [12] |
Bucci MK, Bevan A, Roach M 3rd. Advances in radiation therapy: conventional to 3D, to IMRT, to 4D, and beyond[J]. CA Cancer J Clin, 2005, 55(2): 117-134. DOI:10.3322/canjclin.55.2.117 |
| [13] |
闫钢, 詹文华, 折虹. 放疗体膜固定装置在胸腹部肿瘤放射治疗中的应用研究[J]. 吉林医学, 2011, 32(30): 6339-6340. Yan G, Zhan WH, Zhe H. The application of body membrane fixed device in radiotherapy of the chest tumor[J]. Jilin Med J, 2011, 32(30): 6339-6340. DOI:10.3969/j.issn.1004-0412.2011.30.027 |
| [14] |
Remeijer P, Geedof E, Ploeger L, et a1.3-D portal image analysisin clinical practice: 811 evaluation of 2-D and 3-D analysis tech-niques as pbed to 30 prostate cancer patients[J]. hat J Radiat Oncol Biol Phys. 2000, 46: 1281.1290.
|
| [15] |
Fu WH, Yang Y, Li X, et al. Dosimetric effects of patient rotational setup errors on prostate IMRT treatments[J]. Phys Med Biol, 2006, 51(20): 5321-5331. DOI:10.1088/0031-9155/51/20/016 |
| [16] |
林承光, 邓小武, 黄峻, 等. 鼻咽癌适形放疗实施过程精确度和重复性研究[J]. 肿瘤学杂志, 2004, 10(4): 208-210. Lin CG, Deng XW, Huang J, et al. A study of accuracy and reproducibility in conformal radiotherapy for nasopharyngeal carcinoma[J]. J Oncol, 2004, 10(4): 208-210. DOI:10.3969/j.issn.1671-170X.2004.04.002 |
| [17] |
杨树松, 王凡, 孙维凯, 等. 治疗床面下垂导致的系统摆位误差分析及对策[J]. 中华放射肿瘤学杂志, 2001, 10(1): 55-60. Yang SS, Wang F, Sun WK, et al. Systematic set up errors induced by decline of treatment couch top[J]. Chin J Radiat Oncol, 2001, 10(1): 55-60. DOI:10.3760/j.issn:1004-4221.2001.01.017 |
| [18] |
Wang L, Jacob R, Chen LL, et al. Stereotactic IMRT for prostate cancer: setup accuracy of a new stereotactic body localization system[J]. J Appl Clin Med Phys, 2004, 5(2): 18-28. DOI:10.1120/jacmp.v5i2.1947 |
| [19] |
冯凯华, 罗剑锋, 玉贵永, 等. 图像引导放射治疗技术在分析不同体位固定系统对非小细胞肺癌放疗摆位误差中应用[J]. 临床军医杂志, 2020, 48(7): 858-859. Feng KH, Luo JF, Yu GY, et al. Image guided radiotherapy for patients with non-small cell lung cancer[J]. Clinical Journal of Medical Officers, 2020, 48(7): 858-859. DOI:10.16680/j.1671-3826.2020.07.45 |
| [20] |
Wolff HA, Wagner DM, Conradi LC, et al. Irradiation with protons for the individualized treatment of patients with locally advanced rectal cancer: a planning study with clinical implications[J]. Radiother Oncol, 2012, 102(1): 30-37. DOI:10.1016/j.radonc.2011.10.018 |
| [21] |
林锋, 曾自力, 覃树付, 等. 直肠癌术后调强放疗不同照射野数的剂量学研究[J]. 中国辐射卫生, 2019, 28(2): 201-205. Lin F, Zeng ZL, Qin SF, et al. Dosimetric study of different radiation field numbers in postoperative intensity modulated radiation therapy for rectal cancer[J]. Chin J Radiol Health, 2019, 28(2): 201-205. DOI:10.13491/j.issn.1004-714x.2019.02.024 |
| [22] |
Mok H, Crane CH, Palmer MB, et al. Intensity modulated radiation therapy (IMRT): differences in target volumes and improvement in clinically relevant doses to small bowel in rectal carcinoma[J]. Radiat Oncol, 2011, 6: 63. DOI:10.1186/1748-717X-6-63 |
| [23] |
Arbea L, Ramos LI, Martínez-Monge R, et al. Intensity-modulated radiation therapy (IMRT) vs. 3D conformal radiotherapy (3DCRT) in locally advanced rectal cancer (LARC): dosimetric comparison and clinical implications[J]. Radiat Oncol, 2010, 5: 17. DOI:10.1186/1748-717X-5-17 |
| [24] |
Xu BH, Guo YY, Chen YG, et al. Is the irradiated small bowel volume still a predictor for acute lower gastrointestinal toxicity during preoperative concurrent chemo-radiotherapy for rectal cancer when using intensity-modulated radiation therapy[J]. Radiat Oncol, 2015, 10: 257. DOI:10.1186/s13014-015-0566-6 |



