2. 徐州市中心医院 物理计划室;
3. 徐州市中心医院 放疗科;
4. 徐州市中心医院 影像科
2. Xuzhou Central Hospital-Physical Planning Department;
3. Xuzhou Central Hospital-Radiotherapy Department;
4. Xuzhou Central Hospital- Department of Photography
宫颈癌是目前威胁女性生命发病率最高的生殖系统恶性肿瘤,我国是世界上宫颈癌发病率第二大国家,并且发病年龄有着明显的年轻化趋势[1-2]。近年来,放射治疗在宫颈癌的治疗手段中占据越来越重要的地位,由于宫颈癌患者靶器官的解剖位置特殊,许多患者在接受放射治疗时整个盆腔甚至中下腹部几乎均在照射野范围内,使得患者在治疗获益的同时也有许多毒副反应,尤其是急性血液学毒性,严重时甚至会导致治疗的中断或终止,影响患者的预后[3-5]。成年人近一半的活性骨髓位于盆腔骨和腰骶椎[6],而患者在接受放疗时,具有造血功能的活性骨髓受到破坏,而无造血功能的活性骨髓同时也受到破坏不能转化成活性骨髓,导致造血功能下降,血细胞水平降低。雌激素对造血系统功能也有一定程度的影响,雌激素受体缺乏和受体对雌激素不敏感,或雌激素水平不足均可能会影响骨髓的造血活动,从而影响活性骨髓的修复[7-9]。本研究从活性骨髓的体积与剂量学出发,旨在找到能够很好地预测放疗过程中出现 ≥ 3级血液学毒性的相关因素,从而为目标人群的盆腔精准放疗提供参考。
1 材料与方法 1.1 患者资料回顾性分析2017年8月—2019年6月期间在我院行放射治疗的宫颈癌术后患者,本研究共纳入33例患者,均为绝经期、围绝经期妇女,年龄范围:45~65岁,中位年龄54岁,纳入标准:病理类型均为鳞癌;FIGO分期为IA2至IIB2期;治疗前KPS评分 ≥ 70分;放疗前血常规、肝功能、肾功能各项指标在正常范围;放疗前行术后辅助化疗疗2~4周期;末次辅助化疗后、放射治疗前行腹盆腔MRI;未合并其他肿瘤疾病及血液学系统疾病。
1.2 活性骨髓的认定及勾画使用Varian提供的Eclipse10.0计划系统,采用CT与MRI的T1加权图像融合,在T1加权图像上,认为等于或稍高于周围肌肉组织信号的为活性骨髓,勾画在1名影像科副主任医师及2名本科室副主任医师的指导下完成。定义整个盆腔骨为TBM,分为髋部TBM1和腰骶尾部TBM2,TBM1包括髂骨、耻骨、坐骨以及部分照射区区内的股骨近端,TBM2包括腰椎、骶、尾骨,各部位对应的活性骨髓定义为ABM、ABM1、ABM2。危及器官界限定义为PTV上、下扩展1 cm[10],本文列举了1例发生4级血液学毒性事件患者的活性骨髓勾画区域,具体勾画方式见图1、图2。
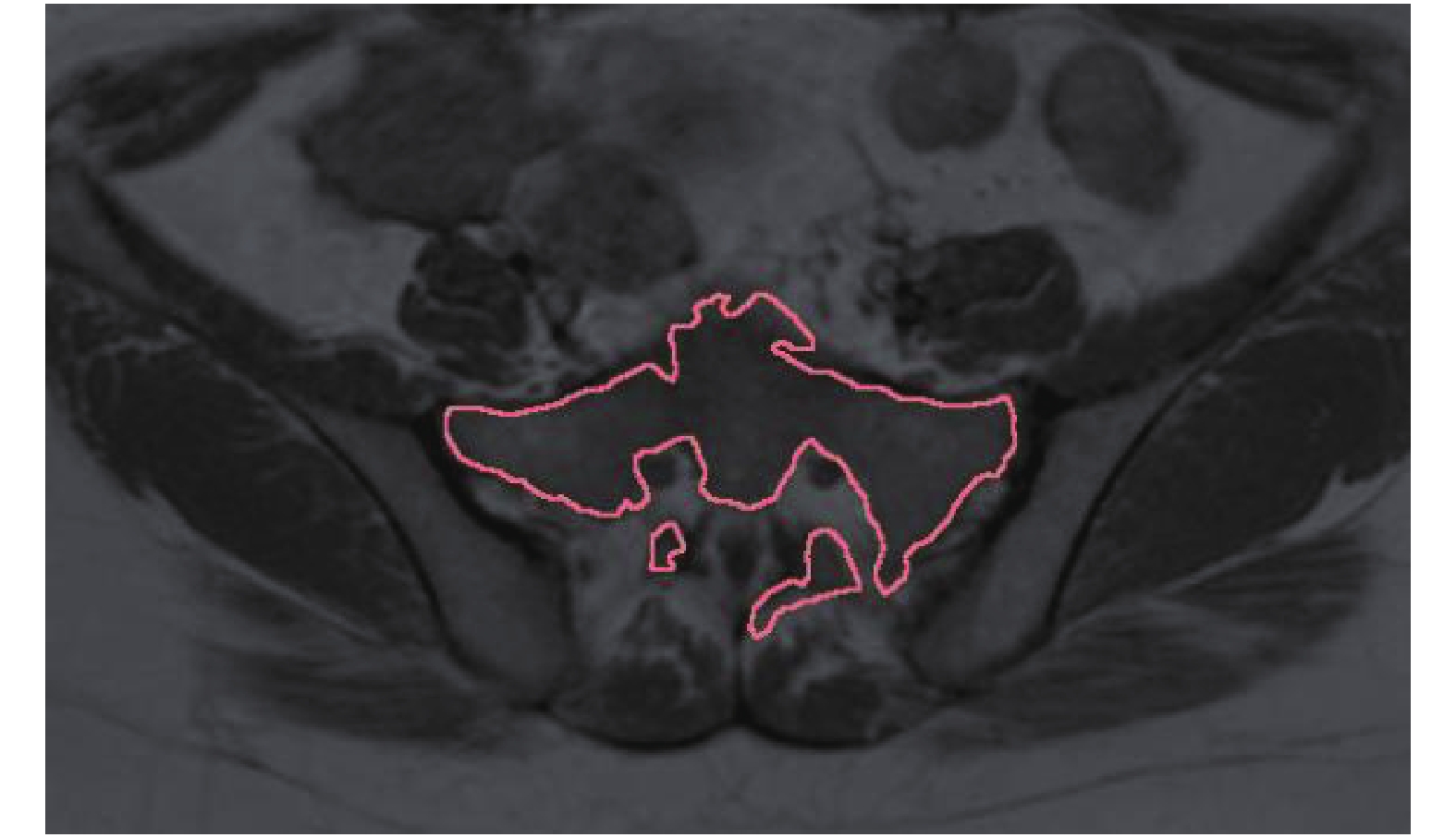
|
图 1 ABM2在MRI T1加权图像上的勾画示例 Figure 1 An example sketch of ABM2 on an MRT1 weighted image |
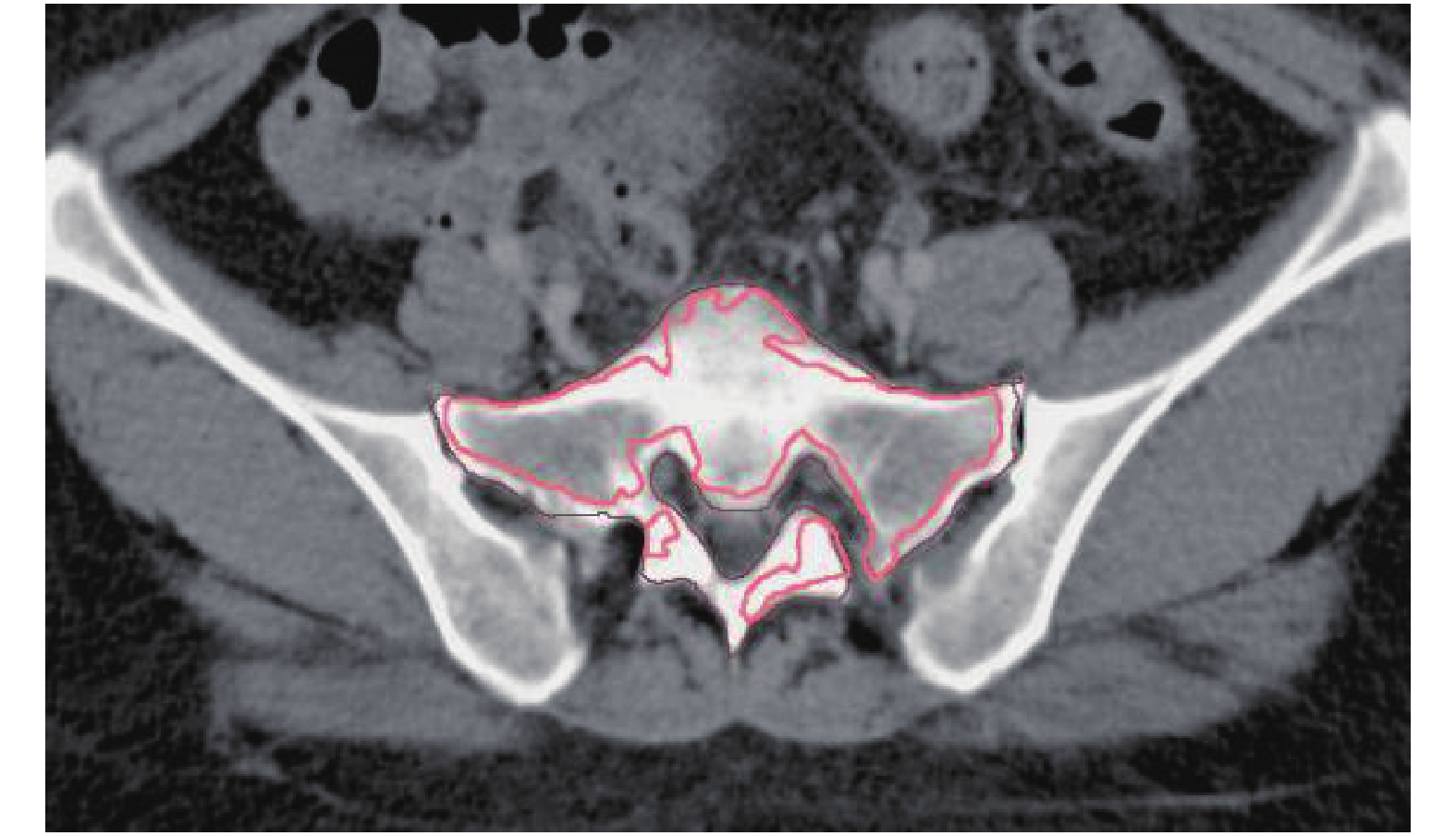
|
图 2 ABM2在CT上的投射区域 Figure 2 The projected area of ABM2 on the CT |
本研究采用“世界卫生组织抗癌药物急性及亚急性毒性反应分度标准”进行血液学毒性分级(详见表1),考虑到临床辅助放化疗治疗的连贯性,本研究中进行评级的血常规采自患者放射治疗开始后至放疗结束后1个月,或下次辅助化疗前,对此期间监测的血常规结果进行评级,采取单次血常规各血液学指标最低值来评定。
|
|
表 1 世界卫生组织抗癌药物急性及亚急性毒性反应分度标准 |
采用SPSS 25软件对数据进行统计学分析。计算资料用均数±标准差表示,血液学毒性等级 ≥ 3级定义为1,≤ 2级定义为0,采用ROC曲线下面积评价TBM、TBM1、TBM2、ABM、ABM1、ABM2体积及ABM、ABM1、ABM2占比(ABM占比用ABM与TBM的比值表示),及各变量的V5~V45、CV5~CV45对预测 ≥ 3级血液学毒性发生的准确性(ABM.CV5表示某患者的照射区活性骨髓ABM受到5 Gy剂量照射的绝对体积,用ABM体积与ABM.V5的乘积表示)。P < 0.05表示差异有统计学意义。用约登指数获取最佳截断值,找到该变量预测血液学毒性的临界值。
2 结 果 2.1 放射剂量及血液学毒性发生情况33例患者接受盆腔外照射剂量均为45 Gy,腔内照射2次,单次剂量5 Gy。共有15例患者发生 ≥ 3级血液学毒性(4例患者发生4级血液学毒性,11例患者发生3级血液学毒性),18例患者发生 ≤ 2级血液学毒性。
2.2 TBM、TBM1、TBM2、ABM、ABM1、ABM2的体积及分布情况见表2。
|
|
表 2 33例患者不同部位骨骼、活性骨髓的体积情况 Table 2 Volume of bone and active bone marrow in different parts of 33 patients |
数据提自DVH直方图,详见图3。
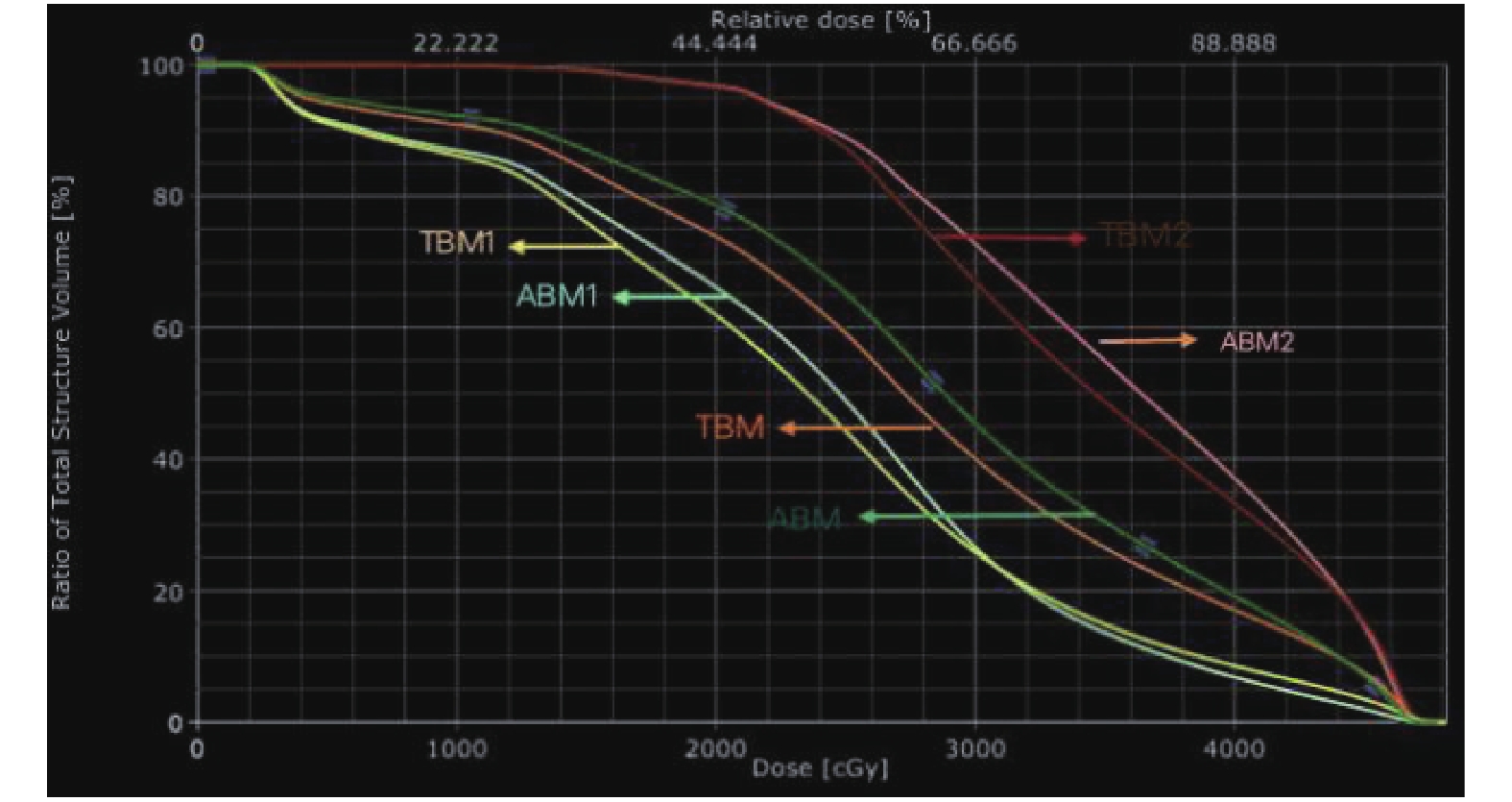
|
图 3 各变量的剂量体积直方图 Figure 3 Dose volume histogram of each variable |
本研究发现,对于围绝经期、绝经期宫颈癌术后患者,腰骶尾部活性骨髓占比、髋部骨骼、髋部活性骨髓、照射区总骨骼、照射区总活性骨髓以及腰骶尾部骨骼的高剂量照射体积百分数能够很好地预测 ≥ 3级血液学毒性的发生(P < 0.05),其中髋部活性骨髓受到40 Gy剂量的绝对体积与 ≥ 3级血液学毒性事件的发生具有明显的相关性( P < 0.05)。本研究中仅列出了有统计学意义的检验变量的ROC分析结果,详见 图4。

|
图 4 对 ≥ 3级血液学毒性事件具有预测价值的ROC曲线分析结果 Figure 4 ROC curve analysis results with predictive value for grade 3 or above hematological toxic events |
利用公式:约登指数=敏感度+特异性−1,获取约登指数最大值对应的截断值为最佳临界点,确定为评估 ≥ 3级血液学毒性事件发生的最佳预测值,结果发现当ABM2占比取临界值65.13%时,敏感度为100%,特异度为50%。TBM1受照射超过30 Gy的体积 ≥ 29.14%时,预测 ≥ 3级血液学毒性的灵敏度为93.93%,特异性为55.60%。详见表3。
|
|
表 3 具有预测价值的各检验变量的ROC曲线分析结果 Table 3 ROC curve analysis results of each test variable with predictive value |
随着医疗不断进步,宫颈癌患者的放射治疗也趋向于精准化,近年来关于盆腔精准放疗的研究越来越多,但由于费用与时间成本的约束以及我国整体医疗环境患多医少的特点,很多研究结果现仅能作为临床参考。李钰[11]、苗慧[12]等研究表明宫颈癌放射治疗中,患者膀胱充盈是否一致以及治疗时的体位均会对正常组织的受照射剂量产生影响,本研究纳入的所有患者均嘱患者照射前饮水400 ml,并憋尿,每次放疗摆位均与与模拟定位时条件一致,这在一定程度上避免了因膀胱充盈度不一致以及体位不同所导致的剂量学误差。杨琦等[13]前瞻性纳入24例根治性同步放化疗的局部晚期宫颈癌患者(年龄18~70岁),发现骨盆活性骨髓的体积能够预测 ≥ 3级血液学毒性发生(P= 0.04)。袁佳等研究[14]纳入了56例宫颈癌根治术后辅助放疗的患者,定义CT上的髓腔为骨髓,得出髂骨骨髓V40与3级以上急性血液血毒性的发生相关,该研究与本研究的结论最为一致,但本研究对活性骨髓的勾画方式与其不同,此外,本研究中还得出髂骨活性骨髓受到40 Gy剂量的绝对体积与 ≥ 3级血液学毒性具有明显的相关性(P< 0.05)。张泽高等[15]研究共纳入189例盆腔恶性肿瘤的患者,包括宫颈癌、前列腺癌、直肠癌,其中宫颈癌患者采用顺铂同步化疗,具体方案未作赘述,将CT上的盆腔骨骨皮质外轮廓作为危及器官,对应本研究中的TBM,研究发现V50、CV50是诊断 ≥ 2级血液学毒性的较好指标,而本研究中33例患者各骨、活性骨髓的危及器官Dmax均 < 50 Gy,CV 50为0。以上研究结果的差异可能源自患者年龄分层、是否有盆腔外靶淋巴结GTV、患者体重、治疗史,末次化疗与放疗之间的骨髓恢复时间窗、是否有同步化疗等,尤其是后两者导致的骨髓代偿反应[16],但结果均表明盆腔各部位骨或活性骨髓与放疗患者治疗期间骨髓抑制等级之间有相关性。
各研究对盆腔骨或靶区骨的定义尚不明确,但主要体现在髋部的股骨头的界定,有些学者在研究时将股骨头包含在总骨量内,有些将股骨头单独作为危及器官进行限量,本文未就这一问题做进一步探讨,因本研究是回顾性分析,左、右股骨头在制定计划时做为单独危及器官进行限量,因此在勾画时未被定义入TBM、ABM、TBM1、ABM1。本研究对6种临床上常见的保护骨髓的勾画方式进行归纳分析,但对病例的筛选具有一定的局限性,相较于其他研究,考虑到雌激素水平与活性骨髓分布模式的年龄相关性[7,17],本研究着重于年龄范围的限定,而未侧重于同步放化疗的归纳研究,因此研究结果的适用面也较窄,但本研究使用最常见的MRI平扫识别活性骨髓,这在临床上相对于FDG-PET、SPECT放射性核素显像节约了部分成本,相对较易于临床工作的开展。
| [1] |
农秋锋. 宫颈癌疫苗及其应用研究进展[J]. 内科, 2020, 15(1): 57-59. |
| [2] |
柴淑霞. 宫颈癌流行病学及高危因素探讨[J]. 世界最新医学信息文摘(电子版), 2017, 17(63): 189-190. |
| [3] |
Sun W Z, Wang T, Shi F, et al. Randomized phase III trial of radiotherapy or chemoradiotherapy with topotecan and cisplatin in intermediate-risk cervical cancer patients after radical hysterectomy[J]. BMC Cancer, 2015, 15: 353. DOI:10.1186/s12885-015-1355-1 |
| [4] |
Green J A, Kirwan J M, Tierney J F, et al. Survival and recurrence after concomitant chemotherapy and radiotherapy for cancer of the uterine cervix: a systematic review and meta-analysis[J]. Lancet, 2001, 358(9284): 781-786. DOI:10.1016/S0140-6736(01)05965-7 |
| [5] |
Torres M A, Jhingran A, Thames H D Jr, et al. Comparison of treatment tolerance and outcomes in patients with cervical cancer treated with concurrent chemoradiotherapy in a prospective randomized trial or with standard treatment[J]. Int J Radiat Oncol, 2008, 70(1): 118-125. DOI:10.1016/j.ijrobp.2007.05.028 |
| [6] |
Vande Berg B C, Malghem J, Lecouvet F E, et al. Magnetic resonance imaging of normal bone marrow[J]. Eur Radiol, 1998, 8(8): 1327-1334. DOI:10.1007/s003300050547 |
| [7] |
Igarashi H, Kouro T, Yokota T, et al. Age and stage dependency of estrogen receptor expression by lymphocyte precursors[J]. Proc Natl Acad Sci U S A, 2001, 98(26): 15131-15136. DOI:10.1073/pnas.011513098 |
| [8] |
Shim G J, Wang L, Andersson S, et al. Disruption of the estrogen receptor beta gene in mice causes myeloproliferative disease resembling chronic myeloid leukemia with lymphoid blast crisis[J]. Proc Natl Acad Sci U S A, 2003, 100(11): 6694-6699. DOI:10.1073/pnas.0731830100 |
| [9] |
张庆红, 曹军, 胡玉珍, 等. 雌激素和雌激素受体参与造血和免疫功能调节的研究进展[J]. 生理科学进展, 2004, 35(3): 277-280. DOI:10.3321/j.issn:0559-7765.2004.03.021 |
| [10] |
Gay H A, Barthold H J, O'Meara E, et al. Pelvic normal tissue contouring guidelines for radiation therapy: a Radiation Therapy Oncology Group consensus panel atlas[J]. Int J Radiat Oncol Biol Phys, 2012, 83(3): e353-e362. DOI:10.1016/j.ijrobp.2012.01.023 |
| [11] |
李钰, 高岩, 刘世龙, 等. 宫颈癌患者的膀胱充盈度一致性对放疗摆位误差的影响[J]. 中国辐射卫生, 2020, 29(3): 305-308. |
| [12] |
苗慧, 施林心, 白海生, 等. 宫颈癌不同体位调强放疗对周围正常组织的辐射剂量学研究[J]. 中国辐射卫生, 2018, 27(4): 381-384. |
| [13] |
杨琦, 汪善兵, 刘佳培, 等. 99Tcm硫胶体-SPECT骨髓显像对局部晚期宫颈癌同步放化疗中血液性毒性的预测
[J]. 国际医学放射学杂志, 2019, 42(4): 405-408. |
| [14] |
袁佳, 常建英, 李凤虎, 等. 宫颈癌术后调强放疗髂骨骨髓受量与血液学毒性相关性研究[J]. 中华肿瘤防治杂志, 2015, 22(21): 1708-1712. |
| [15] |
张泽高, 热伊拉·麦买提伊敏, 哈斯也提·外里, 等. 基于≥2级骨髓抑制盆腔肿瘤放疗骨受剂量体积限制分析[J]. 中华放射肿瘤学杂志, 2019, 28(12): 905-908. DOI:10.3760/cma.j.issn.1004-4221.2019.12.006 |
| [16] |
Noticewala S S, Li N, Williamson C W, et al. Longitudinal changes in active bone marrow for cervical cancer patients treated with concurrent chemoradiation therapy[J]. Int J Radiat Oncol Biol Phys, 2017, 97(4): 797-805. DOI:10.1016/j.ijrobp.2016.11.033 |
| [17] |
Li Z R, Hardij J, Bagchi D P, et al. Development, regulation, metabolism and function of bone marrow adipose tissues[J]. Bone, 2018, 110: 134-140. DOI:10.1016/j.bone.2018.01.008 |




