目前,对辐射暴露人员的损伤评估主要采用常规临床检查,特殊体检包括染色体和微核分析[1-2],但这些指标不能有效的发现辐射所致的早期损伤。随着分子生物学技术的发展,已发现多种辐射敏感的分子指标,而这些研究主要集中在动物模型、细胞模型层面上[3-5],应用到人的辐射损伤评估,有一定的距离。miRNA是一组内源性非编码RNA,广泛存在于真核生物中,在细胞增殖、分化、凋亡及基因调控中起重要作用[6]。因此本研究通过检测不同剂量电离辐射作用后健康成年人外周血miRNA表达变化情况,初步筛选出辐射敏感的分子,为进一步研究辐射早期损伤评估技术提供实验基础。
1 材料与方法 1.1 研究对象选取健康成年男性7人,20~35周岁,近6个月内无放射线接触史,无吸烟和饮酒史,采用肝素钠抗凝管现场每人采集静脉血5 ml。
1.2 照射方式及分组在中国辐射防护研究院放疗科照射,采用60Co远距离治疗机(型号是:GWGP80,生产厂家:中国核动力研究设计院设备制造厂),源皮距为80 cm,照射剂量率为0.50 Gy/min,照射野直径20 cm × 20 cm,辐照剂量分别为0.2 Gy和2.0 Gy,并设假照组。
1.3 miRNA测序、验证不同剂量照射后6 h,采用试剂盒提取miRNA,miRNA测序委托上海康成生物有限公司进行,miRNA测序具体实验过程:样品经琼脂糖凝胶电泳及Nanodrop进行质检定量,构建好文库,用Agilent 2100 Bioanalyzer进行文库质量测定,混合好不同样品的测序文库,通过0.1 M NaOH变性生成单链DNA,在IlluminaNextSeq 500 测序仪上进行51个循环。测序所得数据经质控后进行后续数据分析;设定阈值为1.5倍差异(p ≤ 0.05),来筛选差异表达的miRNA。
1.4 部分miRNA表达水平的验证选取不同剂量共同差异的miRNA分子进行RT-PCR验证,miRNA引物如表1中所示。
|
|
表 1 miRNA引物的列表 |
采用靶基因生物预测数据库mirdbV6和Target Scan7.1预测差异miRNA的靶基因,并筛选两个数据库的交集,以此作为候选的目的靶基因。采用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)对靶基因参与的生物途径进行富集分析。
1.6 统计学方法采用Student t检验(两组间)和方差分析(多组间)进行数据处理,P <0.05,代表差异有统计学意义,所有数据均来源于独立的至少重复3次的实验结果。
2 结果 2.1 不同剂量γ射线作用后人外周血差异miRNA基因表达的变化不同剂量电离辐射作用后6 h,差异miRNA的表达情况是不同的。与对照组相比,0.2 Gy γ射线作用后,显著差异miRNA共有10个,上调2个,下调8个。2.0 Gy照射后,共有21个差异miRNA,上调9个,下调12个,提示辐射敏感的miRNA数量随着照射剂量的增加而增多,表2所示为各组显著上调的前5个分子表达变化情况,其中hsa-miR-23c、hsa-miR-1287-5p、hsa-miR-219a-2-3p、hsa-miR-6511b-3p、has-miR-320d分子在两个剂量组均发生显著变化。
|
|
表 2 不同剂量γ射线作用后显著性差异miRNA分子表达情况 |
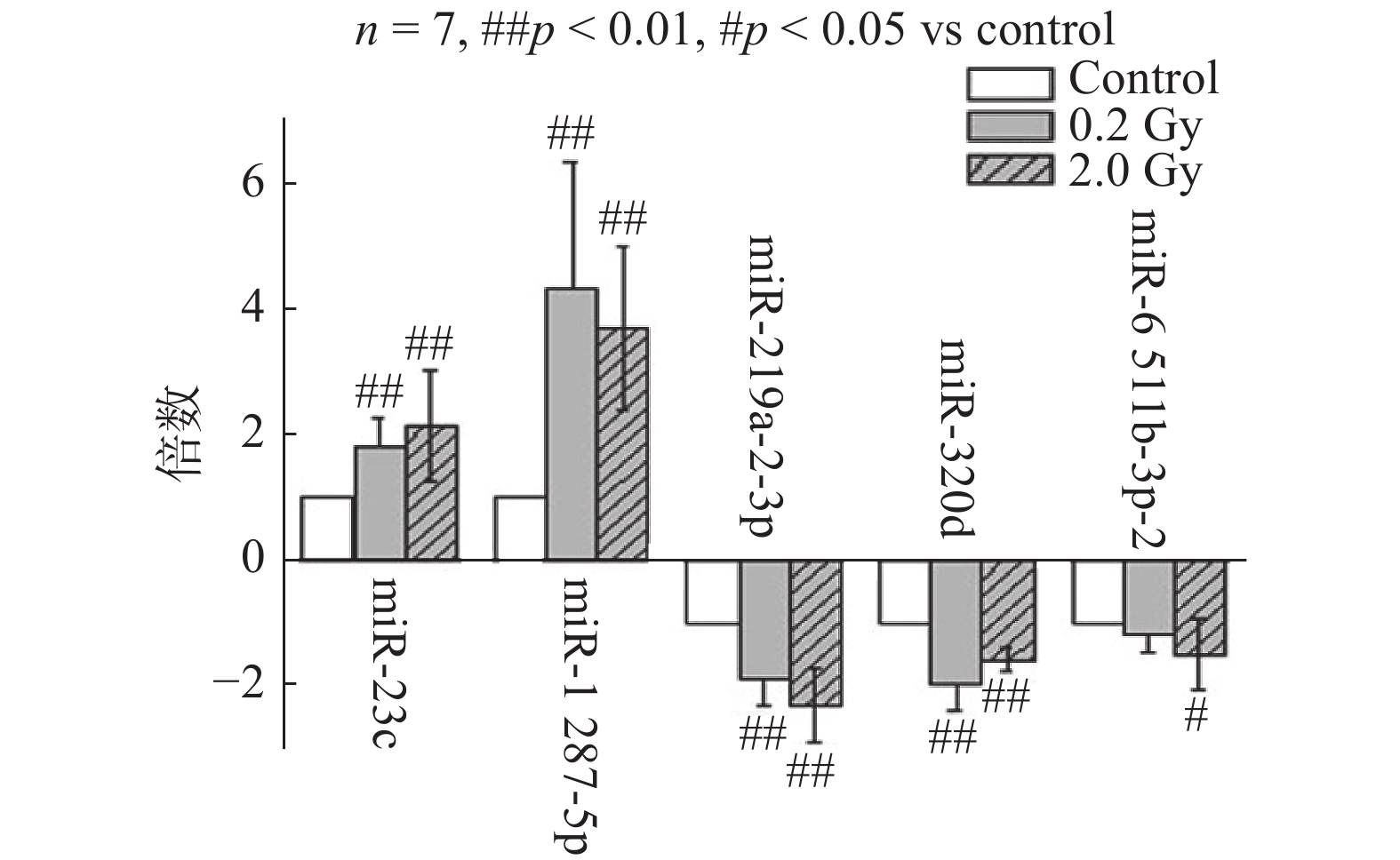
选择在两个剂量组共同发生显著变化(变化倍数 > 1.5,P < 0.05)的5个差异miRNA进行RT-PCR验证,结果如 图1所示。5个miRNA变化趋势与测序结果一致,除hsa-miR-6511b-3p-2 在0.2 Gy组中,与对照组相比无显著差异,其余4个在两个剂量组均有统计学意义,且变化倍数大于1.5倍,分别为miR-23c、miR-1287-5p、miR-219a-3p、miR-320d。验证结果和miRNA测序结果有较高的符合率,说明测序数据可用于进一步的功能分析。
|
图 1 RT-PCR技术检测不同剂量电离辐射作用后显著差异miRNA的表达变化 |
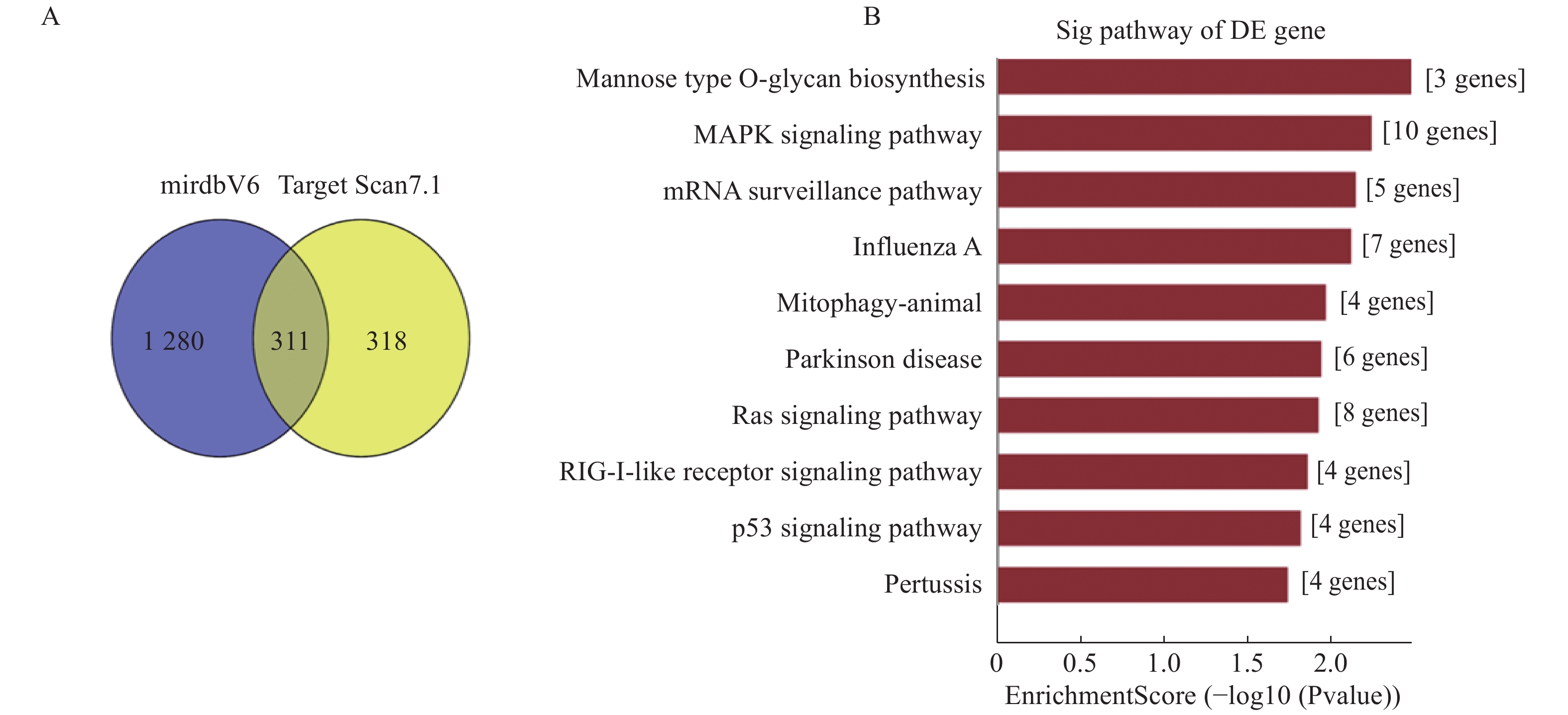
通过mirdbV6和Target Scan7.1数据库预测共同差异miR-23c、miR-1287-5p、miR-219a-3p、miR-320d的靶基因,如图2所示两个数据库中共有的靶基因311个,进一步对靶基因进行显著性通路分析,发现这些靶基因主要富集于与细胞增殖、凋亡和DNA 修复及免疫调控作用有关的MARK、RAS、P53、RIG-I等信号通路。
|
图 2 不同剂量照射后共同差异基因的功能分析 注:A:mirdbV6和Target Scan7.1数据库中miRNA靶基因的交集;B:靶基因参与的信号通路。 |
随着核技术的不断发展,其在工业、农业、医学及研究领域的广泛应用,电离辐射的健康危害成为社会关注焦点。尤其是在发生核辐射突发事件时,能及时、有效地对潜在暴露人员进行剂量估算指导伤员的分类诊断,对于提高应急救援能力、维护社会稳定具有重要意义[7]。电离辐射主要通过诱导机体产生大量自由基,引起多个分子通路基因的改变,影响细胞增殖、细胞周期调控、DNA损伤修复和细胞凋亡等生物学反应,从而导致机体多系统损伤。目前对辐射损伤的评估往往依赖于临床症状(呕吐)、淋巴细胞计数、细胞遗传学分析等手段,但这些方法均存在一定的局限性,如呕吐易受到心理因素影响,使剂量估算的误差率高达190%;淋巴细胞计数在正常人本底值差异较大,易出现假阳性或假阴性;细胞遗学分析技术,实验耗时长达72 h,对技术人员要求高,过程较为繁琐复杂,并且目前这些检测技术对于低剂量电离辐射的损伤的敏感性较差,因此不利于辐射损伤的早期诊断[8-9]。
生物学技术的发展,使得我们有条件应用分子学技术进行辐射损伤的研究。miRNA是一类由内源基因编码的长度约22个核苷酸的非编码单链RNA分子,主要以碱基互补方式与靶基因mRNA的3′非翻译区特异性结合,通过降解mRNA或抑制蛋白翻译合成而实现对靶基因的转录后调控,广泛存在于真核生物中,在细胞增殖、分化、凋亡及基因调控中起着重要作用。人类体液中miRNA耐酸、耐碱、物理性质非常稳定,很适合作为一种生物标志物[10-11]。本研究采用miRNA测序技术筛选γ射线作用后6 h人外周血中差异表达的miRNA,旨在发现辐射损伤早期敏感的miRNA分子。结果发现,0.2 Gy组差异miRNA有10个,2.0 Gy组共有21个差异miRNA。这一结果与Molykutty等研究经不同剂量照全身照射大鼠后6 h的miRNA表达变化趋势一致[12]。李刚强[13]等研究年受照剂量不同的介入工作人员中差异表达的miRNA分子,同样发现随着剂量增加差异miRNA分子数量是增加的,这可能与较大照射剂量激活更多的信号通路,诱导更严重的损伤有关。此外本研究结果发现miR-23c、miR-1287-5p、miR-219a-3p、miR-320d分子表达在两个剂量组均发生显著的变化,提示这4个miRNA分子有望作为辐射损伤的早期诊断指标。
电离辐射会导致细胞凋亡、DNA损伤、抑制免疫系统和造血系统、细胞向癌细胞转化等[5]。通过对本研究发现的共同差异miRNA靶基因生物信息学功能的分析,也发现调控的靶基因主要富集在与细胞增殖、凋亡、DNA损伤修复及免疫调控等过程相关的MARK、RAS、P53、RIG-I等信号通路。这与文献报道[14],电离辐射作用后小鼠空肠转录组差异基因主要富集于DNA损伤修复通路、P53信号通路的结果是相一致的。但这些通路中,具体哪些基因在人外周血受照后发挥作用,在不同剂量电离辐射作用后激活的基因是否一致,还需要进一步的研究。
综上所述,本研究通过对人外周血照射后差异miRNA表达的分析,初步探讨了不同剂量电离辐射作用后差异表达的miRNA分子的表达变化情况,并对其靶基因功能进行了分析,筛选出miR-23c、miR-1287-5p、miR-219a-3p、miR-320d有望作为辐射早期损伤的检测指标,这些miRNA的靶基因主要参与细胞增殖、凋亡、DNA损伤修复及免疫调控等过程,为深入研究miRNA在辐射损伤中的调控机制提供参考。
| [1] |
吕玉民. 染色体畸变在急、慢性辐射损伤评估中的意义专家解析[J]. 中国辐射卫生, 2019, 28(4): 349-354. |
| [2] |
Sproull M T, Camphausen K A, Koblentz G D. Biodosimetry: a future tool for medical management of radiological emergencies[J]. Health Secur, 2017, 15(6): 599-610. DOI:10.1089/hs.2017.0050 |
| [3] |
Li S, Lu X, Feng J B, et al. Identification and validation of candidate radiation-responsive genes for human biodosimetr[J]. Biomed Environ Sci, 2017, 30(11): 834-840. |
| [4] |
李刚强, 濮亚斌, 王寅. 小剂量辐射致小鼠血液中microRNA表达改变[J]. 实用预防医学, 2016, 23(4): 405-408. DOI:10.3969/j.issn.1006-3110.2016.04.007 |
| [5] |
Bugden M, Billing S, Mak K C, et al. Ionizing radiation affects miRNA composition in both young and old mice[J]. Int J Radiat Biol, 2019, 95(10): 1404-1413. DOI:10.1080/09553002.2019.1569771 |
| [6] |
Małachowska B, Tomasik B, Stawiski K, et al. Circulating microRNAs as biomarkers of radiation exposure: a systematic review and meta-analysis[J]. Int J Radiat Oncol Biol Phys, 2020, 106(2): 390-402. DOI:10.1016/j.ijrobp.2019.10.028 |
| [7] |
袁龙, 付熙明, 雷翠萍, 等. 全国核辐射突发事件卫生应急能力现状分析[J]. 中国辐射卫生, 2019, 28(1): 28-32. |
| [8] |
林仲武, 王琪, 王治东. 辐射生物剂量计的研究现状及发展方向[J]. 中华放射医学与防护杂志, 2017, 37(10): 799-802. DOI:10.3760/cma.j.issn.0254-5098.2017.10.015 |
| [9] |
Jacobs A R, Guyon T, Headley V, et al. Role of a high throughput biodosimetry test in treatment prioritization after a nuclear incident[J]. Int J Radiat Biol, 2020, 96(1): 57-66. DOI:10.1080/09553002.2018.1532615 |
| [10] |
Anindo M I, Yaqinuddin A. Insights into the potential use of microRNAs as biomarker in cancer[J]. Int J Surg, 2012, 10(9): 443-449. DOI:10.1016/j.ijsu.2012.08.006 |
| [11] |
李刚强, 朱瑞, 周海亚. 60Coγ辐射致小鼠血液中microRNA表达改变及意义
[J]. 河南预防医学杂志, 2016, 27(6): 401-405. |
| [12] |
Aryankalayil M J, Chopra S, Makinde A, et al. Microarray analysis of miRNA expression profiles following whole body irradiation in a mouse model[J]. Biomarkers, 2018, 23(7): 689-703. DOI:10.1080/1354750X.2018.1479771 |
| [13] |
李刚强, 巢胜吾, 潘瑞林, 等. X射线辐射损伤对介入工作人员血液中miRNA表达的影响[J]. 中国煤炭工业医学杂志, 2017, 20(11): 1301-1304. |
| [14] |
王津晗, 路倩颖, 纪凯华, 等. 基于准路阻侧学的放射性肠损伤基因动态变化[J]. 中华放射医学与防护杂志, 2018, 3(2): 81-85. DOI:10.3760/cma.j.issn.0254-5098.2018.02.001 |




