2. 山东省医学科学院放射医学研究所 山东第一医科大学
2. Institute of Radiation Medicine Shandong Academy of Medical Sciences Shandong First Medical University
随着近年来分子生物学技术的发展,电离辐射导致DNA损伤分子机制研究的不断深入,已发现电离辐射能够诱导转录调节通道网络中的基因表达发生变化,这些基因被称为DNA损伤诱导基因。电离辐射后的基因表达变化被认为是一种潜在的电离辐射生物剂量计。筛选电离辐射损伤基因,研究损伤基因在不同照射剂量和不同照后时间的表达水平变化,研究辐射损伤基因作为检测早期辐射生物标志物的可行性成为放射生物剂量学的研究热点[1-3]。ISG20L1(IFN-stimulated exonuclease gene 20L1)是一个典型的核酸外切酶基因,也叫干扰素诱导基因,又称AEN基因,具有3’-5’核酸外切酶功能,DNA和RNA都是其作用对象,参与核糖体的生物合成[4-5]。ISG20L1是P53依赖的凋亡过程中重要的下游中介,其表达由P53的磷酸化调节。因此,ISG20L1是一个促凋亡基因,在细胞程序性死亡的最后步骤中发挥重要作用。Turtoi在2009年发现ISG20L1在健康人外周血淋巴细胞接受α射线照射后表达明显上调[6]。王治东[7]在2014年利用基因芯片筛选辐射损伤早期生物标志物时发现外周血经0.75、2和6 Gy剂量的X射线照射后2 h,基因表达增加倍数均超过2倍,而且本底水平相对均一的基因有三个:TRIAP1、TRAF4和ISG20L1。Broustas[8]用中子和X射线照射健康献血者的外周血,RT-PCR实时定量检测发现AEN基因剂量效应关系良好,受辐射种类的影响较小。Tilton[9]用2 Gy和10 Gy照射重建的人体皮肤,检测发现AEN基因在照射后3 h和8 h显示高表达。Jin, Y[10]等人在2009年对54名放射工作人员进行辐射照射剂量的调查,结果显示AEN基因可以作为累积照射后的生物标志物。故ISG20L1基因表达的检测有望成为辐射生物剂量测定方法的可行指标。本研究利用实时荧光定量PCR方法,以H-β-actin作为内参基因,研究ISG20L1基因在不同照射剂量和受照后不同时间的表达水平的变化,探究ISG20L1基因作为早期辐射生物标志物的可行性,期望为电离辐射生物剂量估算提供新的实验基础。
1 实验材料及方法 1.1 主要试剂及仪器TRNzol天根生化科技(北京)有限公司,氯仿(国药),DEPC处理水(索莱宝R1600),无水乙醇(国药),反转录试剂盒(TaKaRa, PrimeScript RTreagent kit with gDNA Eraser),qPCR mix(SYBR Green qPCR Master Mix (2×), with ROX,依科赛),qPCR 96孔板(罗氏),封板膜(Axygen),荧光定量PCR仪(罗氏480II),超纯水仪(Millipor synergy),超微量分光光度计(依科赛MINIDROP)。
1.2 血样采集及照射 1.2.1 取样及分组选择无急慢性疾病,不吸烟,无药物滥用史,三个月内无照射史,年龄在23~29周岁的5名非放射工作者作为供血者,2名男性,3名女性,每人采集外周血30 ml于EDTAK2抗凝管中,混匀,将每位供血者的血液分为6组,每组5 ml。
1.2.2 样本照射及培养利用直线加速器装置对抗凝血液样本进行照射,照射剂量为0.5、1.0、2.0、4.0和8.0 Gy,设置0 Gy剂量组为对照组。照射后的人外周血置于37℃,CO2浓度为5%的培养箱中分别培养0、4、8、24、48 h,收集血样,提取总RNA。
1.3 血液总RNA提取及cDNA的反转录血液总RNA的提取采用天根生化科技有限公司的血液总RNA提取试剂盒,运用超微量分光光度计对RNA样品进行浓度测定,并通过核酸电泳鉴定RNA的提取质量。cDNA的合成利用反转录试剂盒完成。
1.4 目的基因的引物设计及验证本研究的目的基因为人ISG20L1基因,所选内参基因为H-β-actin基因。ISG20L1基因全序列来自Gene Bank,实时荧光定量PCR的引物序列设计如表 1,序列合成委托公司完成。
|
|
表 1 ISG20L1基因及H-β-actin基因的RT-PCR引物设计 |
ISG20L1基因的RT-PCR检测分析利用罗氏荧光定量PCR仪完成。每个样品检测3个平行样,同时设立无模板的空白对照,以H-β-actin基因为内参基因,检测结束后输出数据,进行基因相对表达水平的分析。
1.6 统计学分析采用2-△△CT(△CT=CT目的基因-CT内参基因,△△CT=2(-△CT)的相对定量分析方法,以H-β-actin为内参基因。采用方差分析,检验水准为α=0.05。
2 结果 2.1 剂量-效应和时间-效应关系对0~8 Gy剂量范围内,6个剂量点的样本进行ISG20L1基因的实时荧光定量PCR检测。结果显示,与对照组相比,在照射后0.5、1、2、4和8 Gy五个剂量点ISG2OL1基因表达水平均明显增加,相对表达量有统计学意义(F=10.66,P < 0.01)。在受到某个剂量的X射线照射后,ISG20L1基因的相对表达量在照后的不同时间呈现上升趋势,同一剂量点,48 h的表达量最高(表 2)。需要注意的是0 Gy剂量组在0 h的表达量最高,4 h时的相对表达量降低到0 h的36.7%,随后随着时间的延长,ISG20L1基因的表达量呈时间相关性上调,到24 h时,相对表达量与0 h比较无显著性差异,这说明离体外周血的体外培养时间会对ISG20L1基因表达产生一定程度的影响,24 h后这种影响减小。而不同的剂量照射血样后0 h提取RNA,检测ISG20L1表达水平,在不同的剂量点比较无显著性差异,这说明电离辐射导致ISG20L1基因表达改变需要一定的时间,照射后0 h检测相当于本底水平。我们考虑了对照组的时间效应后分析数据,可以看出,电离辐射导致ISG20L1基因表达改变与去除对照组的时间效应之前呈现相同的趋势,不同剂量X射线照射外周血液样本后随着培养时间的延长,相对表达量相应增加,对照组的时间效应不足以影响电离辐射导致的ISG20L1基因改变(表 3,图 1)。同时在照射后某个时间点,在0~4 Gy剂量范围内,随着照射剂量的增加,ISG20L1基因的相对表达随之增加,趋势良好(表 4,图 2),当剂量增大至8 Gy时,ISG20L1基因的表达量在不同的时间点均比4 Gy剂量降低。
|
|
表 2 X射线照射外周血后不同时间点ISG20L1基因的相对表达变化 |
|
|
表 3 去除对照组时间效应后分析不同剂量点ISG20L1基因的相对变化 |
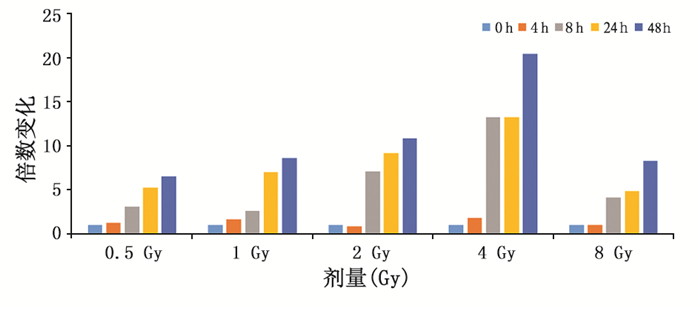
|
图 1 去除对照组的时间效应后,不同剂量的X射线照射后,ISG20L1基因表达随时间变化的趋势 |
|
|
表 4 X射线照射外周血后不同剂量点ISG20L1基因的相对表达变化 |
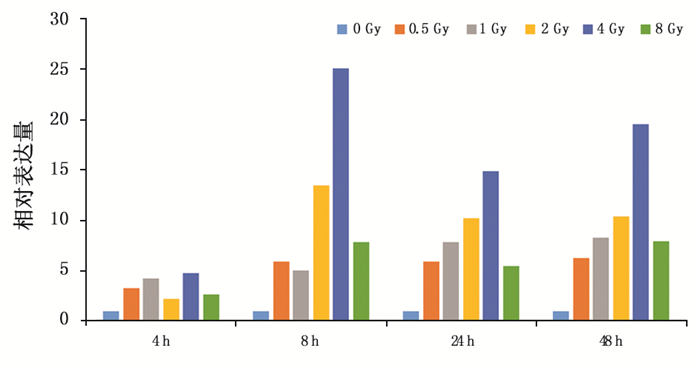
|
图 2 不同时间点,ISG20L1基因表达随照射剂量变化趋势 |
从图 2中可以看出,当照射剂量增大为8 Gy时,ISG20L1基因表达量不再呈上升趋势,去掉8 Gy剂量点,对4个不同的照射后时间点进行线性回归分析,曲线中X轴为照射剂量,Y轴为ISG20L1基因的相对表达水平。拟合曲线如图 3,不同的时间点分别得到拟合方程为:y=0.635 4x+1.191 8,R2=0.433 0(图 3a);y=5.955 9x+1.555,R2=0.978 9(图 3b);y=3.102 5x+3.324,R2=0.908 3(图 3c);y=4.221 4x+2.765 2,R2=0.960 0(图 3d)。在照射后8 h、24 h和48 h,R2值均大于0.9,照射后4 h并未显示明显的剂量效应关系。

|
图 3 照射后4 h(a)、8 h (b)、24 h (c)和48 h (d)剂量-效应曲线及拟合方程 |
理想的生物剂量学指标除了要有好的剂量响应外,还应该遗传背景稳定,本底变异比较低,我们收集了14名健康成人献血者(8名女性,6名男性,年龄在23~33岁之间)血液来检测ISG20L1基因的本底表达水平(图 4),14名献血者的ISG20L1基因的相对表达水平的均值为0.003 73,SD为0.000 9,变异系数为24.9%,变异系数偏大,这应该跟ISG20L1基因的本底表达水平比较低和样本数量少有关系,我们需要增加健康献血者的样本人数来做本底分析。同时我们分析比较8名女性献血者和6名男性献血者的ISG20L1基因的表达水平,做t检验,P=0.71, 两组数据之间无统计学差异,说明在ISG20L1基因的表达水平上在性别之间无显著性差异。因为样本数量限制和献血者年龄主要局限在一个年龄段,所以无法进行年龄差别的分析。

|
图 4 ISG2L1基因本底差异水平分析(F代表女性,M代表男性) |
快速、准确的估算受照人员的辐射生物剂量是实现辐射损伤人员快速准确分类的基础,分子生物学分析技术的发展使快速估算受照剂量变为可能。电离辐射导致的基因表达变化是辐射生物剂量计的研究热点。基因芯片技术的出现方便人们寻找辐射敏感基因,国内外研究人员用基因芯片技术筛选出了很多的辐射敏感基因。目前研究比较多的辐射敏感基因是P53相关基因,众多的P53下游基因相互作用形成了一个巨大的信息网络,参与细胞周期的改变,凋亡或自噬以及DNA的修复[11]。ISG20L1基因是一个促凋亡基因,是P53家族的靶基因,调节遗传毒性应激诱导的自噬[12], 以往的研究认为它具有潜力成为新的生物剂量计[13-16],在本研究中,我们选择了0~8 Gy剂量范围以及0~48 h时间范围作为研究对象,研究了不同照射剂量在照后不同时间的ISG20L1基因表达的研究。结果显示,在0~8 Gy剂量范围内,同一剂量点在照射后不同的时间呈现出随着时间的延长,ISG20L1基因表达持续上调,48 h最高,有良好的时间效应关系,在以后的研究中可以延长培养时间,观察ISG20L1基因表达高峰时间点,为大规模辐射损伤事故后采样估算受照人员剂量提供更好的时间依据。0 Gy剂量照射组(对照组)的ISG20L1基因水平在采样后4 h下降到0 h的36.7%,随后随着培养时间的延长,表达水平相应上调,到24 h基本恢复到0 h的表达水平,这说明了离体外周血液样本中的基因表达代谢动力学特点,在利用基因表达水平分析来估算照射剂量时需要考虑到这一点。我们去除ISG20L1基因离体血液代谢动力学的影响后分析实验数据,可以看出随着照射后培养时间的延长,基因表达持续性上调,离体血液中的基因表达代谢动力学未能影响到电离辐射导致的基因表达上调。同样去除代谢动力学的影响后分析表达量与辐射剂量之间的关系,可以看出在同一时间点,ISG20L1基因随着电离辐射剂量的增加表达呈现上调趋势,但是在剂量超过4 Gy的以后,8 Gy照射剂量点在各个时间点相较于4 Gy照射剂量均有所下降,说明ISG20L1基因适用于4 Gy以下的剂量估算,但是王治东的研究表明剂量在6 Gy时依然呈现良好的剂量效应关系,在接下来的研究中我们可以增加照射剂量点,细化量效关系曲线。分析不同时间点的量效关系发现在电离辐射后4 h基因表达有一定程度上调,但是未能呈现良好的量效关系,而8 h、24 h、48 h时间点,量效关系良好,R2>0.9,说明在照射后8 h取血检测就能估算受照剂量。本次研究表明ISG20L1基因可以作为潜在的生物剂量剂估算受照剂量,但是在本研究中我们只是用人外周血作为实验对象,研究ISG20L1基因表达与辐射剂量之间的量效关系以及时效关系,并未对活体血液进行实验,该实验数据是否能应用于临床估算受照剂量还需要更进一步的研究,进一步细化剂量效应关系曲线,下一步我们计划进行动物活体和离体照射后基因表达改变的比较,并打算收集临床局部放疗或者全身放疗的患者样本进行进一步的研究从而进一步证明ISG20L1基因做为生物剂量学指标估算受照剂量的可行性。
ISG20L1基因的本底表达水平低而且对放射反应良好,0.5 Gy照射后8 h就能观察到2倍以上变化,24 h达到5倍以上,分析了14名健康献血者的本底表达水平后发现男女性别之间无显著性差异,但是整体差异度略高,为24.9%,考虑跟样本数量少和本底表达水平偏低有关系,下一步计划增加样本数量,并扩大献血者的年龄跨度,从而可以进行不同年龄组之间的本底差异的分析。进一步说明IS20L1基因作为生物剂量学指标的可靠性。
| [1] |
LI Shuang, LU Xue, FENG Jiang Bin, et al. Identification and Validation of Candidate Radiation-responsive Genes for Human Biodosimetry[J]. Biomedical and Environmental Sciences, 2017, 30(11): 834-840. |
| [2] |
MacAeva E, Mysara M, de Vos W H, et al. Gene expression-based biodosimetry for radiological incidents:assessment of dose and time after radiation exposure[J]. Int J Radiat Biol, 2019, 95(1): 64-75. DOI:10.1080/09553002.2018.1511926 |
| [3] |
O'Brien G, Cruz-Garcia L, Majewski M, et al. FDXR is a biomarker of radiation exposure in vivo[J]. Sci Rep, 2018, 8: 684. DOI:10.1038/s41598-017-19043-w |
| [4] |
Nguyen L H, Espert L, Mechti N, et al. The human interferon- and estrogen-RegulatedISG20/HEM45Geneproduct degrades single-stranded RNA and DNA in vitro[J]. Biochemistry, 2001, 40(24): 7174-7179. DOI:10.1021/bi010141t |
| [5] |
Couté Y, Kindbeiter K, Belin S, et al. ISG20L2, a novel vertebrate nucleolar exoribonuclease involved in ribosome biogenesis[J]. MolCell Proteomics, 2008, 7(3): 546-559. DOI:10.1074/mcp.M700510-MCP200 |
| [6] |
Turtoi A, Schneeweiss F H A. Effect of 211Atα-particle irradiation on expression of selected radiation responsive genes in human lymphocytes[J]. Int J Radiat Biol, 2009, 85(5): 403-412. DOI:10.1080/09553000902838541 |
| [7] |
王治东, 沈丽萍, 林仲武, 等. 利用基因芯片筛选辐射损伤早期生物标志物[J]. Radiat Res Radiat Process, 2014, 32(5): 1-7. |
| [8] |
Broustas C G, X u, Harken A D, et al. Impact of neutron exposure on global gene expression in a human peripheral blood model[J]. Radiat Res, 2017, 187(4): 443. DOI:10.1667/RR0005.1 |
| [9] |
Tilton S C, Markillie L M, Hays S, et al. Identification of differential gene expression patterns after acute exposure to high and low doses of low-LET ionizing radiation in a reconstituted human skin tissue[J]. Radiat Res, 2016, 186(5): 531. DOI:10.1667/RR14471.1 |
| [10] |
Jin Y-W, Jeong M, Moon K, et al.Possible biomarker gene for radiation workers in hospital[J].Molecular and Cellular Toxicology, 5: 165-171.
|
| [11] |
Lu-Hesselmann J, van Beuningen D, Meineke V, et al. Radiat Prot Dosimetry[J].2006, 122(1-4): 237-243.
|
| [12] |
Eby K G, Rosenbluth J M, Mays D J, et al. ISG20L1 is a p53 family target gene that modulates genotoxic stress-induced autophagy[J]. Mol Cancer, 2010, 9(1): 95. DOI:10.1186/1476-4598-9-95 |
| [13] |
Budworth H, Snijders A M, Marchetti F, et al. DNA repair and cell cycle biomarkers of radiation exposure and inflammation stress in human blood[J]. PLOS One, 2012, 7(11): e48619. DOI:10.1371/journal.pone.0048619 |
| [14] |
Yang H J, Kim N, Seong K M, et al. Investigation of radiation-induced transcriptome profile of radioresistant non-small cell lung cancer A549 cells using RNA-seq[J]. PLOS One, 2013, 8(3): e59319. DOI:10.1371/journal.pone.0059319 |
| [15] |
Turtoi A, Schneeweiss F H A. Effect of 211Atα-particle irradiation on expression of selected radiation responsive genes in human lymphocytes[J]. Int J Radiat Biol, 2009, 85(5): 403-412. DOI:10.1080/09553000902838541 |
| [16] |
Saini D, Shelke S, Mani Vannan A, et al. Transcription profile of DNA damage response genes at G0 lymphocytes exposed to Gamma radiation[J]. Mol Cell Biochem, 2012, 364(1/2): 271-281. |



