电离辐射作为一种高能物理损伤因素,作用于机体引起生物活性分子的电离和激发,导致机体内蛋白、核酸、酶和基因表达的改变,这些改变与机体的损伤程度和辐射剂量相关[1-2]。目前,研究发现越来越多的基因参与电离辐射诱导的机体损伤,并且这些基因表达的改变也影响着细胞的命运[3-4]。研究这些基因在电离辐射损伤中的作用,针对这些基因的特性分析其变化规律,将有可能发展为新的辐射效应分子标志物,作为一种新型的辐射生物剂量计估算辐射剂量[5]。
本研究利用高通量基因芯片(DNA chip)技术对经0.5和2 Gy X射线照射人正常淋巴母细胞AHH-1后6和20h的基因表达情况进行了检测。筛选出X射线照射的辐射诱导差异表达的基因,并通过Real-time PCR对部分差异表达的基因进行了验证。本实验结果为利用电离辐射诱导差异表达的基因作为辐射生物剂量计提供了实验依据。
1 材料与方法 1.1 材料人淋巴母细胞AHH-1由军事医学科学院惠赠;Trizol购买于日本Takara公司;胎牛血清和RPMI 1640培养基购买于美国Gibco公司;直线加速器Varian Clinac 2600C/D购于美国Varian公司;逆转录聚合酶链式反应试剂盒购于加拿大Fermentas公司。
1.2 细胞培养及照射条件AHH-1培养在含10%胎牛血清的1640培养基中,置于37℃ 5% CO2细胞培养箱。照射源采用美国Vavain Clinac 2600C/D直线加速器,照射剂量率为100 cGy/min,产生6 MeV X射线。
1.3 基因芯片分析AHH-1细胞经0.5和2 Gy X射线照射后,置于37℃培养6 h和20 h后,收集细胞,提取总RNA,设立未照射组为对照组。以5 μg总RNA为模板,100 pmol Oligo dT为引物,按照Superscript双链cDNA合成试剂盒进行反转录合成cDNA。参照文献提到的实验方法进行后续探针的标记、杂交以及荧光扫描与基因杂交谱图像分析[6]。
1.4 实时荧光定量PCR(Real-time PCR)AHH-1细胞经0.5和2 Gy X射线照射后,置于37℃培养6 h和20 h后,收集细胞,用Trizol提取细胞中的总RNA,然后用QuantiTect反转录试剂盒将mRNA反转录成cDNA。使用SYBR Green预混合物,添加引物和模板,每个PCR反应的总体积为10 μl。RT-PCR反应程序:95℃10 min激活DNA聚合酶;95℃ 15 s,60℃ 30 s,共40个循环;设置溶解曲线程序。RT-PCR反应中所用引物见表 1。
|
|
表 1 RT-PCR反应中所用引物 |
数据采用SPSS 17.0软件进行处理,数据以均数±标准差(x±s)表示,组间比较采用t检验分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 AHH-1细胞经0.5和2 Gy X射线照射后辐射差异表达基因数目从表 2可以看出,AHH-1细胞经0.5和2 Gy X射线照射6 h后,提取总RNA经基因芯片分析,发现和未照射组细胞相比差异表达的基因分别有1 250和1 773个;经0.5和2 Gy X射线照射20 h后,差异表达的基因分别有1 076和690个。X射线照射影响AHH-1细胞多种基因的表达,且不同剂量及照射后不同时间对基因的表达均有影响。
|
|
表 2 0.5和2Gy X射线照射AHH-1细胞后差异表达基因数目 |
表 3—表 6统计了AHH-1细胞经0.5和2 Gy X射线照射后部分差异表达的基因,可以看出AHH-1细胞经0.5和2 Gy照射后差异表达的基因不同,其中2 Gy X射线照射后差异表达的基因主要参与细胞凋亡、细胞增殖和细胞周期阻滞等过程,如BAX、CDKN1A、TP53I3;而0.5 Gy X射线照射后差异表达的基因主要涉及细胞间信号传导、内环境稳态和DNA损伤修复相关通路,如JUN、BCL6、ATM等。此外,AHH-1细胞经X射线照射后差异基因表达的倍数变化幅度较大,从下调17.93倍到上调23.61倍。表 7统计了AHH-1细胞经0.5和2 Gy X射线照射后部分共同差异表达的基因,其中在0.5和2 Gy照射6 h后PERP基因的表达均下调,前期研究表明PERP基因属于PMP-22/gas3家族,是p53/p63凋亡刺激因子,具有抑制肿瘤和促凋亡的作用,本研究首次发现PERP在辐射损伤中起作用。
|
|
表 3 0.5 Gy X射线照射AHH-1细胞后6 h部分差异表达的基因 |
|
|
表 4 0.5 Gy X射线照射AHH-1细胞后20 h部分差异表达的基因 |
|
|
表 5 2 Gy X射线照射AHH-1细胞后6 h部分差异表达的基因 |
|
|
表 6 2 Gy X射线照射AHH-1细胞后20 h部分差异表达的基因 |
|
|
表 7 0.5和2 Gy X射线照射AHH-1细胞后6和20 h部分共同差异表达的基因 |
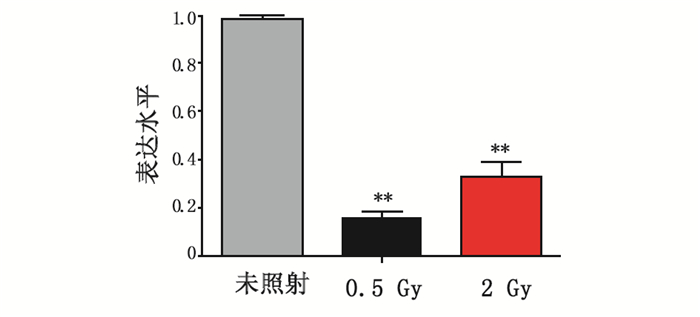
通过RT-PCR验证AHH-1细胞经0.5和2 Gy X射线照射6 h后PERP基因的表达情况,从图 1中可以看出,其表达水平与基因芯片结果趋势一致,和对照组相比,显著下调(P < 0.01)。
|
图 1 RT-PCR验证PERP表达水平 注:**与对照组比较,P < 0.01。 |
随着核能和辐射技术在工业和医学诊断、治疗中应用的增加,伴随产生的电离辐射对人类健康和生活环境的影响也越来越受到人们的关注,因此研究电离辐射的生物效应机制具有重要的意义[7-8]。本研究利用基因芯片技术对经0.5和2 Gy X射线照射AHH-1细胞的基因表达谱进行了检测,筛选出了X射线照射的辐射诱导差异表达的基因,对部分差异表达基因的表达水平进行了验证,初步探讨了辐射诱导的生物效应机制。
本研究发现0.5 Gy X射线照射人正常淋巴母细胞AHH-1 20 h后MAPK8IP2基因表达上调,MAPK8IP2基因又称JIP2基因,在p38 MAPK级联反应中起着关键作用[9]。前期也有研究表明MAPK信号通路介导低剂量辐射细胞反应,本研究结果与之前的结论一致[10-11]。ATM是一种丝氨酸/苏氨酸蛋白激酶,属于PI3K家族,主要功能是感应DNA损伤信号,磷酸化其下游靶基因启动损伤DNA修复过程[12]。当细胞受到电离辐射损伤时,ATM基因被激活,通过多种途径促进DNA损伤修复和细胞存活[13]。本研究中发现AHH-1细胞经0.5 Gy X射线照射20 h后ATM基因表达上调,ATM激活应答辐射诱导的DNA损伤。
AHH-1细胞经2 Gy X射线照射后,DDB2、CDKN1A、BAX、BBC3等基因表达上调,这些基因主要参与细胞凋亡和细胞分化等过程。CDKN1A(P21)是最先被发现的细胞周期依赖激酶抑制因子,位于p53基因的下游,活化的p53转录激活p21表达,具有负调控细胞周期的作用,允许损伤的DNA进行修复[14-15]。此外,p21可以通过与周期蛋白CDK复合物及PCNA结合,影响PCNA与DNA修复蛋白的结合,抑制DNA修复[16]。
DNA损伤结合蛋白(damage-specific DNA-binding protein 2,DDB2)是一类进化保守的DNA修复酶,参与DNA损伤识别,能被UV和X射线照射后激活,可以识别嘧啶二聚体促进DNA损伤修复[17]。实验结果表明,与未照射组相比,该基因在2 GyX射线照射6 h后,其表达水平上调2.3倍。前期研究表明DDB2能够通过抑制p21Waf1/Cip1表达,在DNA损伤时发挥促凋亡作用[18-19]。本研究中DDB2和CDKN1A经2 Gy X射线照射后显著上调,其表达指标能否作为标志生物受照剂量的指标也值得进一步探讨。2 Gy X射线照射AHH-1细胞差异表达的基因在DNA损伤修复、细胞凋亡和细胞周期调节过程中发挥作用。
本研究发现PERP基因参与辐射诱导的DNA损伤反应。从表 3和表 5中可以看出,与对照组相比,AHH-1细胞经X射线照射后6 h,PERP基因表达均下调。并且经Real-time PCR验证与基因芯片结果的一致,表达趋势相同,呈下降趋势。前期研究表明PERP基因是p53凋亡刺激因子,在凋亡发生前caspase级联反应过程中发挥着重要的作用,参与细胞凋亡过程[20]。本研究中首次发现在AHH-1细胞中PERP与辐射损伤应答相关,需要在其他的细胞系和宽泛的辐射剂量中研究PERP基因的表达情况与辐射剂量的关系,探讨其功能及分子作用机制,为进一步研究辐射生物标志物提供了理论依据。
| [1] |
Tubbs A, Nussenzweig A. Endogenous DNA damage as a source of genomic instability in cancer[J]. Cell, 2017, 168(4): 644-656. DOI:10.1016/j.cell.2017.01.002 |
| [2] |
Smirnov D A, Morley M, Shin E, et al. Genetic analysis of radiation-induced changes in human gene expression[J]. Nature, 2009, 459(7246): 587-591. DOI:10.1038/nature07940 |
| [3] |
尹晶晶, 秦秀军, 张伟, 等. 大鼠外周血淋巴细胞2 Gy γ射线照射后12 h差异基因表达谱的研究[J]. 中国辐射卫生, 2013, 22(3): 267-269. |
| [4] |
Cash H, Dean D. The effects of low-dose radiation on articular cartilage:a review[J]. J Biol Eng, 2019, 13: 1. DOI:10.1186/s13036-018-0125-4 |
| [5] |
Balog R P, Bacher R, Chang P, et al. Development of a biodosimeter for radiation triage using novel blood protein biomarker panels in humans and non-human primates[J]. International Journal of Radiation Biology, 2019, 1-13. |
| [6] |
李洁清, 李坤, 封丽, 等. X射线照射AHH-1细胞基因表达转录谱变化研究[J]. 中国职业医学, 2013, 40(5): 420-426. |
| [7] |
陈忠民, 刘波, 南新中, 等. 低剂量电离辐射损伤检测技术及其研究进展[J]. 中国辐射卫生, 2017, 26(2): 254-256. |
| [8] |
王畅, 黎金荣, 莫素芳, 等. 放射工作人员淋巴细胞微核异常影响因素的病例对照研究[J]. 中国辐射卫生, 2018, 27(3): 209-212. |
| [9] |
Long XH, Zhao ZQ, He XP, et al. Dose-dependent expression changes of early response genes to ionizing radiation in human lymphoblastoid cells[J]. Int J Mol Med, 2007, 19(4): 607-15. |
| [10] |
Premkumar K, Shankar B S. Involvement of MAPK signalling in radioadaptive response in BALB/c mice exposed to low dose ionizing radiation[J]. International Journal of Radiation Biology, 2016, 92(5): 249-262. DOI:10.3109/09553002.2016.1146829 |
| [11] |
Kita K, Sugita K, Sato C, et al. Extracellular release of annexin A2 is enhanced upon oxidative stress response via the p38 MAPK pathway after low-dose X-ray irradiation[J]. Radiation Research, 2016, 186(1): 79-91. DOI:10.1667/RR14277.1 |
| [12] |
Jazayeri A, Falck J, Lukas C, et al. ATM-and cell cycle-dependent regulation of ATR in response to DNA double-strand breaks[J]. Nat Cell Biol, 2006, 8(1): 37-45. DOI:10.1038/ncb1337 |
| [13] |
Balmus G, Pilger D, Coates J, et al. ATM orchestrates the DNA-damage response to counter toxic non-homologous end-joining at broken replication forks[J]. Nat Commun, 2019, 10: 87. DOI:10.1038/s41467-018-07729-2 |
| [14] |
Fischer M, Quaas M, Steiner L, et al. The p53-p21-DREAM-CDE/CHR pathway regulates G2/M cell cycle genes[J]. Nucleic Acids Res, 2016, 44(1): 164-174. DOI:10.1093/nar/gkv927 |
| [15] |
Nukina K, Hayashi A, Shiomi Y, et al. Mutations at multiple CDK phosphorylation consensus sites on Cdt2 increase the affinity of CRL4Cdt2 for PCNA and its ubiquitination activity in S phase[J]. Genes Cells, 2018, 23(3): 200-213. DOI:10.1111/gtc.12563 |
| [16] |
Budworth H, Snijders AM, Marchetti F, et al. DNA repair and cell cycle biomarkers of radiation exposure and inflammation stress in human blood[J]. PLoS One, 2012, 7(11): e48619. DOI:10.1371/journal.pone.0048619 |
| [17] |
Cazzalini O, Perucca P, Mocchi R, et al. DDB2 association with PCNA is required for its degradation after UV-induced DNA damage[J]. Cell Cycle, 2014, 13(2): 240-248. DOI:10.4161/cc.26987 |
| [18] |
Zou N, Xie G Z, Cui T T, et al. DDB2 increases radioresistance of NSCLC cells by enhancing DNA damage responses[J]. Tumor Biol, 2016, 37(10): 14183-14191. DOI:10.1007/s13277-016-5203-y |
| [19] |
Xue B. Coordination between p21 and DDB2 in the cellular response to UV radiation[J]. PLoS One, 2013, 8(11): e80111. DOI:10.1371/journal.pone.0080111 |
| [20] |
Singaravelu K, Devalaraja-Narashimha K, Lastovica B, et al. PERP, a p53 proapoptotic target, mediates apoptotic cell death in renal ischemia[J]. American Journal of Physiology-Renal Physiology, 2009, 296(4): F847-F858. DOI:10.1152/ajprenal.90438.2008 |




