2. 吉林大学第二医院放射线科;
3. 吉林大学第二医院放疗科
2. Department of Radiology, Second Hospital of Jilin University;
3. Department of Radiotherapy, Second Hospital of Jilin University
ATRX(alpha thalassemia/mental retardation syndrome X-inked protein)蛋白是SWI2/SNF2蛋白家族的成员,具有广泛的生物学作用,能够影响染色质重组以及在修复DNA损伤、调节转录等过程中发挥作用,而且对调节肿瘤细胞端粒不正常延长(Alternative Lengthening of Telomeres,ALT)有重要影响[1-3]。H2AX可以作为DNA双链断裂的标志,用荧光标记其磷酸化表达后,计数荧光焦点的个数,从而得出辐射剂量与DSB数量的关系[4-5]。人类RAD51蛋白在同源重组修复中,是催化断裂的DNA双链与完整的同源DNA姐妹链进行链间转移置换的关键酶,RAD51蛋白表达的失调可促进肿瘤的发生和发展。本研究通过RNAi靶向沉默H460细胞中ATRX,进而检测细胞增殖、γH2AX和RAD51的焦点形成,以及PARP1、γH2AX和RAD51蛋白的表达,判断沉默ATRX后辐射对增殖及DNA辐射损伤修复的影响,明确二者的相互关系,进一步为基因放射治疗肿瘤提供新的支撑和实验证据。
1 材料与方法 1.1 主要实验试剂和仪器人肺癌H460细胞和293T细胞由本实验室保存,MEM培养基和胎牛血清(美国Gibco公司),质粒转染采用转染试剂Hieff-TransTM(上海翊圣生物科技有限公司),青链霉素(Thermo Fisher scientific公司,美国),兔多克隆一抗包括ATRX、磷酸化H2AX(γH2AX)、Rad51、poly ADP-ribose polymerase 1(PARP1)和GAPDH(Santa Cruz公司,美国),红色荧光标记的抗兔二抗(CST公司,美国),HRP标记的抗兔二抗(Immunoway公司,美国),嘌呤霉素(Sigma公司,美国),X-RAD 320i X射线辐照仪(Precision X-ray公司,美国),SDS-PAGE系统(BioRad公司,美国)。
1.2 靶向沉默ATRX的H460细胞的获得靶向ATRX的3段shRNA的序列分别为ATCCTCAAGAGGTTGAATC、TTTCTTATGTTCACCACCG和TTATCTTGTGGAACTTCCT。分别构建到pGIPz载体上,设立shControl对照,采用293T细胞进行病毒包装,按照质量shRNA :pSPAX2 :pMD2G=2 :1 :1进行质粒转染,所用试剂为Hieff TransTM转染试剂,48 h后收取1次病毒,72 h后收取2次病毒,0.45 μm滤膜过滤后感染H460细胞,利用嘌呤霉素进行阳性筛选,所得细胞模型命名为shControl-H460、shATRX1-H460、shATRX2--H460和shATRX3-H460,并提取总蛋白后Western blot进行沉默效率验证,同时逐渐将细胞扩大并冻存液氮中备用。
1.3 克隆形成实验分别将shcontrol-H460、shATRX2-H460和shATRX3-H460细胞接种于6孔板中,接种密度为每孔80、200、800、4 000和20 000个细胞,12 h后进行0、2、4、6和8 Gy照射,并继续培养10 d,利用带有甲醛的吉姆萨染液染色后进行克隆计数,按照存活分数(survival fraction,SF)=受到一定剂量照射的克隆数/(接种的单个细胞数×PE),PE为未照射时形成的集落数与接种的单个细胞数,绘制SF与照射剂量的关系图,评价细胞增殖能力。
1.4 免疫荧光检测γH2AX和Rad51焦点形成分别将shControl-H460和shATRX3-H460细胞接种于放置了盖玻片的6孔板中,按照1 × 105个/孔,12 h后进行4 Gy X射线照射,于0、0.5、1、3和6 h固定(4%多聚甲醛),2% BSA + 0.3% TritonX100封闭1 h,γH2AX和Rad51一抗(1:500)4℃过夜孵育,PBS洗5次,每次5 min,红色荧光二抗(1 :1 000)室温孵育1 h,PBS洗5次,每次5 min,8 μl的DAPI滴加到载玻片上,封片后荧光显微镜下观察γH2AX和Rad51焦点形成,并随机选取5个视野,每个视野选择5个细胞,计数焦点数。
1.5 Western blot按照实验分组,shcontrol-H460和shATRX3-H460细胞接种于6孔板,80%~90%融合后进行4 Gy X射线照射,0、0.5、1、3和6 h收样并提取总蛋白,100 ℃变性蛋白,SDS-PAGE电泳,4℃过夜转膜,5%脱脂奶粉封闭1 h后,ATRX、PARP1、γH2AX、Rad51和GAPDH(1:1 000)一抗,37℃孵育2 h后TBST洗3次,每次10 min,加入HRP标记的二抗(1:3 000)后37℃孵育1 h,TBST洗3次,利用ECL发光液在暗室中反应并曝光,拍照分析。
1.6 统计学处理γH2AX和Rad51焦点数以x±s表示,利用SPSS 24.0统计软件t检验进行分析,P < 0.05表示差异具有统计学意义。
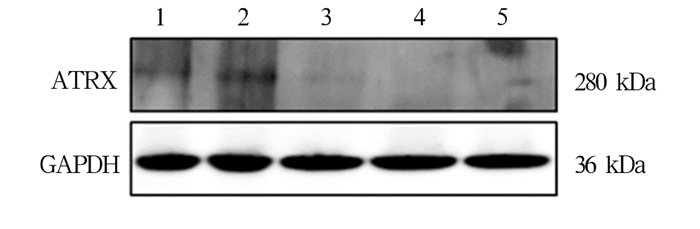
2 结果 2.1 ATRX沉默效率判定由图 1可见,泳道1和泳道2中ATRX表达正常,而在泳道3~5可见ATRX蛋白低表达,说明沉默ATRX的细胞模型建立成功。
|
图 1 Western blot检测各种细胞模型中ATRX蛋白的表达 注:泳道1:H460;泳道2:shControl-H460;泳道3:shATRX1-H460;泳道4:shATRX2-H460;泳道5:shATRX3-H460 |
由图 2可见,0、2、4、6和8 Gy照射后shATRX2-H460和shATRX3-H460细胞的存活分数均较shControl-H460细胞的存活分数低,提示其增殖能力的降低,且shATRX2-H460和shATRX3-H460之间无明显差异。

|
图 2 不同剂量照射后细胞存活分数的变化 |
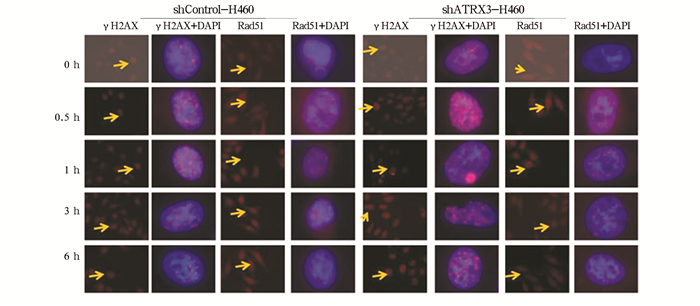
由图 3可见,荧光显微镜下4 Gy照射后shControl-H460和shATRX3-H460组细胞中γH2AX和Rad51焦点形成,分别计数0~6 h γH2AX和Rad51焦点数,shControl-H460和shATRX3-H460组细胞中γH2AX在1 h时最多,而Rad51焦点数在3 h时最多,且均显著高于0 h时(P < 0.001),而后逐渐降低,与shControl-H460细胞比较,在1和6 h时shATRX3-H460细胞γH2AX焦点,以及1、3和6 h时Rad51焦点显著增多(P < 0.05,P < 0.01),见表 1。
|
图 3 荧光显微镜观察4 Gy照射后0 ~ 6 h的γH2AX和Rad51焦点形成 |
|
|
表 1 4 Gy照射后0 ~ 6 h的γH2AX和Rad51焦点数的变化(n=25,x±s) |
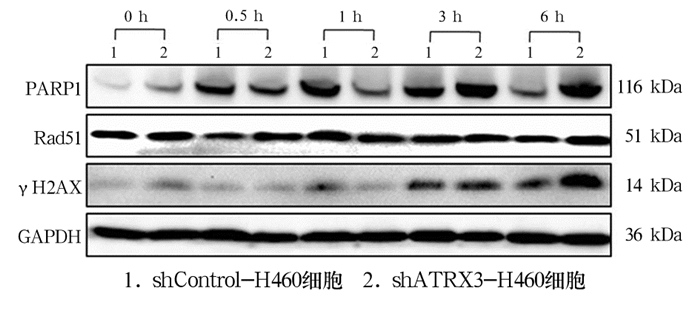
由图 4可见,4 Gy照射后3和6 h,shATRX3-H460细胞中PARP1、Rad51和γH2AX蛋白表达均高于shControl-H460细胞,提示DNA损伤后修复的较慢。
|
图 4 Western blot法检测4 Gy X射线照射后PARP1、γH2AX和Rad51蛋白表达 |
肿瘤基因—放射治疗研究是辐射肿瘤学相关研究的热门,如何提高肿瘤细胞放射敏感性成为相关学科研究的热点。DNA是辐射的敏感靶点,损伤后可导致DNA单链断裂(Single strand breaks,SSB)、双链断裂(double strand breaks,DSBs)、碱基的修饰和丧失碱基位点等,其中DSB最严重[6-8]。而且,主要通过同源重组(homologous recombination,HR)和非同源末端连接(Non-Homologous end joining,NHEJ)完成损伤修复。遵循DNA损伤,修复不能成功,影响细胞生存的基本思路,将DNA损伤及其修复作为肿瘤基因放射治疗的靶点[9]。DNA损伤修复涉及到非常多的基因,ATRX基因具有维持DNA结构和直接连接到双链断裂位点等功能,是重要的DNA损伤修复基因[10-11]。本研究中利用靶向ATRX基因的慢病毒感染H460细胞获得靶向沉默ATRX的稳定细胞模型,Western blot结果显示,3条靶向序列具有较好的沉默效果,可作为候选细胞进行后续研究。
电离辐射的重要的靶点包括细胞膜、细胞核和细胞器等,电离辐射时,DNA的DSB与染色体结构和辐射相关因素有关[12]。而且,肿瘤的放射治疗中,射线损伤DNA,继而导致修复障碍,从而导致细胞死亡而抑制细胞的增殖[13]。HR和NHEJ损伤修复时,涉及到多种信号通路,Rad51蛋白是HR的关键酶,是损伤的感应器和周期检查点关键蛋白,此外,还需要交叉互补修复基因2(X- ray repair cross-complementing gene 2,XRCC2)蛋白共同完成[14]。而电离辐射引起的DSBs均伴随γH2AX的簇集,且γH2AX核灶形成没有细胞特异性。Rad51和γH2AX的焦点形成均可以作为判断DNA损伤修复程度的指标。
本研究中发现,shControl-H460、shATRX2-H460和shATRX3-H460细胞在照射后存活分数存在差异,后2者的SF在相同剂量照射后明显降低,暗示着增殖被抑制,可能具有较高的放射敏感性。继而将shControl-H460和shATRX3-H460细胞作为研究对象,4 Gy照射后0~6 h内,γH2AX和Rad51焦点的形成在2种细胞间存在明显的差异,分别在1和3 h时达到最大值,并逐渐消退。γH2AX和Rad51焦点数是研究辐射损伤DNA导致DNA链断裂的重要指标,而且PARP1也是重要的调控DNA损伤修复的因子[13],本研究也证实辐射后ATRX缺失的H460细胞中PARP1、γH2AX和Rad51蛋白表达也具有明显的差异,提示细胞激活DNA损伤修复后,修复比对照组缓慢,这也是其导致细胞增殖变慢的原因之一。
综上所述,本研究所进行的ATRX靶向RNAi,可以实现ATRX蛋白低或无表达,并且能够抑制H460细胞增殖,可能与辐射所致的DNA损伤修复能力降低,进而导致细胞死亡有关,为临床肿瘤的放疗提供一个新的参考和实验数据。
| [1] |
Ramamoorthy M, Smith S. Loss of ATRX suppresses resolution of telomere cohesion to control recombination in ALT cancer cells[J]. Cancer Cell, 2015, 28(3): 357-369. DOI:10.1016/j.ccell.2015.08.003 |
| [2] |
Scott H S. Loss of ATRX, genome instability, and an altered DNA damage response are hallmarks of the alternative lengthening of telomeres pathway[J]. PLoS Genet, 2012, 8(7): e1002772. DOI:10.1371/journal.pgen.1002772 |
| [3] |
de Wilde R F, Heaphy C M, Maitra A, et al. Loss of ATRX or DAXX expression and concomitant acquisition of the alternative lengthening of telomeres phenotype are late events in a small subset of MEN-1 syndrome pancreatic neuroendocrine tumors[J]. Mod Pathol, 2012, 25(7): 1033-1039. DOI:10.1038/modpathol.2012.53 |
| [4] |
Kuefner MA, Brand M, Engert C, et al. Radiation Induced DNA Double-Strand Breaks in Radiology[J]. Rofo, 2015, 187(10): 872-878. DOI:10.1055/s-0035-1553209 |
| [5] |
李世龙, 刘波, 陈文忠, 等. C形臂X射线机扫描对小鼠的辐射损伤研究[J]. 中国辐射卫生, 2015, 24(1): 56-58. |
| [6] |
Alipoor A, Fardid R, Sharifzadeh S. Evaluating Gamma-H2AX Expression as a Biomarker of DNA Damage after X-ray in Angiography Patients[J]. J Biomed Phys Eng, 2018, 8(4): 393-402. |
| [7] |
何楚琦, 王月, 龙鼎新. 电磁辐射对中枢神经系统的影响及机制[J]. 中国辐射卫生, 2017, 26(3): 381-384. DOI:10.3969/j.issn.1004-714X.2017.03.038 |
| [8] |
蒋超, 张鹏程, 王晓炜, 等. 二甲双胍对肺癌细胞A549放疗增敏作用及机制研究[J]. 中国辐射卫生, 2017, 26(6): 718-722. DOI:10.3969/j.issn.1004-714X.2017.06.027 |
| [9] |
Ceccaldi R, Rondinelli B, D'Andrea A D. Repair pathway choices and consequences at the double-strand break[J]. Trends in Cell Biology, 2016, 26(1): 52-64. DOI:10.1016/j.tcb.2015.07.009 |
| [10] |
Voon H P J, Hughes J R, Rode C, et al. ATRX plays a key role in maintaining silencing at interstitial heterochromatic loci and imprinted genes[J]. Cell Reports, 2015, 11(3): 405-418. DOI:10.1016/j.celrep.2015.03.036 |
| [11] |
Noh K M, Maze I, Zhao D, et al. ATRX tolerates activity-dependent histone H3 methyl/phos switching to maintain repetitive element silencing in neurons[J]. Proc Natl Acad Sci USA, 2015, 112(22): 6820-6827. DOI:10.1073/pnas.1411258112 |
| [12] |
Wood R D, Doublié S. DNA polymerase θ (POLQ), double-strand break repair, and cancer[J]. DNA Repair, 2016, 44: 22-32. DOI:10.1016/j.dnarep.2016.05.003 |
| [13] |
Chua M L K, Horn S, Somaiah N, et al. DNA double-strand break repair and induction of apoptosis in ex vivo irradiated blood lymphocytes in relation to late normal tissue reactions following breast radiotherapy[J]. Radiat Environ Biophys, 2014, 53(2): 355-364. DOI:10.1007/s00411-014-0531-z |
| [14] |
Haines J W, Coster M, Bouffler S D. Impairment of the non-homologous end joining and homologous recombination pathways of DNA double strand break repair:Impact on spontaneous and radiation-induced mammary and intestinal tumour risk in Apcmin/+ mice[J]. DNA Repair, 2015, 35: 19-26. DOI:10.1016/j.dnarep.2015.08.002 |




