放射治疗是临床肿瘤治疗的主要手段之一,但在射线杀死肿瘤细胞的同时,也常对机体正常组织器官造成损伤,包括造血系统和免疫系统,这对患者的生存质量和治疗效果带来了很大的影响[1]。目前临床上针对放疗副作用的主要防护药物为氨磷汀,但氨磷汀具有一定的副作用,易导致恶心、呕吐等症状[2]。所以,开发和探索安全有效、副作用低的辐射防护剂具有重要的意义。丙二醇是一种低毒性、应用广泛的小分子化学试剂,除了用做药品溶剂,食品、电子烟等的保湿剂外,还可用作细胞低温保护剂[3-4]。但目前对丙二醇的生物效应和辐射防护效应方面的研究很少,本研究通过检测丙二醇对5.5 Gy照射后小鼠脾脏指数、脾脏病理结构,胸腺指数和血清SOD活性的改变初步探讨丙二醇对辐射损伤小鼠的保护作用。
1 材料与方法 1.1 主要试剂及仪器丙二醇(纯度≥ 99%)购自上海阿拉丁生化科技股份有限公司,10%中性甲醛固定液购自北京索莱宝科技有限公司。总超氧化物歧化酶(SOD)检测试剂盒(A001-3, WST-1法)购买自南京建成生物工程研究所。60Co γ照射源为北京市辐照中心辐照源。MEK6400型全自动血细胞分析仪(日本光电株式会社)。
1.2 实验动物采用6~8周SPF级C57BL/6J雄性小鼠(22 ± 2)g,购买并饲养于北京大学医学部SPF级动物实验室(实验动物生产许可证号:SCXK(京)2016-0010,实验动物使用许可证号:SYXK(京)2016-0041),温度(24±2)℃,湿度50 %~60 %,采用昼夜12 h交替照明。每笼4只小鼠,采用动物饮用水和SPF级大小鼠饲料饲养。小鼠健康状况良好,活动度正常,无打架或撕咬行为。动物实验经中国疾病预防控制中心辐射防护与核安全医学所实验动物伦理福利委员会审查通过。
1.3 动物分组及给药方式所有小鼠适应性饲养3 d后进行实验,外周血细胞检测实验小鼠按随机数字表法分为5组,每组8只,分别为:对照组,照射组,丙二醇照射前1 h给药组,照前3 h给药组和照前6 h给药组。脾脏指数等实验小鼠按随机数字表法分为3组,分别为:对照组,照射组,丙二醇照射前1 h给药组,每组12只小鼠。丙二醇以生理盐水配制成60%浓度溶液,按10 ml/kg体重进行腹腔注射给药。对照组和照射组在同一时间给予10 ml/kg体重生理盐水。
1.4 照射方法将小鼠装进特制有机玻璃盒固定后,以动物运输盒运输至北京市辐照中心钴源室进行全身照射,对照组同样运输至钴源室但不进行照射。照射过程中不打开运输盒包装以保证无菌状态,照射后运送回北京大学医学部动物房饲养。根据前期实验研究,选择低于小鼠LD50/30剂量的5.5 Gy作为模型照射剂量,照射距离94 cm,剂量率1.0 Gy/min。
1.5 观察指标 1.5.1 小鼠外周血细胞测定照射后10 d割小鼠尾静脉取血,每只小鼠取20 μl静脉血于2 ml血细胞稀释液里,以全自动血细胞计数仪检测。
1.5.2 脾脏指数和胸腺指数测定在照射后7,10,18 d称量小鼠体重,处死小鼠,解剖取出完整脾脏和胸腺,剔除附着脂肪组织后称重,计算小鼠脾脏指数和胸腺指数。脏器指数=脏器质量(mg)/小鼠体质量(g)。
1.5.3 脾脏病理在照射后10 d,将小鼠脾脏以10%中性甲醛固定3 d,流水冲洗30 min,常规脱水、浸蜡、包埋、切片,切片脱蜡、HE染色、制片,置于光学显微镜下观察脾脏组织病理结构变化。
1.5.4 血清SOD的测定小鼠在照射后7 d摘眼球取血,室温静置1 h后,3 000 rpm离心10 min,分离上层血清,-80 ℃冰箱保存备用。SOD检测采用WST-1法,将血清以生理盐水进行10倍稀释,以SOD酶标准品作为阳性对照,以SOD酶稀释液作为阴性对照,参照南京建成生物工程研究所SOD检测试剂盒进行加样、混匀,37℃孵育20 min,波长450 nm,酶标仪测定吸光度值。
1.6 统计学处理所有数据均以x±s表示,使用GraphPad Prism 7.0软件对数据进行分析作图。多组计量数据比较采用单因素方差分析, 组间两两比较采用t检验。P<0.05表示差异有统计学意义。
2 结果 2.1 丙二醇预防给药对辐射损伤小鼠外周血细胞的影响如表 1所示,照射后10d,各组间WBC, RBC, PLT均具有统计学差异,且差异具有统计学意义(F=203、89、134.2, P<0.05)。与对照组相比,照射组小鼠外周血WBC, RBC, PLT明显降低,差异有统计学意义(t=15.08、15.34、14.76,P<0.05)。与照射组相比,照射前1 h给药组小鼠外周血WBC, PLT显著升高,差异具有统计学意义(t=2.53、3.72,P<0.05);照前3 h给药组与照射组相比,PLT高于对照组,差异有统计学意义(t=3.00,P<0.05);而照前6 h给药组与照射组相比,WBC, RBC, PLT均无明显差异。因此选择照射前1 h给药为最佳给药时间点,进行后续实验。
|
|
表 1 5.5 Gy照射后10 d小鼠外周血象的变化(x±s) |
在照射后7 d,10 d,18d记录小鼠体重,观察丙二醇是否缓解照射引起的小鼠体重下降。在照射后7 d,三组小鼠体重无统计学差异(F=1.37, P>0.05)。照射后10 d,三组小鼠体重存在统计学差异(F= 8.61, P<0.01)。两两比较发现,照射组小鼠体重比对照组降低,差异有统计学意义(t=3.84, P<0.05);与照射组相比,丙二醇照射前1 h给药组组小鼠体重高于照射组,且差异有统计学意义(t=2.86, P<0.05)。而在照射后18 d,虽然照射组小鼠体重低于对照组和丙二醇照射前1 h给药组,但三组间差异无统计学意义(F= 2.27, P>0.05)。说明丙二醇能减轻辐射导致的小鼠体重的下降。
2.3 丙二醇预防用药对辐射损伤小鼠脾脏指数的影响小鼠在照后7 d、10 d、18 d的脾脏指数变化统计结果见表 2。由表 2可见,在照射后7、10、18 d,小鼠三组间脾脏指数均存在统计学差异,且差异具有统计学意义(F=177.2、49.35、10.44, P<0.01)。与对照组比较,照射组小鼠脾脏指数在7、10 d明显降低,差异具有统计学意义(t=16.45, 13.4, P<0.05);丙二醇照射前1 h给药组小鼠脾脏指数降低,差异有统计学意义(t=8.52, 3.29,P<0.05)。但与照射组比较,丙二醇照射前1 h给药组小鼠在7 d脾脏指数升高,差异具有统计学意义(t=2.95,P<0.05)。照射后18 d,与对照组相比,照射组和丙二醇照射前1 h给药组小鼠脾脏指数均显著增加,差异具有统计学意义(t=8.24、6.60,P<0.05);与照射组相比,丙二醇照射前1 h给药组小鼠脾脏指数增加,但差异无统计学意义(P>0.05)。这说明丙二醇可以增加照射后7 d的脾脏指数,减轻脾脏损伤。
|
|
表 2 5.5 Gy照射后小鼠体重的变化(x±s) |
|
|
表 3 5.5 Gy照射后小鼠脾脏指数的变化(x±s) |
由表 4可见,在照射后7、10、18 d,小鼠三组间胸腺指数均存在统计学差异,且差异具有统计学意义(F=11.1,4.37,5.64,P<0.01)。在照射后7 d,与对照组相比,照射组小鼠的胸腺指数明显降低,差异有统计学意义(t=4.14,P<0.05);与照射组相比,丙二醇照射前1 h给药组小鼠的胸腺指数显著增加,差异有统计学意义(t = 2.74,P<0.05)。照射后10 d,与对照组相比,照射组小鼠的胸腺指数没有明显变化,差异无统计学意义(P>0.05);与照射组相比,丙二醇照射前1 h给药组小鼠胸腺指数降低,但差异无统计学意义(P>0.05)。而在照射后18 d,与对照组相比,照射组小鼠胸腺指数明显降低,差异有统计学意义(t=5.64,P<0.05);与照射组相比,丙二醇照射前1 h给药组小鼠胸腺指数显著增加,差异有统计学意义(t=6.81,P<0.05)。即小鼠胸腺指数在照射后呈现先降低,后升高,再降低的双相变化。丙二醇预防用药可减轻辐射导致的小鼠胸腺指数的降低,说明丙二醇在一定程度上减轻辐射导致的小鼠胸腺的损伤。
|
|
表 4 5.5 Gy照射后小鼠胸腺指数的变化(x±s) |
如图 1所示,在照射后10 d,对照组小鼠脾脏被膜完整,红、白髓分界清晰,生发中心、边缘区清楚,未见异常;照射组小鼠脾脏较对照组体积变小,脾被膜皱缩,红白髓分界不明显,脾小体较少或无,脾小体内淋巴细胞密度减小,无明显生发中心,白髓明显减少,红髓减少。而丙二醇照射前1h给药组小鼠脾脏与照射组相比,红白髓分界相对明显,白髓相对增多,结构趋于完整清晰,脾小体内淋巴细胞密集,可见较明显的生发中心,说明小鼠脾脏损伤已开始恢复。
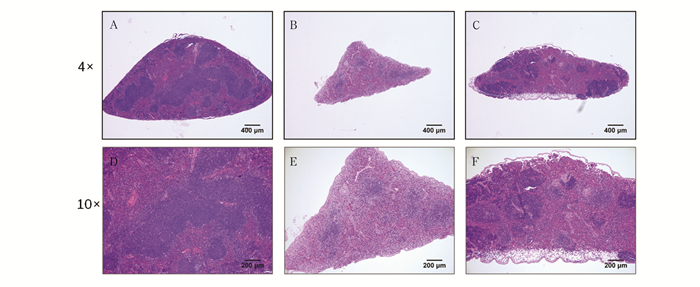
|
图 1 小鼠脾脏病理结构的变化HE染色 注:A.对照组(4×); B.照射组(4×); C.丙二醇+照射组(4×); D.对照组(10×); E.照射组(10×); F.丙二醇+照射组(10×)。 |
从表 5结果可见,三组间虽无统计学差异(F=2.61,P>0.05)。但与对照组相比,照射后7 d小鼠血清中总SOD酶活性降低;与照射组相比,丙二醇照射前给药组SOD升高,差异均无统计学意义(P>0.05)。说明照射后早期小鼠体内SOD明显受到抑制,而丙二醇能够提升小鼠血清SOD水平。
|
|
表 5 小鼠5.5 Gy照射后7 d总超氧化物歧化酶活性的变化(x±s) |
电离辐射作用于机体,可导致机体代谢紊乱,造血、免疫、神经和内分泌系统的调节功能障碍等一系列病变[5-7]。本研究通过建立5.5 Gy照射小鼠辐射损伤模型,观察丙二醇不同时间给药对辐射损伤小鼠外周血象的影响,同时观察对辐射损伤小鼠脾脏指数、胸腺指数、脾脏病理、SOD活性等的影响,初步探索丙二醇对γ射线全身照射小鼠辐射造血和免疫损伤的防护作用。
造血系统是辐射敏感组织之一,当机体受到一定剂量的全身或局部照射后,即可引起骨髓造血功能障碍,使外周血各系血细胞减少,包括WBC、RBC、PLT、中性粒细胞等,造成机体造血系统的严重损伤[8]。本研究发现,丙二醇照射前不同时间给药后,在照射前1 h可提高辐射损伤小鼠外周血WBC、PLT,效果明显。而照射前3 h给药仅使外周血PLT升高;照射前6 h对提高辐射损伤小鼠外周血象的作用未见明显效果。所以认为丙二醇在照射前1 h给药对辐射损伤小鼠具有较好的辐射防护作用。小鼠体重记录发现,丙二醇可以减轻照射后10 d辐射导致的小鼠体重下降,减轻辐射造成的小鼠机体损伤。
脾脏作为机体的第二大造血器官,同时也是维持机体免疫功能的重要免疫器官,对辐射具有高度敏感性[9]。机体受到电离辐射后,脾脏指数下降,脾脏萎缩,脾小体变小或消失,从而影响机体正常的造血功能和免疫功能[10]。本实验研究结果发现,丙二醇照射前1h给药能升高照射引起的小鼠脾脏指数的降低,这在照射后7 d尤为明显。同时脾脏病理观察发现,丙二醇前1h给药可显著增加脾脏白髓含量,脾脏结构趋于恢复,减轻辐射导致的脾脏病理结构损伤。这初步说明了丙二醇对电离辐射导致的脾脏损伤有保护作用,对机体造血和免疫功能的恢复具有一定的防护作用。
免疫系统是辐射敏感组织,辐射引起的机体免疫功能的改变是辐射损伤的表现之一[11],0.5 Gy以上的剂量照射即可显示辐射对免疫系统的抑制作用,剂量越大,抑制程度越深,持续时间越久[5]。胸腺是T细胞分化、成熟的中枢免疫器官,其中的淋巴细胞对辐射十分敏感[12]。本研究结果发现,照射后小鼠胸腺指数呈现双相变化,这和刘树峥等对小鼠胸腺重量在照射后会出现双相变化的描述基本一致[5],同时他认为第二次下降可能是骨髓来源的淋巴样细胞损伤不利于胸腺的再生和恢复。丙二醇照射前1 h给药能够显著减轻胸腺指数的两次下降,说明丙二醇对小鼠胸腺细胞具有一定的保护作用,同时也说明丙二醇可以减轻骨髓来源的淋巴样细胞损伤,亦说明对骨髓有一定的保护作用。
电离辐射对机体的损伤是多方面的,不仅造成造血、免疫系统的损伤,还可通过氧自由基攻击细胞组分,进而导致DNA链断裂、染色体畸变和细胞凋亡[13-14]。SOD是机体主要的清除自由基的抗氧化酶,其活力的高低间接地反映了机体清除氧自由基的能力[15]。本次实验结果表明,小鼠在受到5.5 Gy γ射线照射后,总SOD活性下降,表示机体的抗氧化能力下降,氧化还原平衡被打破;照射前给以丙二醇后,小鼠SOD活性升高,但是差异不具有统计学意义,推测可能是因为动物样本量较小,导致统计学差异不明显。
综上所述,丙二醇照射前1 h给药可显著升高辐射损伤小鼠外周血象,减轻辐射导致的小鼠体重下降,提高小鼠的脾指数和胸腺指数,促进小鼠脾脏损伤的恢复,同时通过增加血清SOD的活性。说明其对小鼠辐射造血损伤和免疫损伤具有一定的保护作用,结合其低毒性、高稳定性、容易制备的特点,提示其具有作为辐射防护剂候选药物的潜在价值,但辐射防护作用的具体机制尚待进一步研究。
| [1] |
Taylor CW, Kirby AM. Cardiac side-effects from breast cancer radiotherapy[J]. Clin Oncol, 2015, 27(11): 621-629. DOI:10.1016/j.clon.2015.06.007 |
| [2] |
Allanore LV, N. Poulalhon N, Fagot JP, et al. Stevens-Johnson syndrome and toxic epidermal necrolysis induced by amifostine during head and neck radiotherapy[J]. Radiother Oncol, 2008, 87(2): 300-303. DOI:10.1016/j.radonc.2008.01.021 |
| [3] |
Crenshaw MD, Tefft ME, Buehler SS, et al. Determination of nicotine, glycerol, propylene glycol and water in electronic cigarette fluids using quantitative 1H NMR[J]. Magn Reson Chem, 2016, 54(11): 901-904. DOI:10.1002/mrc.4498 |
| [4] |
Yang N, Hort J, Linforth R, et al. Impact of flavour solvent (propylene glycol or triacetin) on vanillin, 5-(hydroxymethyl)furfural, 2, 4-decadienal, 2, 4-heptadienal, structural parameters and sensory perception of shortcake biscuits over accelerated shelf life testing[J]. Food Chem, 2013, 141(2): 1354-1360. DOI:10.1016/j.foodchem.2013.03.084 |
| [5] |
刘树峥. 医学放射生物学[M]. 3版. 北京: 原子能出版社, 2010: 18-19.
|
| [6] |
Singh VK, Newman VL, Romaine PL, et al. Radiation countermeasure agents:an update(2011-2014)[J]. Expert Opin Ther Pat, 2014, 24: 1229-1255. DOI:10.1517/13543776.2014.964684 |
| [7] |
Tajima G, Delisle AJ, Hoang K, et al. Immune system phenotyping of radiation and radiation combined injury in outbred mice[J]. Radiat Res, 2013, 179(2): 101-112. |
| [8] |
Shao LJ, Luo Y, Zhou DH. Hematopoietic stem cell injury induced by ionizing radiation[J]. Antioxid Redox Signal, 2014, 20(9): 1447-1462. DOI:10.1089/ars.2013.5635 |
| [9] |
曲功霖, 李辰, 邵帅, 等. 不同君药四君子汤辐射损伤防护作用的比较研究[J]. 中国辐射卫生, 2017, 26(3): 265-269. DOI:10.3969/j.issn.1004-714X.2017.03.003 |
| [10] |
王春燕, 李宁, 佟鹏, 等. 纳米氧化铈对小鼠辐射损伤防护作用的研究[J]. 中国辐射卫生, 2016, 25(3): 273-276. |
| [11] |
郑辉, 涂序珉, 甄荣, 等. 不同剂量辐射损伤后T淋巴细胞亚群TH1和TH2变化观察[J]. 中国辐射卫生, 2009, 18(1): 13-14. |
| [12] |
Iglesias ML, Schmidt A, Ghuzlan AA, et al. Radiation exposure and thyroid cancer:a review[J]. Arch Endocrinol Metab, 2017, 61(2): 180-187. DOI:10.1590/2359-3997000000257 |
| [13] |
Cervelli T, Panetta D, Navarra T, et al. A new natural antioxidant mixture protects against oxidative and DNA damage in endothelial cell exposed to low-dose irradiation[J]. Oxid Med CellLongev, 2017, 2017: 1-7. |
| [14] |
Wang Y, Liu LB, Pazhanisamy SK, et al. Total body irradiation causes residual bone marrow injury by induction of persistent oxidative stress in murine hematopoietic stem cells[J]. Free Radic Biol Med, 2010, 48(2): 348-356. DOI:10.1016/j.freeradbiomed.2009.11.005 |
| [15] |
Cheng CL, Yi JJ, Wang RC, et al. Protection of spleen tissue of γ-ray irradiated mice against immunosuppressive and oxidative effects of radiation by adenosine 5'-monophosphate[J]. IntJMol Sci, 2018, 19(5): 1-15. |




