血液中的单核细胞在趋化因子和细胞因子的作用下,穿透血管壁进入组织,分化成为巨噬细胞。巨噬细胞具有极强的可塑性,在细胞因子等体内外刺激因素的作用下,巨噬细胞基因表达发生改变,可以分化为两种不同的功能类型,分别是经典活化的M1型巨噬细胞和选择性活化的M2型巨噬细胞。M1型巨噬细胞由干扰素-γ(IFN-γ)和脂多糖(LPS)激活,分泌TNF-α、IL-1β、IL-6和IL-12等细胞因子,表现为抗原递呈能力提高,吞噬功能增强,促进炎性免疫应答;M2型巨噬细胞由白介素-4(IL-4)、白介素-10(IL-10)和白介素-13(IL-13)激活,分泌IL-4、IL-13、IL-10和TGF-β等细胞因子,表现为抗原递呈能力差,抑制炎性免疫反应,在组织损伤修复、代谢类疾病以及肿瘤发生发展中发挥重要作用。
实体肿瘤中的肿瘤细胞、免疫细胞、间质细胞及多种活性介质共同构成肿瘤微环境,局部微环境会影响巨噬细胞类型和功能。在肿瘤组织中,这两种细胞类型按照一定的比例共同存在。在肿瘤发生的早期,肿瘤相关巨噬细胞(TAMs)表现出以M1型巨噬细胞为主的特性,随着肿瘤的发展,在多种细胞因子的作用下,表现出以M2型巨噬细胞为主的特性[1]。而且有研究证实在胃癌[2]、乳腺癌[3]、胰腺癌[4]、前列腺癌[5]、肺癌[6]、结肠癌[7]、卵巢癌[8]等多种肿瘤中,M2型巨噬细胞和M2/M1型巨噬细胞的比例与肿瘤的预后不良有关。M2型巨噬细胞能分泌的MMP-2和MMP-9降解细胞基质,同时还分泌VEGF促进血管新生[1],因而M2型巨噬细胞促进肿瘤的发展和转移,鉴于此,针对M2型巨噬细胞分化及功能研究成为抗肿瘤免疫研究的热点。
目前放射治疗已经成为治疗肿瘤的重要手段之一,电离辐射作为一种外环境刺激因素对TAMs的功能影响尚未完全阐明。基于此,本次研究以小鼠巨噬细胞系RAW264.7细胞为研究对象,采用重组IL-4体外诱导成为M2型巨噬细胞,探讨电离辐射对M2型巨噬细胞分泌基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)和血管内皮生长因子(VEGF)的影响,为肿瘤的治疗提供作用靶点。
1 材料与方法 1.1 材料小鼠单核巨噬细胞RAW264.7(江苏凯基生物技术股份有限公司)、鼠源重组白细胞介素4(rm IL-4,novoprotein公司)、抗小鼠MMP-2抗体(proteintech公司)、抗小鼠MMP-9抗体(proteintech公司)、抗小鼠VEGF抗体(proteintech公司)、SDS-PAGE凝胶配置试剂盒(Beyotime公司),PVDF膜(Millipore公司)、二抗、一抗稀释液、ECL发光试剂盒(Millipore公司)、RIPA裂解液(Beyotime公司)、蛋白Marker(Beyotime公司)、BCA蛋白浓度测定试剂盒(Beyotime公司)。
1.2 细胞培养及处理 1.2.1 细胞培养与实验分组RAW264.7细胞用含10%灭活胎牛血清、100 U/mL青霉素,100 U/mL链霉素的DMEM高糖培养基培养,置于37℃、5%CO2培养箱。根据细胞生长情况,取对数生长期细胞实验。实验分为两部分,分别用X射线照射细胞24 h给予IL-4刺激12 h和IL-4刺激3 h X射线照射9 h,每部分受照剂量分别为0、2、5、10 Gy。
1.2.2 X射线照射采用美国Varian 21EX医用6 MV直线加速器,细胞培养板放置在1.5 cm等效蜡板上,源皮距100 cm,照射野10 cm×10 cm,剂量率400 cGy/min。
1.2.3 Western blot检测Western blot检测MMP-2、MMP-9和VEGF蛋白的表达情况。用胰酶消化收取细胞后加入200 μl蛋白裂解液,提取总蛋白,BCA法测定蛋白浓度,配置SDS-PAGE浓缩胶和分离胶,在电泳缓冲液中电泳,将蛋白质转移到硝酸纤维素膜上,加入一抗和二抗进行免疫反应,以GAPDH作为对照,采用ECL显影及凝胶成像分析,计算条带吸光度值。
1.3 统计学分析用SPSS 19.0进行统计学分析,不同受照剂量时,MMP-2、MMP-9和VEGF的比较首先进行方差齐性分析,方差齐的情况下采用One-way ANOVA,有统计学意义后采用LSD法进行两两比较;两种受照方式下,MMP-2、MMP-9和VEGF的比较采用两独立样本的t检验,方差不齐时选择修正后的P值;MMP-2和VEGF、MMP-9和VEGF的相关性分析用Pearson相关分析。检验水准α=0.05,P<0.05认为差异有统计学意义。
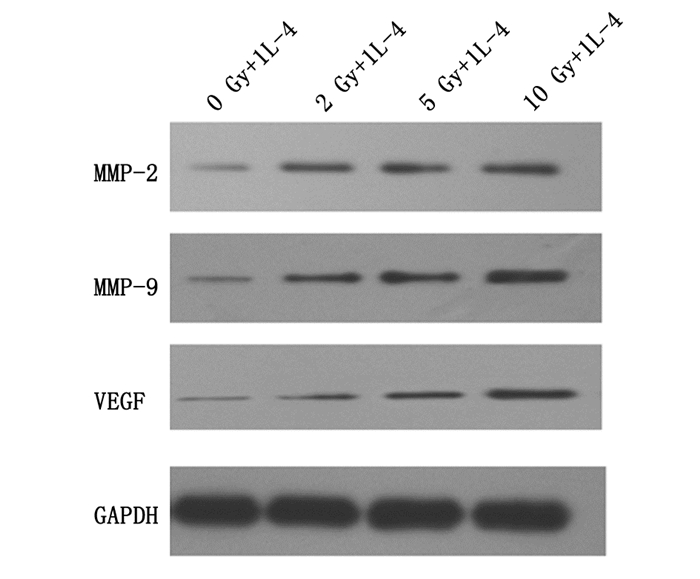
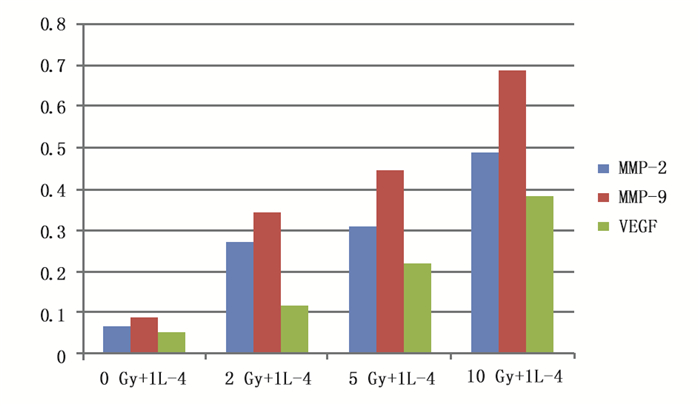
2 结果 2.1 受照剂量依赖性增加RAW264.7细胞MMP-2、MMP-9和VEGF的表达 2.1.1 不同剂量的X射线照射后再用IL-4刺激处理组图 1所示为0、2、5、10Gy X射线照射RAW264.7后再用IL-4刺激,MMP-2、MMP-9和VEGF的Western blot表达条带。如图 2所示,四个剂量组间MMP-2、MMP-9和VEGF的表达差异有统计学意义(F=63.099,P<0.001;F=198.786,P<0.001;F=53.1,P<0.001)。两两比较分析,MMP-2的表达,2 Gy组与5 Gy组差异无统计学意义外,其余组间比较均有统计学差异(P<0.001);MMP-9的表达,各组间比较差异均有统计学意义(P<0.001);VEGF的表达,各组间比较差异均有统计学意义(P<0.001)。随着受照剂量的增高,MMP-2、MMP-9和VEGF的表达均增高。
|
图 1 免疫印迹分析X射线+IL-4处理对RAW264.7细胞MMP-2/9和VEGF表达的影响 |
|
图 2 不同剂量X射线+IL-4处理对RAW264.7细胞MMP-2/9和VEGF表达的柱状图分析 |
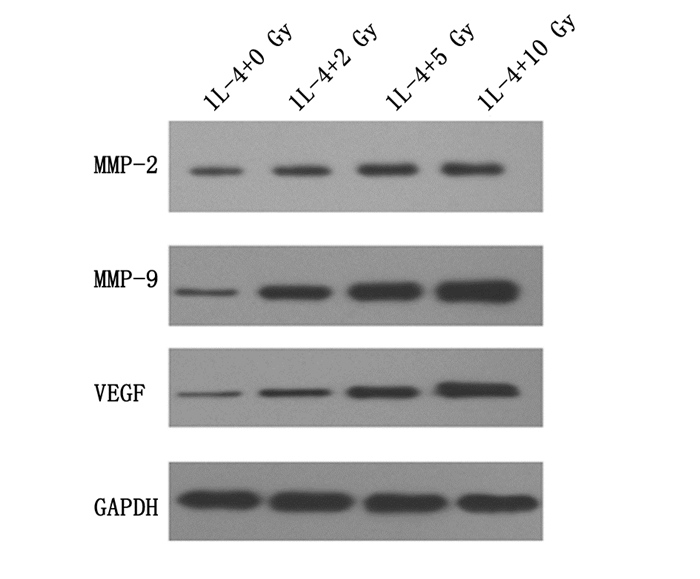
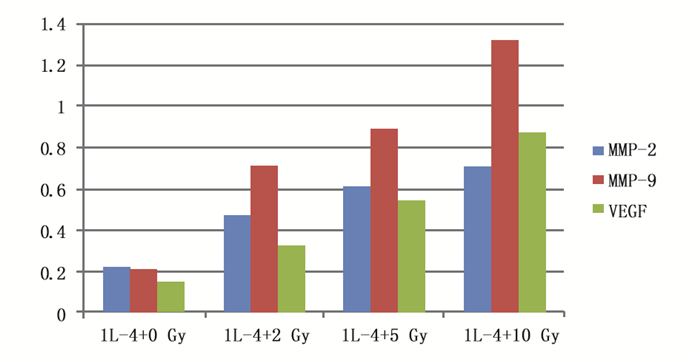
图 3为IL-4刺激后再用不同剂量的X射线照射RAW264.7,MMP-2、MMP-9和VEGF的Western blot表达条带。图 4所示,四个剂量组间MMP-2、MMP-9和VEGF的表达差异有统计学意义(F=13.909,P<0.01;F=71.797,P<0.001;F=141.378,P<0.001)。两两比较,MMP-2的表达,2 Gy组与5 Gy组比较差异没有统计学意义,5 Gy与10 Gy组比较差异没有统计学意义,其余各组间比较差异都有统计学意义(P<0.05);MMP-9的表达,各组间比较差异都有统计学意义(P<0.05);VEGF的表达,各组间比较差异都有统计学意义(P<0.05);随着受照剂量的增加,MMP-2、MMP-9和VEGF的表达均增高。
|
图 3 免疫印迹分析IL-4+X射线处理对RAW264.7细胞MMP-2/9和VEGF表达的影响 |
|
图 4 IL-4+不同剂量X射线处理对RAW264.7细胞MMP-2/9和VEGF表达的柱状图分析 |
图 5所示为相同的受照剂量下,两种不同的受照方式,MMP-2、MMP-9和VEGF的表达情况。由表 1可见,分别在2、5、10 Gy受照剂量下,IL-4刺激+X射线的照射方式MMP-2、MMP-9和VEGF的表达均高于X射线+IL-4刺激的照射方式(P<0.05)。
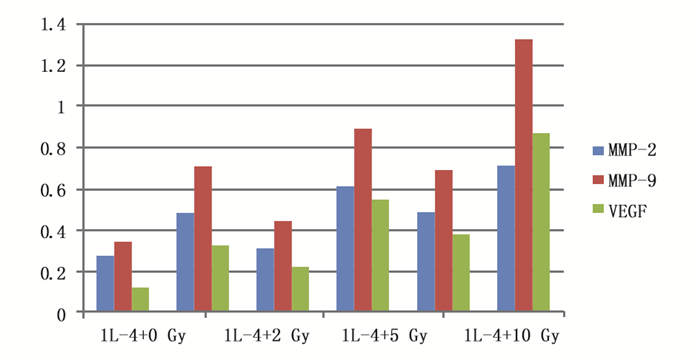
|
图 5 两种受照方式对RAW264.7细胞MMP-2/9和VEGF的表达情况 |
|
|
表 1 两种受照方式对RAW264.7细胞MMP-2、MMP-9和VEGF的表达比较分析 |
对于照射+IL-4处理组,MMP-2、MMP-9分别与VEGF进行Pearson积差相关分析,相关系数分别为0.892,P<0.001和0.948,P<0.001;对于IL-4+照射处理组,MMP-2、MMP-9分别与VEGF进行Pearson积差相关分析,相关系数分别为0.857,P<0.001和0.958,P<0.001;差异均有统计学意义。
3 讨论本次研究以小鼠巨噬细胞系RAW264.7为研究对象,用重组的小鼠IL-4刺激使其极化为M2型巨噬细胞,以模拟实体肿瘤微环境内部的肿瘤相关巨噬细胞(TAMs),有研究证明,TAMs更倾向于极化为M2型巨噬细胞,同时表达M2型巨噬细胞表面标记物,分泌IL-10、CCL17、CCL18、CCL22、TGF-β等多种细胞因子抑制免疫应答[9-11]。其他研究者的结果已经证实:RAW264.7在IL-4的刺激下,高表达精氨酸酶1(Arg-1)和YM-1,极化为M2型巨噬细胞[12]。
M2型巨噬细胞能够通过自分泌或旁分泌的方式释放多种基质金属蛋白酶,如MMP-2、MMP-9和多种细胞因子,如bFGF、VEGF、PDGF、GM-CSF。基质金属蛋白酶家族(MMPs)能导致细胞外基质(ECM)和基底膜(BM)降解,而VEGF促进肿瘤微血管形成,两者是肿瘤侵袭和转移的必要条件。有研究证明,几乎在所有肿瘤组织中MMPs表达均较正常组织中增高[13]。在结直肠癌中,MMP-2的表达水平与肿瘤体积、浸润程度、淋巴结转移、Dukes分期水平正相关[14]。在胰腺癌患者中,巨噬细胞表达MMP-2和MMP-9,增加肿瘤细胞周围的血管浸润,促进胰腺癌细胞肝转移。在胃癌、肠癌、鼻咽癌、卵巢癌、肾癌等多种肿瘤中都有VEGF及其受体高表达。在非小细胞肺癌中,VEGF的表达与肺癌有无淋巴结转移,临床分期及肿瘤的分化程度显著相关[15]。本研究发现电离辐射照射后,MMP-2、MMP-9和VEGF表达均增高,而且随着受照剂量的增加,存在剂量-反应关系。这与Hovinga KE、周勇等人的研究结果相似,Hovinga KE认为在多种肿瘤组织放疗后均表现出VEGF水平上调[16]。周勇用γ射线照射RAW264.7后,发现10Gy剂量组MMP-9 mRNA表达增强最明显,并且MMP-9蛋白表达也显著增加[17]。
研究认为,在肿瘤转移过程中,肿瘤细胞分泌的MMPs可以提高促血管生长因子的作用,共同促进肿瘤细胞增殖及转移。Riedel等对头颈部肿瘤的研究发现,VEGF和MMP-9有协同作用,共同促进肿瘤血管生成和远处转移[18]。Che等对非小细胞肺癌的研究也发现,VEGF和MMP-2在促进血管生成和肿瘤生长、浸润和转移中也有明显相关性[19]。本研究中,对MMP-2和MMP-9分别与VEGF进行线性相关分析,发现MMP-2和VEGF有强相关性,MMP-9和VEGF也有强相关性,与上述研究结果一致。
本研究设置了两种照射方式,分别是先给予RAW264.7巨噬细胞IL-4刺激,再用电离辐射照射,和先给予电离辐射照射,再用IL-4刺激,以分别模拟实体肿瘤中已经极化为M2型巨噬细胞的TAMs受到电离辐射照射,和迁移至实体肿瘤中的单核细胞受到电离辐射照射后再极化为M2型巨噬细胞,结果发现在2、5、10 Gy剂量组,IL-4刺激后再照射组MMP-2、MMP-9和VEGF均高于照射后再IL-4刺激组,提示对MMP-2、MMP-9和VEGF的分泌而言,实体肿瘤中已经存在的M2型巨噬细胞受电离辐射的影响更大。
综上所述,本研究证实:电离辐射照射可以导致小鼠巨噬细胞系RAW264.7分泌MMP-2、MMP-9和VEGF表达增高,并且存在剂量-反应关系,不同照射方式对RAW264.7细胞MMP-2、MMP-9和VEGF分泌影响不同。
| [1] |
张庆勇, 朱武飞, 王群兴. 肿瘤相关巨噬细胞与肿瘤的发生发展[J]. 细胞与分子免疫学杂志, 2013, 29(1): 106-108. |
| [2] |
Zhang J, Yan Y, Yang Y, et al. High infiltration of tumor-associated macrophages influences poor prognosis in human gastric cancer patients, associates with the phenomenon of EMT[J]. Medicine(Baltimore), 2016, 95(6): e2636. |
| [3] |
Vasiljeva O, Papazoglou A, Kruger A, et al. Tumor cell-derived and macrophage-derived cathepsin B promotes progression and lung metastasis of mammary cancer[J]. Cancer Res, 2006, 66(10): 5242-5250. DOI:10.1158/0008-5472.CAN-05-4463 |
| [4] |
Gocheva V, Wang H W, Gadea B B, et al. IL-4 induces cathepsin protease activity in tumor-associated Macrophages to promote cancer growth and invasion[J]. Genes Dev, 2010, 24(3): 241-255. DOI:10.1101/gad.1874010 |
| [5] |
Comito G, Giannoni E, Segura CP, et al. Cancer-associated fibroblasts and M2-polarized macrophages synergize during prostate carcinoma progression[J]. Oncogene, 2014, 33: 2423-2431. DOI:10.1038/onc.2013.191 |
| [6] |
Wang R, Zhang J, Chen S, et al. Tumor-associated macrophages provide a suitable microenvironment for non-small lung cancer invasion and progression[J]. Lung Cancer, 2011, 74(2): 188-196. DOI:10.1016/j.lungcan.2011.04.009 |
| [7] |
Cui Y L, Li H K, Zhou H Y, et al. Correlations of tumor-associated macrophage subtypes with liver metastases of colorectal cancer[J]. Asian Pac J Cancer Prev, 2013, 14(2): 1003-1007. DOI:10.7314/APJCP.2013.14.2.1003 |
| [8] |
Li D, Wang X, Wu J L, et al. Tumor-produced versican V1 enhances hCAP18/LL-37 expression in macrophages through activation of TLR2 and vitamin D3 signaling to promote ovarian cancer progression in vitro[J]. PLos One, 2013, 8(2): e56616. DOI:10.1371/journal.pone.0056616 |
| [9] |
Tugal D, Liao X, Jain MK. Transcriptional control of macrophage polarization[J]. Arterioscler Thromb Vasc Biol, 2013, 33(6): 1135-1144. DOI:10.1161/ATVBAHA.113.301453 |
| [10] |
Lawrence T, Natoli G. Transcriptional regulation of macrophage polarization:enabling diversity with identity[J]. Nat Rev Immunol, 2011, 11(11): 750-761. DOI:10.1038/nri3088 |
| [11] |
宛硕, 黄艳, 陈庭金, 等. 巨噬细胞极化的研究进展[J]. 中国病原生物学杂志, 2015, 10(11): 1051-1054. |
| [12] |
解海荣, 李贞, 李海亮, 等. 不同照射方式对IL-4诱导的小鼠RAW264.7细胞极化的影响[J]. 中国辐射卫生, 2017, 26(6): 637-641. DOI:10.3969/j.issn.1004-714X.2017.06.005 |
| [13] |
Mc Cawley LJ, Matrisian LM. Matrix metalloproteinases:they're not just any more[J]. Curr Opin Cell Biol, 2001, 13(5): 534-540. DOI:10.1016/S0955-0674(00)00248-9 |
| [14] |
姜友, 刘戈, 葛尔树. HER2、MMP2、Leptin在结直肠癌组织中的表达及临床意义[J]. 安徽医药, 2012, 16(4): 479-482. DOI:10.3969/j.issn.1009-6469.2012.04.026 |
| [15] |
蒋晓东, 戴鹏. HIF1α、VEGF、VEGFR2在非小细胞肺癌组织中的表达及临床意义[J]. 临床肺科杂志, 2011, 16(3): 386-388. DOI:10.3969/j.issn.1009-6663.2011.03.028 |
| [16] |
Hovinga KE, Stalpers LJ, Van BC, et al. Radiation enhanced vascular endothelial growth factor(VEGF) secretion glioblasto mamulfiforme cell lines a clue to radioresistance[J]. Neuro Oncol, 2005, 74(2): 99-103. DOI:10.1007/s11060-004-4204-7 |
| [17] |
周勇, 王科, 何忠时, 等. 辐射对巨噬细胞系RAW264.7基质金属蛋白酶-9表达的影响[J]. 实用癌症杂志, 2013, 28(1): 20-23. |
| [18] |
Riedel F, Gotte K, Schwalb J, et al. Expression of 92KD a type Ⅳ collagenase correlates with angiogenic marker 8 and poor surviving in head and neck squamous cell carcinoma[J]. Int J Oncol, 2000, 17(6): 1099-1105. |
| [19] |
Che G, Chen J, Liu L, et al. Transfection of nm23-H1 increased expression of beta Catenin, E-Cadherin and TIMP-1 and decreased the expression of MMP2, CD44v6 and VEGF and inhibited the metastatic potential of human non-small cell lung cancer line L9981[J]. Neoplasma, 2006, 53(6): 530-537. |



