肝细胞肝癌(hepatocellular carcinoma,HCC)的发病率在全球恶性肿瘤的排名中居第6位,其致死率更是高居第3位。在这当中,全世界每年新发的肝癌病例,我国占比超过55%,其致死人数多达23.7/10万[1-2]。目前,临床上对肝癌患者的治疗方式是以手术为主的综合治疗,其实际应用及治疗效果已日益趋向于成熟。然而,肝癌手术切除治疗后的复发仍旧是制约患者远期预后及生存质量的重要危险因素。有文献指出[3-4],肝切除患者术后远期复发率可高达70%左右,即便是接受肝移植的患者,其5年内的复发率也接近于25%。微血管侵犯(microvascular invasion, MVI)在肝癌术后复发的病理机制中扮演着重要角色,其导致其不良预后的关键,而相关影像学对MVI的研究亦日益见诸文献报道[5-7]。有鉴于此,本研究旨在探寻MSCT肝癌微血管侵犯征象对肝癌术后复发的诊断价值,为术后肝癌的复发找到直接的影像学证据。
1 资料与方法 1.1 临床资料对我院行根治性切除的孤立性肝癌患者进行为期2年的随访,时间段为2016年1月-2018年1月。以是否存在术后复发作为随访内容,并收集患者的术前MSCT影像学资料进行回顾性分析。本研究的整个过程严格遵照以下标准实施:纳入标准:①术前患者行MSCT扫描,对肝癌的影像学诊断按照美国肝脏研究协会(American Association for the Study of Liver Diseases,AASLD)标准执行[8]。②患者具备治疗指征,手术方法遵循相应指南实施[9]。③所有肝癌患者经手术切除后均获得病理标本。排除标准:①术前有过肝癌治疗史的;②影像/临床资料不完备或质量未能达标;③患者合并了其他的恶性肿瘤。经过本研究设定的入组标准严格筛选后,最终收集到了59例肝癌患者,年龄36~75岁,中位年龄49岁,包括男性患者36例、女性患者23例。根据最终的随访结果,得出随访期间肝癌术后复发32例、无复发27例。本研究在实施过程中严格遵循医院伦理委员会的规定。
1.2 MSCT扫描参数本研究选用的MSCT扫描仪器为GE64排MSCT(美国,optima CT660),扫描检查前常规禁食约四小时,并于病人肘静脉留置20G套管针。开始扫描时,参数如下:管电压、管电流分别为120 kV、200 mAs,层厚/层间距=0.75 mm/0.75 mm,螺距为1。扫描视野从膈顶至肝脏下缘,包括整个肝脏。增强扫描时,采用碘海醇非离子型对比剂,以高压注射器接肘静脉留置针注射,注射速率为2.5 ml/s,按照1.5 ml/kg的标准确定注射剂量。扫描时相分为动脉期、静脉期以及平衡期,分别为:20~30、60~80、180~200 s。
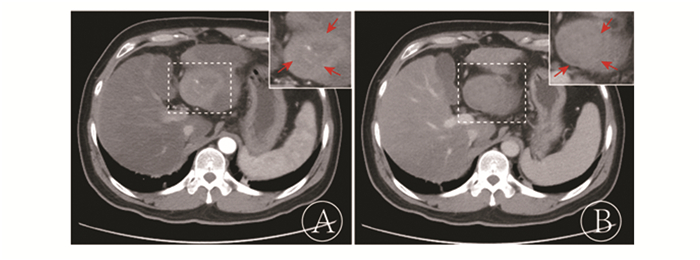
1.3 图像分析处理患者术前MSCT资料由两位分别具有20年及25年腹部影像学诊断经历的高年资放射科医师盲法独立阅片,分别在不同扫描时相(动脉期、静脉期以及平衡期)进行多方位、多层面观察MSCT征象。根据文献报道的几组MSCT征象来诊断肝癌微血管侵犯:①包膜侵犯征(见图 1):MSCT显示瘤灶无包膜或包膜不完整[10-11];②癌周强化征(见图 2):动脉期癌周临近肝组织可见强化,而平衡期强化程度减退或消失[10-11];③癌灶连续多结节征(见图 3):癌灶边缘不光整、可见多个结节凸起[7, 11-12];④弓弦比征(见图 4):当肿瘤贴近肝缘包膜时,测量肿瘤的弓长/弦长(弓弦比),当弓弦比值≤1认为无微血管侵犯征、弓弦比值≥1认为可能存在微血管侵犯征[12-13]。两位医师在所得结果不一致时,经复核协商后达成一致意见。

|
图 3 肝癌瘤灶边缘不清晰,可见多个凸起结节 |

|
图 4 肝癌瘤灶弓弦比>1 |
病理规范化取材参照《原发性肝癌规范化病理诊断指南(2015年版)》[14],对所有病理学标本进行切片镜检。当标本解剖大体病理时,未能在肉眼观察下发现血管内栓塞,而显微镜下观察到微小静脉癌栓时(包括中央静脉或门脉分支、包膜小静脉等),定义为微血管侵犯表现[15],见图 5。

|
图 5 病理标本HE染色(ⅹ100).红箭所示微血管侵犯 |
使用SPSS 16.0软件包,对MSCT肝癌微血管侵犯征象与病理微血管侵犯及肝癌术后复发关系行卡方检验,并计算相应的敏感度、特异度以及准确度。检验值α=0.05,以P<0.05认为差异具有统计学意义。
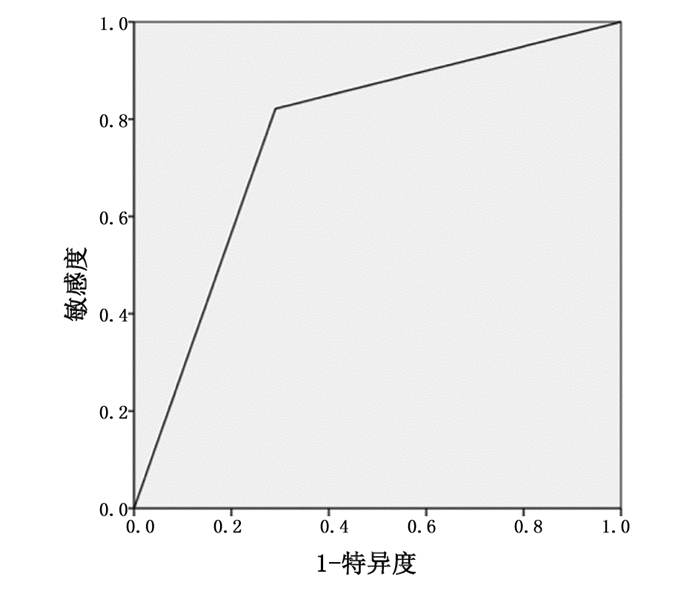
2 结果对照病理结果,术前MSCT诊断为肝癌微血管侵犯的28例患者当中,病理结果显示有3例在显微镜下未见微血管侵犯;而术前MSCT诊断无肝癌微血管侵犯的31例患者当中,病理结果显示有7例存在微血管侵犯。术前MSCT诊断肝癌微血管侵犯的敏感度、特异度以及准确度分别为78.13%、88.89%以及83.05%。入组研究的肝癌患者中术后复发32例、无复发27例,与术前MSCT微血管侵犯征象具有统计学差异(χ2=16.719,P=0.000),以术前MSCT微血管侵犯征象预测肝癌术后复发的敏感度、特异度以及准确度分别为71.88%、81.48%以及76.27%,见表 1、图 6。
|
|
表 1 MVI的MSCT征象与肝癌术后复发的关系 |
|
图 6 术前MSCT征象诊断肝癌术后复发的ROC曲线分析 |
现有的医学研究表明,肝癌的术后复发是一个极为复杂的病理进展过程,该过程涉及到多因素、多步骤的参与。因肝癌术后复发而造成的致死及生存质量的降低,目前仍旧是制约肝癌手术切除治疗效果的一个难题。故而,若能术前准确预测肝癌患者术后的复发,则可提前进行相应干预措施,这对患者的治疗效果的提高及生存预后的改善是有着重大意义的。微血管侵犯的发生是肝癌术后复发的一个重要参与因素,存在微血管侵犯的肝癌患者较之于无微血管侵犯的肝癌患者,其术后的复发率高出4.4倍[16]。目前关于肝癌微血管侵犯的术前影像学诊断,有学者提出了“包膜侵犯”、“癌周强化”、“连续结节”等征象[5-7, 17]。然而,术前影像学对肝癌术后复发的直接证据却鲜有文献报道,因此本文旨在探寻两者的相关性。
参考既往文献,对术前MSCT微血管侵犯征象进行了总结概括:①包膜侵犯:肝癌的包膜从病理学成份来讲,其本质是属于一层纤维囊结构[18],因此完整的包膜是限制肿瘤侵袭的前提条件;当肝癌发生包膜侵犯时,势必导致肿瘤的侵袭性、扩散性相应提升,造成手术切除的难以彻底,成为今后的复发灶。②“癌周强化”:关于这一征象的解释,Matsui等[19]提出了动脉代偿灌注学说,认为当肝癌表现为较强侵袭性时,肿瘤周围组织小静脉易被癌栓闭塞,引起了肝动脉的异常灌注,在MSCT影像学上表现为肝动脉期癌周组织的异常强化。③“连续结节”:这一征象设计到肿瘤的血供情况,当肝癌血供异常丰富时,其生物学异质性以及侵袭性相应提高,故癌灶边缘极易表现为不光整,呈多个结节样改变,这一类型的肝癌亦难以得到彻底的切除根治。④弓弦比征:国内外有文献将计算肿瘤与临近结构交界面的弓弦比作为判断肿瘤侵袭临近组织的一项简单而准确的指标,据此,本研究在以上三点MSCT征象存在争议或无法评估时,引入了肝癌与肝缘包膜交界面弓弦比这一概念,以完善本研究的严谨性,并提出了一项新的辅助量化指标[12-13]。
本研究结果表明,依据术前MSCT征象诊断的肝癌微血管侵犯病例,与术后病理微血管侵犯结果相对比,差异具有统计学意义(P<0.05),该结论与之前文献报道的结果是一致的[5-7, 17]:当肝癌存在微血管侵犯时,会伴随有包膜侵犯、“癌周强化”、“连续结节”以及弓弦比增大等一个或多个征象。当存在这些征象时,往往预示着肿瘤的较强侵袭性,极大提升了其微血管侵袭的风险,这也从另一角度验证了之前所说的临床实用性。本文进一步的研究结果还显示,术前MSCT征象诊断为肝癌微血管侵犯的患者,其术后的复发率显著增加(P<0.05),这也与当下肝癌微血管侵犯易造成早期复发的主流学说大体契合[16]:当肝癌患者伴随有微血管侵犯时,肿瘤很容易发生“潜在转移”的可能,造成手术切除的不彻底,成为术后复发的新病灶。可见,本研究为肝癌复发的提前预判提供了直接影像学证据。
本研究存在一定的局限性:首先,本研究是一项实验参数统一的单中心研究,日后可能会与其他研究机构得出的结论存在小范围的偏差;其次,本研究仅对孤立性肝癌进行入组分析,尚缺乏对多灶性亦或弥漫性病灶的进一步分组研究;再者,本研究病例数尚少,仍有待进一步扩充以获取更丰富的实验结果。尽管如此,本研究结果显示术前MSCT肝癌微血管侵犯征象与肝癌术后复发存在显著相关性,这将对术前治疗方案的制定及预后结局的提前预判有着重要的参考价值。
| [1] |
Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2012, 379(9822): 1245-1255. DOI:10.1016/S0140-6736(11)61347-0 |
| [2] |
Bosch FX, Ribes J, Díaz M, et al. Primary liver cancer:Worldwide incidence and trends[J]. Gastroenterology, 2004, 127(5 Suppl 1): S5-S16. |
| [3] |
Bruix J, Gores GJ, Mazzaferro V. Hepatocellular carcinoma:clinical frontiers and perspectives[J]. Gut, 2014, 63(5): 844-855. DOI:10.1136/gutjnl-2013-306627 |
| [4] |
Mazzaferro V. Resection and liver transplantation for hepatocellular carcinoma[J]. Semin Liver Dis, 2005, 25(2): 181-200. DOI:10.1055/s-2005-871198 |
| [5] |
Chou CT, Chen RC, Lin WC, et al. Prediction of microvascular invasion of hepatocellular carcinoma:preoperative CT and histopathologic correlation[J]. AJR Am J Roentgenol, 2017, 203(3): W253-W259. |
| [6] |
Chou C T, Chen R C, Lee C W, et al. Prediction of microvascular invasion of hepatocellular carcinoma by pre-operative CT imaging[J]. Br J Radiol, 2012, 85(1014): 778-83. DOI:10.1259/bjr/65897774 |
| [7] |
张俊. 术前CT肿瘤形态检查对肝细胞癌微血管侵犯的预测价值[J]. 肝脏, 2015(10): 793-796. DOI:10.3969/j.issn.1008-1704.2015.10.012 |
| [8] |
Bruix J, Sherman M. Practice Guidelines Committee, American Association for the Study of Liver Diseases[J]. Hepatology, 2005, 53: 1208-1236. |
| [9] |
Cucchetti A, Ercolani G, Vivarelli M, et al. Is portal hypertension a contraindication to hepatic resection?[J]. Ann Surg, 2009, 250(6): 922-928. DOI:10.1097/SLA.0b013e3181b977a5 |
| [10] |
Chou CT, Chen RC, Lin WC, et al. Prediction of microvascular invasion of hepatocellular carcinoma:preoperative CT and histopathologic correlation[J]. AJR Am J Roentgenol, 2017, 203(3): W253-W259. |
| [11] |
Chou C T, Chen R C, Lee C W, et al. Prediction of microvascular invasion of hepatocellular carcinoma by pre-operative CT imaging[J]. Br J Radiol, 2012, 85(1014): 778-83. DOI:10.1259/bjr/65897774 |
| [12] |
Banerjee S, Wang D S, Kim H J, et al. A computed tomography radiogenomic biomarker predicts microvascular invasion and clinical outcomes in hepatocellular carcinoma[J]. Hepatology, 2015, 62(3): 792-800. DOI:10.1002/hep.27877 |
| [13] |
左阳, 苏丹柯, 赖少侣, 等. MDCT动态增强扫描测量肝癌与膈肌交界面弓弦比对膈肌侵犯的诊断价值[J]. 中国癌症防治杂志, 2015, 7(3): 206-209. DOI:10.3969/j.issn.1674-5671.2015.03.14 |
| [14] |
中国抗癌协会肝癌专业委员会, 中华医学会肝病学分会肝癌学组, 中国抗癌协会病理专业委员会, 等. 原发性肝癌规范化病理诊断指南(2015年版)[J]. 中华肝胆外科杂志, 2015, 21(3): 145-151. DOI:10.3760/cma.j.issn.1007-8118.2015.03.001 |
| [15] |
金赟, 李江涛. 肝癌细胞侵犯微血管的临床相关因素及分子标志物的研究进展[J]. 临床肝胆病杂志, 2013, 29(7): 550-553. DOI:10.3969/j.issn.1001-5256.2013.07.020 |
| [16] |
Zimmerman M A, Ghobrial R M, Tong M J, et al. Recurrence of hepatocellular carcinoma following liver transplantation:a review of preoperative and postoperative prognostic indicators[J]. Arch Surg, 2008, 143(2): 182-188. DOI:10.1001/archsurg.2007.39 |
| [17] |
Renzulli M, Brocchi S, Cucchetti A, et al. Can Current Preoperative Imaging Be Used to Detect Microvascular Invasion of Hepatocellular Carcinoma[J]. Radiology, 2016, 279(2): 432-442. DOI:10.1148/radiol.2015150998 |
| [18] |
Ng IO, Lai EC, Ng MM, et al. Tumor encapsulation in hepatocellular carcinoma. A pathologic study of 189 cases[J]. Cancer, 1992, 70(1): 45-49. DOI:10.1002/(ISSN)1097-0142 |
| [19] |
Matsui O, Kobayashi S, Sanada J, et al. Hepatocelluar nodules in liver cirrhosis:hemodynamic evaluation (angiography-assisted CT) with special reference to multi-step hepatocarcinogenesis[J]. Abdom Imaging, 2011, 36(3): 264-272. DOI:10.1007/s00261-011-9685-1 |
| [20] |
李金平, 李大庆, 张金玲, 等. 肝癌边缘双期CT强化特征与组织病理学的相关性[J]. 哈尔滨医科大学学报, 2012, 46(3): 285-289. DOI:10.3969/j.issn.1000-1905.2012.03.022 |